Сапонины
Сапонины — сложные безазотистые[1] органические соединения из гликозидов растительного происхождения с поверхностно-активными свойствами. Растворы сапонинов при взбалтывании образуют густую стойкую пену. Название происходит от латинского sapo (род. падеж saponis) — мыло[2]. Широко распространены в природе, встречаются в различных частях растений — листьях, стеблях, корнях, цветах, плодах[3]. Содержат агликон (сапогенин) и углеводную часть[2].
Для выделения группы сапонинов из других вторичных метаболитов используются свойства поверхностной активности и гемолитической активности. Однако не все сапонины могут ими обладать. Поэтому вещества могут помещать в группу сапонинов на основе структурной формулы (стероидные и терпеноидные гликозиды)[4].
Из-за сапониновых свойств (поверхностная и гемолитическая активность, образование комплексов с холестерином) к сапонинам часто относят также гликозиды азотсодержащих стероидных алкалоидов (гликоалкалоиды)[5].
Многие сердечные гликозиды (карденолиды) дают пену в водных растворах, однако из-за специфических биологических свойств к сапонинам не относятся, а рассматриваются отдельно[6].
Физические свойства
Сапонины — бесцветные или желтоватые аморфные вещества без характерной температуры плавления (обычно с разложением). Оптически активны[2]. Гликозиды растворимы в воде и спиртах, нерастворимы в органических растворителях; свободные сапогенины, наоборот, не растворяются в воде и хорошо растворимы в органических растворителях. В кристаллическом виде получены представители, которые имели в своем составе не более 4 моносахаридных остатков. С увеличением количества моносахаридов повышается растворимость сапонинов в воде и других полярных растворителях. Сапонины с 1—4 моносахаридными остатками в воде растворяются плохо.
Специфическим свойством сапонинов является их способность снижать поверхностное натяжение жидкостей (воды) и давать при встряхивании стойкую обильную пену.
Агликоны сапонинов (Сапогенины), как правило, являются кристаллическими веществами с чёткой температурой плавления, и в отличие от сапонинов, не обладают гемолитической активностью и не токсичны для рыб[7].
Химические свойства
Химические свойства сапонинов обусловлены структурой агликона, наличием отдельных функциональных групп, а также присутствием гликозидной связи.
Сапонины делят на нейтральные (стероидные и тетрациклические тритерпеновые) и кислые (пентациклические тритерпеновые) соединения. Их кислотность обусловлена наличием карбоксильных (-СООН) групп в структуре агликона и присутствием уроновых кислот в углеводной цепи[8]. Гидроксильные группы могут быть ацилированы уксусной, пропионовой, ангеликовой и др. кислотами[9].
Кислые сапонины образуют соли, растворимые с одновалентными и нерастворимые с двухвалентными и многовалентными металлами[8]. При взаимодействии с кислотными реагентами (SbCl3, SbCl5, FеСl3, конц. H2SO4) образуют окрашенные продукты[10][11].
Сапонины гидролизуются под влиянием ферментов и кислот. Производные с О-ацилгликозидными связями гидролизуются под воздействием щелочей[8].
Многие сапонины образуют молекулярные комплексы с белками, липидами, стеринами, танинами[8].
Разновидности агликонов
В зависимости от химического строения агликона все сапонины классифицируют на стероидные и тритерпеновые. Стероидные сапонины синтезируются из холестерина и содержат 27 атомов углерода[12]. Тритерпеновые сапонины синтезируются напрямую из сквалена, при этом во время их циклизации не происходит потерь атомов углерода, они содержат по 30 атомов углерода[7].
Стероидные сапонины
Стероидные сапонины в качестве сапогенинов содержат обычно производные спиростана или фуростана. Поскольку они, как правило, являются производными спиртов, содержащих в 3-м положении гидроксил, то их называют спиро- и фуростаноловыми гликозидами[13].
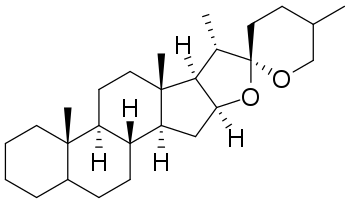
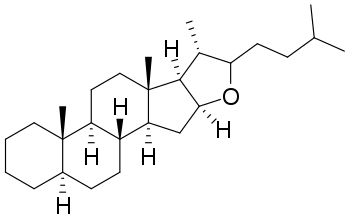
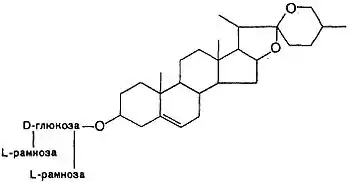
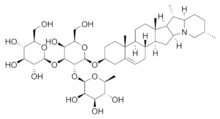
Спиростаноловые сапогенины, в основном, содержат 27 атомов углерода. Углеводная часть молекулы стероидных сапонинов присоединяется к 3-гидроксилу и может содержать 1-6 моносахаридов (D-глюкоза, D-галактоза, D-ксилоза, L-рамноза, L-арабиноза, галактуроновая и глюкуроновая кислоты). Известны сапонины, содержащие остатки D-хиновозы, D-апиозы и D-фукозы. Моносахариды могут образовывать как линейные, так и разветвленные цепи. Встречаются также гликозиды с углеводным компонентом при атомах С-1, С-2, С-5, С-6, С-11. Углеводных цепей может быть одна (вещества называются монодесмозиды), две (бидесмозиды)[14], редко три (тридесмозиды)[15]. Ацильная группа (остатки уксусной, бензойной, 2-гидрокси-2-метилглутаровой, серной кислот) может находиться как в сапогенной, так и в углеводной частях молекулы[14]. Некоторые спиростанолы образуют труднорастворимые комплексы с холестерином[16]
Один из важных представителей спиростаноловых гликозидов — диосцин, состоящий из сапогенина диосгенина и трёх гликозидов в разветвлённой цепи. Диосцин, в частности, содержится в корневищах видов диоскореи Dioscorea [17]. Диосгенин играет важную роль в фармацевтике, как сырьё для производства кортикоидных препаратов[18].
Сапонины ряда фуростанола, как правило, содержат углеводную цепь при С-3 и остаток D-глюкозы при С-26[14]. Отщепление остатка сахара от С-26 под действием кислот или ферментов приводит к спиростаноловым сапонинам[19]. Фуростанолы не осаждают холестерин[16], обладают повышенной по сравнению со спиростанолами гидрофильностью[20] и пониженной поверхностной активностью[16].
Для спиростаноловых сапонинов характерно гемолитическое, гипохолестеринемическое, канцеролитическое, а также фунгицидное, антимикробное[21], моллюскоцидное действие[22]. У фуростаноловых гораздо слабее выражена гемолитическая[23] и фунгицидная активность[24], зато повышены антиоксидантные свойства[22]; они обладают иммуномодулирующими и анаболическими свойствами[25]. Фуростаноловые и спиростаноловые гликозиды влияют на репродуктивную систему животных, оказывая как стимулирующее, так и контрацептивное действие[26].
Стероидные гликозиды — способ защиты растений от патогенов[27]. Фуростаноловые гликозиды повышают всхожесть, скорость прорастания растений и устойчивость их к биотическим и абиотическим стрессам[28], изменяют состав каротиноидных пигментов фотосинтеза[29].
Стероидные гликозиды синтезируются в листьях растений в фуростаноловой форме. Затем они транспортируются по всему растению и накапливаются в идиобластах (специализированных клетках) эпидермиса листьев и стеблей. Основная масса гликозидов транспортируется в корневище (орган вегетативного размножения), где гликозидаза переводит их в спиростаноловую (активную) форму. В надземных органах гликозидаза располагается поблизости от идиобластов (в мезофилле). При повреждении ткани быстро образуются спиростаноловые гликозиды. Таким образом, при защите от патогенов в надземных органах работает стратегия полуиндуцибельных защитных соединений[30].
Стероидные гликозиды могут применяться как основа для синтеза лекарственных стероидных гормонов[31], как гербициды, антигрибные и антидрожжевые препараты (а также консерванты пищевых продуктов, содержащих грибы), эмульгаторы и пенообразователи[32].
Тритерпеновые сапонины
Тритерпеновые сапонины содержат 30 атомов углерода и отличаются большим разнообразием химических структур (среди тритерпеноидов выделяют не менее 30 групп[33]). В зависимости от количества пяти- и шестичленных колец в структуре агликона их можно разделить на 2 группы[34]:
а) тетрациклические — содержат в структуре агликона 4 углеродных кольца;
б) пентациклические — содержат в структуре агликона 5 углеродных колец.
Тетрациклические тритерпеновые гликозиды
Тетрациклические сапонины относятся к группам даммарана, циклоартана, ланостана, кукурбитана[35] и др.
| Структурная основа | Даммаран | Циклоартан | Ланостан | Кукурбитан |
|---|---|---|---|---|
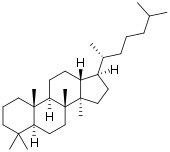 | 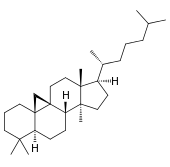 |  | 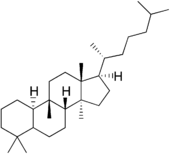 | |
| Химическая основа | Даммарандиол | Циклоартенол | Ланостерол | |
 | 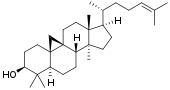 |  |
Производные даммарана
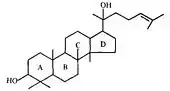
Эти соединения обнаружены в женьшене[36], березе[37][38]. Гликозиды женьшеня являются производными двух агликонов: панаксадиола и панаксатриола[39].
 |  |
| Общая формула веществ на основе протопанаксадиола. R1 — углевод, R2 — Н или углеводы. | Общая формула веществ на основе протопанаксатриола. R1 — углевод, R2, R3 — Н или углеводы |
 |  |
| Панаксадиол | Панаксатриол |
Вначале синтезируются гликозиды на основе протопанаксодиола и протопанаксотриола. При кислом гидролизе происходит отщепление углевода R2, боковая цепь замыкается в гетероцикл, образуются панаксадиол и панаксатриол[40].
Гликозиды женьшеня содержат в углеводных цепях от 3 до 6 моносахаридных остатков (глюкозы, рамнозы, арабинозы, ксилозы). Почти все гликозиды имеют по 2 углеводные цепи, соединенные с агликоном обычными гликозидными связями. Это их отличает от типичных пентациклических тритерпеновых сапонинов, в которых (при наличии двух углеводных цепей) одна присоединяется О-ацил-гликозидной связью[39].
Сапонины женьшеня в России называют панаксозидами, а в Японии — гинзенозидами[36], по латинскому названию женьшеня Panax ginseng.
Как лекарственное растение женьшень известен на Востоке более 1000 лет. Корень женьшеня применяют как стимулирующее и тонизирующее средство. Показано влияние женьшеня на реактивность организма, обмен веществ, гонадотропное и антидиуретическое действие[41]. Ряд панаксозидов стимулируют синтез инсулина в β-клетках поджелудочной железы у мышей с диабетом[42].
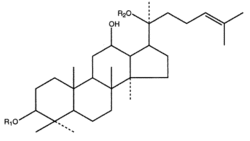
Производные циклоартана
Гликозиды производных циклоартана обнаружены в растениях, принадлежащих большей частью к семействам Лютиковых:
- василистник — таликтозиды, циклофоэтозиды, скваррозиды;
- цимицифуга — шенгманол, цимигенол, дагуринол;
- воронец (растение);
- Beesia — бизиозиды;
и Бобовых:
- астрагалус — астрагалозиды, орбикозиды;
- абрус — абрузозиды;
- остролодочник.
Производные циклоартана встречаются в семействах Мареновых (муссенда) и Страстоцветных: страстоцветы — квадрангулозид, пассифлорин[43][44].
Углеводными их компонентами являются D-ксилоза, D-глюкоза, D-галактоза, L-арабиноза, L-рамноза; пентозы встречаются чаще, чем гексозы. Циклоартановые чаще встречаются в форме би- и тридесмозидов.
Растения родов Цимицифуга и Астрагалус издавна используются в народной медицине, для получения успокоительных и гипотензивных средств. Растения рода Астрагалус используются и в научной медицине. Показана гипохолестеринемическая, гипотензивная, диуретическая, кардиотоническая и антивоспалительная активность астрагалозидов.[45]
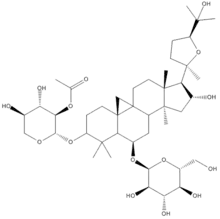
Производные ланостана
Поскольку ланостерол — одно из промежуточных соединений при синтезе стероидных веществ, то ряд веществ со структурой на основе ланостана иногда выделяют в отдельные группы (например, голостаны).
Голостаны — производные ланостана, имеющие в структуре лактонное кольцо. Они обнаружены в морских организмах отряда Голотурий (морские огурцы). Среди голостанов часто встречаются сульфатированные формы; в углеводной части присутствуют фукоза и хиновоза, метилглюкоза и метилксилоза. Голотоксины, голотурины, эхинозиды и др. служат защитой от морских хищников, показана также их антимикотическая активность.[46][47]
Ланостановые гликозиды эрилозиды обнаружены в губках Erylus[48].
Ланостановые производные содержатся и в растениях. В эвкомисе, пролеске, хионодоксе, Muscari paradoxum обнаружены сцилласапонины; ланостановые гликозиды хионодоксы и Muscari обладают цитотоксичностью[49]; марианозиды расторопши пятнистой способны ингибировать протеазу химотрипсин[50].
Ряд ланостановых гликозидов обнаружен в грибах: лэтипозиды из Laetiporus versisporus[51], аскостерозид из Ascotricha amphitricha имеет антимикотическую активность[52], фомитозиды из трутовика окаймлённого проявляют антивоспалительные свойства[53], для дедалиозидов из дедалеи Дикенса показана цитотоксичность к опухолевым клеткам[54].
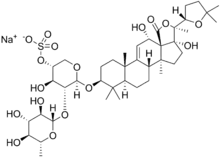
Производные кукурбитана
В бахчевых культурах и других растениях семейства Cucurbitaceae содержатся сапонины тритерпенового ряда, обладающие горьким неприятным вкусом. Сапогенины этих сапонинов — кукурбитацины[2].

Кукурбитановые — довольно сильно окисленные агликоны и гликозиды. Циклы и боковые цепи содержат много кислородсодержащих функциональных групп.
Кукурбитацины известны своими вкусовыми свойствами. Глюкозиды обычно безвкусны, но могут иметь и сладкий вкус (например, могрозиды из Sirattia grosvenori[55]). Агликоны очень горькие, выполняют функцию репеллентов (хотя некоторые насекомые, приспосабливаясь, используют их как пищевые аттрактанты и стимуляторы).[56]
Кукурбитацины обнаружены в ряде других семейств растений, у нескольких родов грибов и в морском моллюске[каком?]. Кукурбитацины обладают широким спектром биологических свойств (противоопухолевые, противозачаточные, антивоспалительные, антимикробные и антигельминтовые и др.) Однако из-за своей неспецифической токсичности в традиционной медицине они имеют ограниченное применение.[57]
Пентациклические тритерпеновые гликозиды
Пентациклические тритерпеновые сапонины содержатся не менее чем в 70 семействах, типичны более чем для 150 родов[7].
Пентациклические агликоны делят на группы производных различных структур. Наиболее распространены производные олеанана, урсана и лупана[58] (приводятся также структуры гопана и фриделина).
| Структурная основа | Урсан | Олеанан | Лупан | Гопан | Фриделин |
|---|---|---|---|---|---|
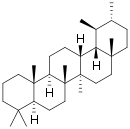 |  | 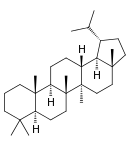 |  |  | |
| Химическая основа | α-амирин | β-амирин | Лупеол | ||
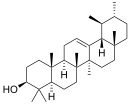 | 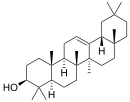 | 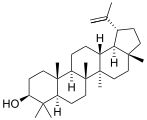 |
Из функциональных групп у них встречаются гидроксильные, карбоксильные, альдегидные, лактонные, эфирные и карбонильные группы. Двойная связь наиболее часто встречается в положении 12—13[34].
У производных β-амирина, α-амирина и лупеола, если имеется один гидроксил, то он находится у С-3, у фриделина в положении 3 — карбонильная группа. Карбоксильная группа, если она одна, чаще всего бывает у С-28, но может быть и при других углеродных атомах. Отдельные сапогенины могут иметь одновременно разные функциональные группы. Сапогенины, содержащие альдегидную, лактонную группы или сложноэфирные связи, неустойчивы и могут изменяться уже в процессе выделения из растений[34].
Углеводная часть тритерпеновых сапонинов обычно присоединяется к агликону в 3 положении за счет гидроксильной (-ОН) группы, в 28 положении за счет карбоксильной (-СООН) группы (ацилгликозидная связь)[59]; распространены бидесмозиды[60], известны тридесмозиды[61]. Углеводная часть тритерпеновых гликозидов может содержать 1-11[59] моносахаридов (D-глюкоза, D-галактоза, D-ксилоза, L-рамноза, L-арабиноза, L-фукоза, D-глюкуроновая и D-галактуроновая кислоты). Она может быть линейной и разветвленной. Разветвление углеводной цепи происходит от первого сахарного остатка, связанного с агликоном[34]. У фриделинов гликозидных форм не обнаружено[35].
Возможно, для биосинтеза фриделиновых тритерпеноидов исходным соединением является β-амирин; при этом происходит серия миграций метильных групп и водородных атомов от кольца А[7].
Производные олеанана
Большинство пентациклических тритерпеновых сапонинов относится к типу β-амирина, в основе которого лежит углеродный скелет олеанана.
| Сапогенин | Пример гликозида |
|---|---|
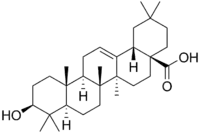
| Олеаноловая кислота | Аралозид A |
 | 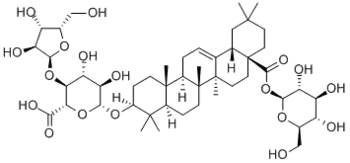 |
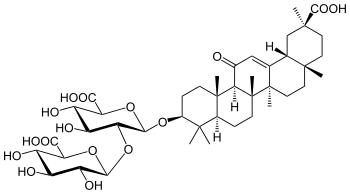
| Глицерритиновая кислота | Глицирризиновая кислота |
 |  |
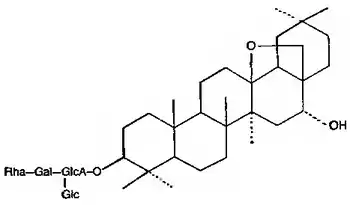
| Протопримулагенин А | Примуловая кислота I |
 |  |
| Эсцин | |
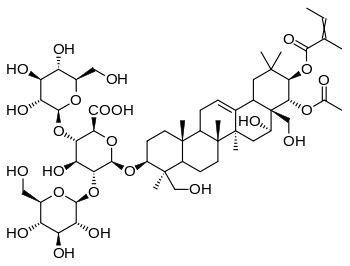 | |
| Полигаловая кислота | Сенегин II |
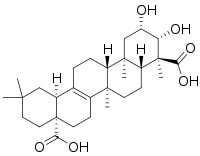 |  |
Одним из наиболее распространённых представителей является олеаноловая кислота[58]. Олеаноловая кислота является агликоном аралозидов аралии манчжурской[62], сапонинов календулы лекарственной[63], патринии средней[64][65].
Другим фармакологически значимым основанием является глицирретиновая кислота. Глицирретиновая кислота является агликоном глицирризиновой кислоты (в 3 положении присоединяется углеводная цепь из двух молекул глюкуроновой кислоты). Глицирризиновая кислота содержится в солодке голой и солодке уральской. Препараты на основе глицирризиновой кислоты используются при гипофункции коры надпочечников [66].
β-амирин также является структурной основой эсцина (конский каштан)[67], примуловой кислоты (первоцвет весенний)[68], полигаловой (от Polygala — истод) кислоты и сенегинов истода[69], сапонинов синюхи голубой[70].
Производные урсана
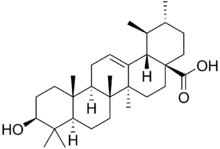
α-амирин лежит в основе различных соединений, которые содержатся в почечном чае (ортосифон тычиночный)[71], лапчатке прямостоячей[72][73][74]. Одним из наиболее важных представителей является урсоловая кислота.
Урсоловая кислота обнаружена не менее, чем в сотне растений[75], в том числе бруснике обыкновенной[76], клюкве болотной[77], причем встречается как в виде гликозидов, так и свободного агликона[76]. Известны её антимикробные, гепатопротекторные, антивоспалительные, антиаллергические, антивирусные, цитотоксические, противоопухолевые свойства.[75]
Производные лупана
Кроме лупеола, к лупановым производным относятся бетулин и бетулиновая кислота.
| Бетулин | Бетулиновая кислота |
|---|---|
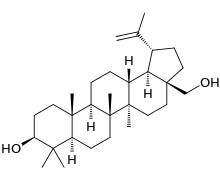 | 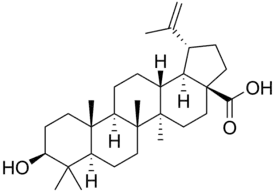 |
Бетулин содержится в коре берёзы, он обеспечивает её белый цвет. Обнаружен бетулин и в других растениях семейства берёзовых (лещине, грабе, ольхе). Является ценным компонентом косметических продуктов.
Бетулиновая кислота также обнаруживается во многих видах растений, однако, в небольших концентрациях. Показана её избирательная противоопухолевая активность. Бетулиновая кислота и её производные защищают клетки от репликации ВИЧ.
Лупеол, бетулин и бетулиновая кислоты обладают противовоспалительной активностью, возможно, вследствие того, что лупановые производные способны взаимодействовать с глюкокортикоидными рецепторами.[78]
Гликоалкалоиды
Стероидные алкалоиды представляют собой химические вещества, в основе которых лежат стероидные соединения. Однако в структуре их гетероциклов присутствует атом азота, что обеспечивает им щелочные свойства. Гликоалкалоиды (гликозиды стероидных алкалоидов) обнаружены, в основном, в семействе Паслёновые (картофель, томаты) и найдены у представителей семейства Лилейные (чемерица, рябчик).
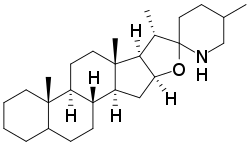
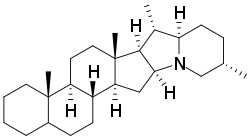
По структуре агликонов у стероидных алкалоидов выделяют группы спиросолановых и соланидановых алкалоидов. Атом азота в них является вторичным (спиросоланы) или третичным (соланиданы). Спиросоланы являются азотными аналогами спиростанов; у соланиданов атом азота входит в индолизидиновую структуру. Углеводные части некоторых гликоалкалоидов получили собственные тривиальные названия.
| Спиросолан | Соланидан |
|---|---|
 |  |
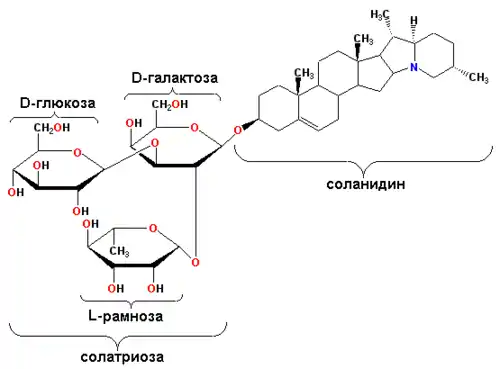
Примером гликоалкалоида картофеля служит соланин (генин — соланидин).
| Соланин |
|---|
 |
Другим гликозидом соланидина является хаконин (гликозидная часть — β-хакотриоза — состоит из двух рамноз и одной глюкозы). Хакотриоза и солатриоза являются также углеводными компонентами лептининов и лептинов у соланидановых агликонов лептинидина и ацетил-лептинидина соответственно.
Спиросолановый агликон картофеля — соласодин, его гликозиды — соласонин (глюкоза, рамноза и галактоза), соламаргин (две рамнозы и одна глюкоза), содержатся в видах рода Solanum, солаплюмбин (глюкоза и рамноза) обнаружен у Nicotiana plumbaginifolia.
Томатидин — спиросолановый агликон, обнаруженный в томатах и картофеле. Его производным является томатин (ксилоза, 2 глюкозы и галактоза). Такой же углеводный остаток (β-ликотетраоза) у демиссина, производного соланиданового агликона демиссидина.
Известна токсичность гликоалкалоидов для человека. Гидролиз их в желудочно-кишечном тракте приводит к формированию безвредных агликонов. В случае же их прямого введения их эффект сходен с действием сердечных гликозидов, они могут привести к параличу нервной системы и смерти. Они не уничтожаются при кипячении, жарке или высушивании при высоких температурах. Наибольшие их количества содержатся в зелёных клубнях, листьях и плодах.
Гликоалкалоиды обладают фунгицидными (томатин, соланин), моллюскоцидными (томатин, соласонин, соламаргин), инсектицидными (демиссин, томатин, соланин, хаконин, лептины, соламаргин, соласонин), противоопухолевыми (соламаргин, соласонин, соланин, солаплюмбин), антивоспалительными (соласодин, томатин) свойствами.[79]
Биосинтез сапонинов
Биосинтез сапонинов происходит по изопреноидному пути синтеза тритерпенов и стероидов (см. Биосинтез холестерина). 3 изопреновых 5-углеродных единицы соединяются «голова-к-хвосту» в 15-углеродный фарнезилдифосфат. Два фарнезилдифосфата затем объединяются «хвост-к-хвосту» в 30-углеродный сквален. Сквален затем окисляется до оксидосквалена. Эта точка является исходной для многочисленных реакций циклизации тритерпеноидного биосинтеза. Оксидосквален циклизуется после протонирования и раскрытия эпоксидного кольца. В результате образуется карбокатион, подвергающийся циклизации и последующим перестройкам: гидридным сдвигам и метильным миграциям, в результате которых образуются новые карбокатионы. Нейтрализация карбокатионов происходит при удалении протона — образуется двойная связь или циклопропановое кольцо, а также при реакции с водой — образуется гидроксильная группа. Конкретные типы скелетов и их стереохимия определяются участвующими в реакциях типами циклаз: циклоартенолсинтаза, ланостеролсинтаза, β-амиринсинтаза и др.[35]
Физиологическое действие
Гемолитическая активность
Исследования сапонинов класса естественных продуктов показали их комплексообразование с холестерином, с формированием поры в двойных слоях мембраны клетки, например, в мембране эритроцита. Такое комплексообразование приводит к гемолизу при внутривенной инъекции. Оболочка из полупроницаемой становится проницаемой. Гемоглобин свободно поступает в плазму крови и растворяется в ней. На проницаемость мембран и гемолитическую способность влияет структура сапонина, количество и строение активных групп[80]. Усиливают проникновение белков и других макромолекул через клеточные мембраны[81].
Гемолитической активностью обладают только гликозиды[7]. При попадании в кровь сапонины токсичны, поскольку вызывают гемолиз эритроцитов. При приеме внутрь, как правило, менее токсичны[82] вследствие гидролиза гликозидов; однако сапонины мыльного дерева (Sapindus) при проглатывании могут вызвать у некоторых людей крапивницу.
Токсичность для жабродышащих
Сапонины высокотоксичны для животных, дышащих жабрами. Они нарушают функцию жабр, которые являются не только органом дыхания, но и регулятором солевого обмена и осмотического давления в организме[8][83]. Сапонины парализуют или вызывают гибель холоднокровных животных даже в больших разведениях (1:1 000 000)[84]. Агликоны сапонинов для холоднокровных животных не токсичны[7]. Рыба, отравленная сапонинами, остается съедобной. Эсцин и прочие сапонины конского каштана не токсичны для рыб.
Влияние на растительные организмы
Сапонины могут оказывать влияние на проницаемость растительных клеток. Определённые концентрации сапонинов ускоряют прорастание семян, рост и развитие растений, а в увеличенных концентрациях могут их тормозить. Особую роль выполняют в растениях фриделиновые тритерпены (фриделин, церин), поскольку они содержатся в лубе растений[7].
Другие воздействия на человеческий организм
Сапонины оказывают раздражающее действие на слизистые оболочки глаз, носа, полости рта[8]. При легком раздражающем действии сапонинов происходит усиление секреции всех желез, что благоприятно сказывается на бронхах — ведет к разжижению мокроты, что облегчает и её эвакуацию[85]. Вместе с тем избыток сапонинов приводит к раздражению слизистой желудка и кишечника, они могут быть токсичными — вызывают тошноту, рвоту, диарею, головокружение[8].
Кардиотоническим, нейротрофным, гипотензивным и тоническим действием обладают аралозиды, календулозиды, патризиды, клематозиды[86].
Сапонины различных растений обладают и другими лекарственными действиями: гипохолестеринемическое и противосклеротическое, диуретическое[85]; кортикотропное[86]; адаптогенное, седативное[87]; противоязвенное[88]; легкое слабительное[68]. Кроме того, в присутствии сапонинов некоторые другие лекарственные вещества легче всасываются[89].
Применение
Благодаря способности сапонинов образовывать обильную пену, они находят некоторое применение в качестве детергентов и пенообразующих агентов в огнетушителях. Эмульгирующие свойства сапонинов широко используются для стабилизации разных дисперсных систем (эмульсий, суспензий). Их используют при приготовлении халвы и других кондитерских изделий, пива и иных шипучих напитков. Благодаря эмульгирующим свойствам сапонины оказывают моющее действие, но их отличает от анионных мыл отсутствие щелочной реакции[90].
Сапонины производятся коммерчески как пищевые и диетические добавки. В терапевтической практике используются как отхаркивающие, мочегонные, тонизирующие, седативные средства, применяются как вспомогательные средства в вакцинах. При этом токсичность, связанная с комплексообразованием стерола (стерина), остаётся главной проблемой.[91] Необходима большая осторожность в оценке терапевтической пользы при употреблении естественных продуктов, содержащих сапонин-разновидности.
Примечания
- Сапонины — статья из Большой советской энциклопедии.
- Горовиц, 1995.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002.
- Hostettmann K., Marston A., 1995, p. 1.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 457.
- Hostettmann K., Marston A., 1995, p. 5.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 322.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 321.
- Hostettmann K., Marston A., 1995, p. 60.
- Коренская И. М., Ивановская Н. П., Колосова О. А., Измалкова И. Е., Мальцева А. А. Биологически активные вещества¸ входящие в состав растительного сырья. Учебное пособие для вузов. — Воронеж: ИПЦ Воронежского государственного университета, 2010. — С. 19. — 66 с. (недоступная ссылка)
- Hostettmann K., Marston A., 1995, p. 124.
- Васильева И. С., Пасешниченко В. А., 2000, с. 175.
- Васильева И. С., Пасешниченко В. А., 2000, с. 155.
- Васильева И. С., Пасешниченко В. А., 2000, с. 156.
- Watanabe Y., Sanada S., Ida Y., Shoji J. Comparative Studies on the Constituents of Ophiopogonis Tuber and Its Congeners. III. Studies on the Constituents of the Subterranean Part of Ophiopogon ohwii OKUYAMA and O. jaburan (KUNTH) LODD (англ.) // Chem. Pharm. Bull. — 1984. — Т. 32, № 41(3). — С. 566—570. — ISSN 1347-5223. — doi:10.1248/cpb.41.566. (недоступная ссылка)
- Васильева И. С., Пасешниченко В. А., 2000, с. 186.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 317.
- Васильева И. С., Пасешниченко В. А., 2000, с. 159.
- Васильева И. С., Пасешниченко В. А., 2000, с. 157.
- Lazur'evskii G. V., Kintya P. K., Pukhal'skaya E. Ch., Sofina Z. P. Structure and activity of steroidal glycosides (англ.) // Pharmaceutical Chemistry Journal. — 1978. — Т. 11, № 6. — С. 749—757. — ISSN 0091-150X. — doi:10.1007/BF00779287. (недоступная ссылка), p. 751
- Васильева И. С., Пасешниченко В. А., 2000, с. 185.
- Васильева И. С., Пасешниченко В. А., 2000, с. 189.
- Lazur'evskii G. V., Kintya P. K., Pukhal'skaya E. Ch., Sofina Z. P. Structure and activity of steroidal glycosides (англ.) // Pharmaceutical Chemistry Journal. — 1978. — Т. 11, № 6. — С. 749—757. — ISSN 0091-150X. — doi:10.1007/BF00779287. (недоступная ссылка), p.756.
- Васильева И. С., Пасешниченко В. А., 2000, с. 187.
- Васильева И. С., Пасешниченко В. А., 2000, с. 191.
- Васильева И. С., Пасешниченко В. А., 2000, с. 190.
- Васильева И. С., Пасешниченко В. А., 2000, с. 188.
- Васильева И. С., Пасешниченко В. А., 2000, с. 192.
- Васильева И. С., Пасешниченко В. А., 2000, с. 193.
- Физиология растений / под ред. И. П. Ермакова. — М.: ИЦ Академия, 2005. — 640 с., стр. 617
- Schwarz M. W. Saponins (англ.) // Ulmann's Encyclopedia of Industrial Chemistry. — 2012. — Т. 32. — С. 177—191. — doi:10.1002/14356007.a23_485.
- Васильева И. С., Пасешниченко В. А., 2000, с. 196.
- Mahato S. B., Nandy A. K., Roy G. Triterpenoids (англ.) // Phytochemistry. — 1992. — Т. 31, № 7. — С. 2199—2249. — doi:10.1016/0031-9422(92)83257-Y.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 320.
- Vinken J. P., Heng L., de Groot A., Gruppen H. Saponins, classification and occurance in plant kingdom (англ.) // Phytochemistry. — 2007. — Т. 68. — С. 275—297. — doi:10.1016/j.phytochem.2006.10.008.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 343.
- Rickling B., Glombitza K. W. Saponins in the leaves of birch? Hemolytic dammarane triterpenoid esters of Betula pendula (англ.) // Planta Medica. — 1993. — Т. 59. — С. 76—79. — doi:10.1055/s-2006-959609. (недоступная ссылка)
- Xiong J., Taniguchi M., Kashiwada Y., Yamagishi T., Takaishi Y. Seven new dammarane triterpenes from the floral spikes of Betula platyphylla var. japonica (англ.) // Journal of natural medicines. — 2011. — Т. 65. — С. 217—223. — doi:10.1007/s11418-010-0462-1. (недоступная ссылка)
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 344.
- Hostettmann K., Marston A., 1995, p. 57.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 345.
- Kimura M., Waki I., Chujo T., Kikuchi T., Hiyama C., Yamazaki K., Tanaka O. Effects of hypoglycemic components in ginseng radix on blood insulin level in alloxan diabetic mice and on insulin release from perfused rat pancreas (англ.) // J Pharmacobiodyn. — 1981. — Т. 4, № 6. — С. 410—417.
- Hostettmann K., Marston A., 1995, p. 43—49.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 346.
- Isaev M. I., Gorovits M. B., Abubakirov N. K. Triterpenoids of the cycloartane series (англ.) // Chemistry of Natural Compounds. — 1985. — Т. 21, № 4. — С. 399—447. — doi:10.1007/BF00579134. (недоступная ссылка)
- Kitagawa I., Kobayashi M., Inamoto T., Fuchida M., Kyogoku Y. Marine natural products. XIV. Structures of echinosides A and B, antifungal lanostane-oligosides from the sea cucumber Actinopyga echinites (Jaeger). (англ.) // Chem Pharm Bull (Tokyo). — 1985. — Т. 33, № 12. — С. 5214—5224. — ISSN 1347-5223. — doi:10.1248/cpb.33.5214. (недоступная ссылка)
- Hostettmann K., Marston A., 1995, p. 106.
- Shin J., Lee H.-S., Woo L., Rho J.-R., Seo Y., Cho K. W., Sim C. J. New Triterpenoid Saponins from the Sponge Erylus nobilis (англ.) // J. Nat. Prod. — 2001. — Т. 64, № 6. — С. 767–771. — doi:10.1021/np010047d.
- Ori K., Kuroda M., Mimaki Y., Sakagami H., Sashida Y. Lanosterol and tetranorlanosterol glycosides from the bulbs of Muscari paradoxum (англ.) // Phytochemistry. — 2003. — Т. 64, № 8. — С. 1351–1359. — doi:10.1016/S0031-9422(03)00498-9.
- Ahmed E., Malik A., Ferheen S., Afza N., Azhar-ul-Haq, Lodhi M. A., Choudhary M. I. Chymotrypsin Inhibitory Triterpenoids from Silybum marianum (англ.) // CHEMICAL & PHARMACEUTICAL BULLETIN. — 2006. — Т. 54, № 1. — С. 103—106. — ISSN 1347-5223. — doi:10.1248/cpb.54.103. (недоступная ссылка)
- Yoshikawa K., Matsumoto K., Mine C., Bando S., Arihara S. Five Lanostane Triterpenoids and Three Saponins from the Fruit Body of Laetiporus versisporus (англ.) // CHEMICAL & PHARMACEUTICAL BULLETIN. — 2000. — Т. 48, № 10. — С. 1418—1421. — ISSN 1347-5223. (недоступная ссылка)
- Gorman J. A., Chang L-P., Clark J., Gustavson D. R., Lam Kin S., Mamber S. W., Pirnik D., Ricca C., Fernandes P. B., O'Sullivan J. Ascosteroside, a New Antifungal Agent from Ascotricha amphitricha. I. Taxonomy, Fermentation and Biological Activities (англ.) // The Journal of Antibiotics. — 1996. — Т. 49, № 6. — С. 547—552. — ISSN 1881-1469. (недоступная ссылка)
- Yoshikawa K., Inoue M., Matsumoto Y., Sakakibara C., Miyataka H., Matsumoto H., Arihara S. Lanostane Triterpenoids and Triterpene Glycosides from the Fruit Body of Fomitopsis pinicola and Their Inhibitory Activity against COX-1 and COX-2 (англ.) // J. Nat. Prod. — 2005. — Т. 68, № 1. — С. 69–73. — doi:10.1021/np040130b.
- Yoshikawa K., Kouso K., Takahashi J., Matsuda A., Okazoe M., Umeyama A., Arihara S. Cytotoxic Constituents of the Fruit Body of Daedalea dickisii (англ.) // J. Nat. Prod. — 2005. — Т. 68, № 6. — С. 911–914. — doi:10.1021/np058024c.
- Chen J. C., Chiu M. H., Nie R. L., Cordell G. A., Qiu S. X. Cucurbitacins and cucurbitane glycosides: structures and biological activities (англ.) // Nat. Prod. Rep. — 2005. — Т. 22, № 3. — С. 386—399. — doi:10.1039/B418841C.
- Семенов А. А. Очерк химии природных соединений. — Новосибирск: Наука. Сибирская издательская фирма РАН, 2000. — 664 с., стр. 224—226
- Chen J. C., Chiu M. H., Nie R. L., Cordell G. A., Qiu S. X. Cucurbitacins and cucurbitane glycosides: structures and biological activities (англ.) // Nat. Prod. Rep. — 2005. — Т. 22, № 3. — С. 386—399. — doi:10.1039/B418841C.
- Hostettmann K., Marston A., 1995, p. 11.
- Hostettmann K., Marston A., 1995, p. 3.
- Hostettmann K., Marston A., 1995, p. 29.
- Oleszek W., Jurzysta M., Ploszynski M., Colquhoun T. J., Price K. R., Fenwick G. R. Zahnic acid tridesmoside and other dominant saponins from alfalfa (Medicago sativa L.) aerial parts (англ.) // J. Agric. Food Chem. — 1992. — Т. 40. — С. 191–196. — doi:10.1021/jf00014a005.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 337.
- Szakiel A., Ruszkowski D., Janiszowska W. Saponins in Calendula officinalis L. – Structure, Biosynthesis, Transport and Biological Activity (англ.) // Phytochemistry Reviews. — 2005. — Т. 4. — С. 151—157. — doi:10.1007/s11101-005-4053-9. (недоступная ссылка)
- Khorlin A. Ya., Ivanova V. M. Triterpenoid saponins Communication 14. Saponins of Patrinia intermedia (Roem. et Schult.) (англ.) // Russian Chemical Bulletin. — 1964. — Т. 14, № 2. — С. 287—291. — doi:10.1007/BF00845594. (недоступная ссылка)
- Bukharov V. G., Karlin V. V., Talan V. A. The triterpene glycosides of Patrinia intermedia Schult. IV. Structure Of the Carbohydrate Chains of Patrinosides C and D (англ.) // Khimiya Prirodnykh Soedinenii. — 1969. — Т. 5, № 2. — С. 76—78. — doi:10.1007/BF00633280. (недоступная ссылка)
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 323—329.
- Sirtori C. R. Aescin: pharmacology, pharmacokinetics and therapeutic profile (англ.) // Pharmacol. Res. — 2001. — Т. 44. — С. 183–193. — doi:10.1006/phrs.2001.0847.
- Hostettmann K., Marston A., 1995, p. 324.
- Harborn J. B., Baxter H. Chemical dictionary of economic plant. — John Wiley&Sons Ltd, 2001., p. 32
- Golyak Yu. A., Khishova O. M., Dubashinskaya N. V., Kukhareva L. V. Quantitative determination of total triterpenoid saponins in Polemonium caeruleum rhizomes and roots (англ.) // Pharmaceutical Chemistry Journal. — 2008. — Т. 42. — С. 456—459. — doi:10.1007/s11094-008-0148-0. (недоступная ссылка)
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 339.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 595.
- Bilia A. R., Palme E., Catalano S, Flamini G, Morelli I. New triterpenoid saponins from the roots of Potentilla tormentilla (англ.) // Journal of Natural Products. — 1994. — Т. 57, № 3. — С. 333—338. — doi:10.1021/np50105a001.
- Tomczyka M., Lattéb K. P. Potentilla — A review of its phytochemical and pharmacological profile (англ.) // Journal of Ethnopharmacology. — 2009. — Т. 122, № 2. — С. 184–204. — doi:10.1016/j.jep.2008.12.022.
- Sultana N. Clinically useful anticancer, antitumor, and antiwrinkle agent, ursolic acid and related derivatives as medicinally important natural product (англ.) // Journal of Enzyme Inhibition and Medicinal Chemistry. — 2011. — Т. 26, № 5. — С. 616—642. — doi:10.3109/14756366.2010.546793.
- Szakiel A, Mroczek A. Distribution of triterpene acids and their derivatives in organs of cowberry (Vaccinium vitis-idaea L.) plant (англ.) // Acta Biochim Pol. — 2007. — Т. 54, № 4. — С. 733—740.
- Rogachev A. D., Komarova N. I., Morozov S. V., Fomenko V. V., Salakhutdinov N. F. Phytochemical Studies of Rhododendron adamsii Rehder. Quantitative Determination of Ursolic and Oleanolic Acids in Some Representatives of Ericaceae Family // Chemistry for Sustainable Development. — 2007. — Т. 15. — С. 561—564. (недоступная ссылка)
- Patočka J. Biologically active pentacyclic triterpenes and their current medicine signification (англ.) // Journal of Applied Biomedicine. — 2003. — Т. 1. — С. 7 – 12. — ISSN 1214-0287. Архивировано 23 февраля 2012 года.
- Hostettmann K., Marston A., 1995, p. 96—105, 297—306.
- Francis G., Kerem Z., Makkar H. P. S., Becker K. The biological action of saponins in animal systems: a review // Br. J. Nutr. — 2002. — Т. 88. — С. 587–605. — doi:10.1079/BJN2002725.
- Saponin from quillaja bark. Sigma-Aldrich. Дата обращения: 23 февраля 2009. Архивировано 6 июня 2012 года.
- George A. J. Legal status and toxicity of saponins (англ.) // Food and Cosmetics Toxicology. — Т. 3, № 1965. — С. 85–91. — doi:10.1016/S0015-6264(65)80012-8.
- Hostettmann K., Marston A., 1995, p. 250.
- Hostettmann K., Marston A., 1995, p. 251.
- Hostettmann K., Marston A., 1995, p. 267.
- Hostettmann K., Marston A., 1995, p. 270.
- Hostettmann K., Marston A., 1995, p. 279.
- Hostettmann K., Marston A., 1995, p. 275.
- Hostettmann K., Marston A., 1995, p. 284.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П., 2002, с. 323.
- Sun H.-X., Xie Y., Ye Y.-P. Advances in saponin-based adjuvants (англ.) // Vaccine. — 2009. — Т. 27, № 12. — С. 1787–1796. — doi:10.1016/j.vaccine.2009.01.091.
Литература
- Горовиц М. Б. Сапонины // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1995. — Т. 4: Полимерные—Трипсин. — С. 292—294. — 639 с. — 40 000 экз. — ISBN 5-85270-039-8.
- Физер Л., Физер М. Органическая химия. В 2-х томах. — М.: Химия, 1970. — Т. II. — 800 с.
- Ягодка В. С. Лекарственные растения в дерматологии и косметологии. — К.: Наукова думка, 1991. — 272 с.
- Тринус Ф. П. Фармако-терапевтический справочник. — 6-е изд. — К.: Здоров’я, 1989. — 640 с. — ISBN 5-225-04714-9.
- Муравьева Д. А., Самылина И. А., Яковлев Г. П. Фармакогнозия. — 4 изд. — М.: Медицина, 2002. — 656 с. — ISBN 5-225-04714-9.
- Физер Л., Физер М. Стероиды. — М., 1964.
- Augustin J. M., Kuzina V., Andersen S. B., Bak S. Molecular activities, biosynthesis and evolution of triterpenoid saponins (англ.) // Phytochemistry. — 2011. — Т. 72, № 6. — С. 435–457. — doi:10.1016/j.phytochem.2011.01.015.
- Hostettmann K., Marston A. Saponins. — Cambridge: Cambridge University Press, 1995. — ISBN 0-521-32970-1.
- Васильева И. С., Пасешниченко В. А. Стероидные гликозиды растений и культуры клеток диоскореи, их метаболизм и биологическая активность (рус.) // Успехи биологической химии. — 2000. — Т. 40, № 6. — С. 153—204. Архивировано 15 февраля 2017 года.