Бетулиновая кислота
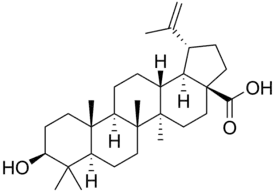
Бетулиновая кислота (3β-гидрокси-20(29)-лупаен-28-овая кислота)- природный пентациклический тритерпеноид. Содержится в коре некоторых видов растений, главным образом берёзы пушистой (Betula pubescens), от которой и получила своё название.
| Бетулиновая кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
бетулиновая кислота |
| Хим. формула | C30H48O3 |
| Физические свойства | |
| Молярная масса | 456.70 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 316 - 318 °C |
| • разложения | 295 - 298 °C |
| Классификация | |
| Рег. номер CAS | 472-15-1 |
| PubChem | 64971 |
| Рег. номер EINECS | 207-448-8 |
| SMILES | |
| InChI | |
| ChEBI | 3087 |
| ChemSpider | 58496 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Фармакологическая активность
Бетулиновая кислота и её производные обладают противовоспалительной, противоопухолевой и анти-ВИЧ- активностью.[1] [2]
Получение
Известен ряд способов получения бетулиновой кислоты из бетулина, которые можно разделить на две группы. К первой группе способов относятся многостадийные схемы, позволяющие избежать изменения пространственной ориентации гидроксильной группы в положении 3 и получить биологически активный 3β-изомер. Сущность этих методов заключается в защите гидроксильных групп бетулина, снятии защиты у первичной гидроксильной группы, окислении первичной гидроксильной группы в карбоксильную, снятии защиты у вторичной гидроксильной группы.
Был разработан пятистадийный способ получения бетулиновой кислоты из бетулина, по которому на первой стадии проводят защиту первичной гидроксильной группы дигидропираном с образованием тетрагидропиранового эфира бетулина. Затем проводят защиту вторичной гидроксильной группы ацилированием уксусным ангидридом в пиридине с последующим снятием тетрагидропирановой защиты. Далее осуществляют окисление моноацетата бетулина реактивом Джонса в моноацетат бетулиновой кислоты с последующим получением бетулиновой кислоты отщеплением ацетильной группы карбонатом калия в метаноле. Этот метод даёт возможность получать 3β-изомер бетулиновой кислоты, обладающий, в отличие от 3α-изомера, биологической активностью. К недостаткам этого метода можно отнести его многостадийность, а, следовательно, длительность процесса в целом и небольшой суммарный выход целевого продукта (40 – 50 %).[3]
Вторая группа методов представлена двухстадийными схемами, позволяющими достичь желаемого результата более коротким путём, но с превращением небольшого количества целевого продукта (около 15 %) в биологически неактивную 3α-гидрокси-20(29)-лупаен-28-овую кислоту (3α-изомер. Преимущества этой группы методов связаны не только с сокращением числа стадий процесса, но и с увеличением выхода целевого продукта, даже с учётом снижения выхода 3β-изомера вследствие появления 3α-изомера. В двухстадийных схемах получения бетулиновой кислоты бетулин вначале окисляют в бетулоновую кислоту, которую затем восстанавливают изопропилатом алюминия или комплексными гидридами в бетулиновую кислоту.[4]
Примечания
- Pisha E. Method for selectivity inhibiting melanoma, using betulinic acid. Nat. Med. 1995. Vol.1. P. 1046-1051
- Fujioka T. Compounds and methods of use to treat HIV infections. J. Nat. Prod. 1994. Vol. 57. P. 243 – 247.
- Pezzuto Dg., Darrick S.H.L. Kim. Methods of manufacturing betulinic acid. US patent 5.804.575.1997.
- Ruzicka L., Lamberton A.H., Christe Ruzicka C.W. Synthetic approach to betulinic acid. Helv. Chim. Acta. 1938. Vol.21. P. 1706-1717.
Литература
- Pisha E. Method for selectivity inhibiting melanoma, using betulinic acid. Nat. Med. 1995. Vol.1. P. 1046-1051.
- Fujioka T. Compounds and methods of use to treat HIV infections. J. Nat. Prod. 1994. Vol. 57. P. 243 – 247.
- Pezzuto Dg., Darrick S.H.L. Kim. Methods of manufacturing betulinic acid. US patent 5.804.575.1997.
- Ruzicka L., Lamberton A.H., Christe Ruzicka C.W. Synthetic approach to betulinic acid. Helv. Chim. Acta. 1938. Vol.21. P. 1706-1717.