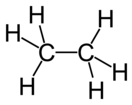
Этан
Эта́н (от лат. ethanum, химическая формула — C2H6 или H3C—CH3) — органическое соединение, относящееся к классу предельных углеводородов — алканов.
| Этан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Этан | ||
| Хим. формула | C2H6 | ||
| Рац. формула | H3C—CH3 | ||
| Физические свойства | |||
| Состояние | Газ | ||
| Молярная масса | 30,07 г/моль | ||
| Плотность | 1,2601 кг/м3 в стандартных условиях по ГОСТ 2939—63; при н. у. (0С) 0,001342 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −182,8 °C | ||
| • кипения | −88,6 °C | ||
| • вспышки | 152 °C | ||
| • воспламенения | 152 °C | ||
| • самовоспламенения | 472 °C | ||
| Мол. теплоёмк. | 52,65 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -84,67 кДж/моль | ||
| Давление пара | 2,379 МПа (0°С) | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 42 (вода, 20°С) | ||
| Структура | |||
| Гибридизация | sp3-гибридизация | ||
| Классификация | |||
| Рег. номер CAS | 74-84-0 | ||
| PubChem | 6324 | ||
| Рег. номер EINECS | 200-814-8 | ||
| SMILES | |||
| InChI | |||
| RTECS | KH3800000 | ||
| ChEBI | 42266 | ||
| Номер ООН | 1035 | ||
| ChemSpider | 6084 | ||
| Безопасность | |||
| Токсичность | Малотоксичен | ||
| Краткие характер. опасности (H) |
H220, H280[1] |
||
| Меры предостор. (P) |
P210, P377, P381, P410+P403 |
||
| Сигнальное слово | Опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
При стандартных условиях, этан — это газ без цвета и запаха.
Строение

Молекула этана имеет тетраэдрическое строение: атомы углерода являются sp3-гибридными. Связь C-C образована перекрыванием sp3-гибридных орбиталей, а связь C-H — перекрыванием sp3-гибридной орбитали углерода и s-орбитали водорода. Длина связи C-C равна 1,54 Å, а длина связи C-H равна 1,095 Å[2].
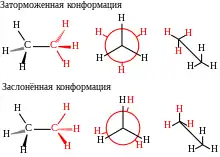
Поскольку С-С-связь в этане одинарная, вокруг неё возможно свободное вращение атомов водорода метильных групп. При вращении возникают различные пространственные формы молекулы этана, которые называются конформациями. Конформации принято изображать в виде перспективного изображения (такие изображения иногда называют «лесопильными козлами») либо в виде проекций Ньюмена[2].
Число конформаций для этана бесконечно для всевозможных углов скручивания, однако обычно принято рассматривать две крайние конформации:
- заслонённую, в которой атомы водорода максимально сближены в пространстве;
- и заторможенную, в которой атомы водорода максимально удалены[2].
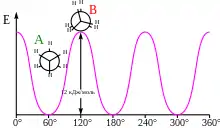
Заслонённая конформация имеет наибольшую энергию из всех конформаций, а заторможенная — наименьшую, то есть является наиболее энергетически выгодной и, следовательно, более устойчивой. Разница энергии между этими конформациями равна 2,9 ккал/моль (~12 кДж/моль). Считается, что это число отражает торсионное напряжение в менее выгодной заслонённой конформации. Если разделить эту энергию на три взаимодействия между парами атомов водорода, то энергия торсионного взаимодействия двух атомов водорода составит примерно 1 ккал/моль[2].
По значению 2,9 ккал/моль из уравнения Гиббса можно вычислить константу равновесия между двумя конформациями этана. При температуре 25 °С значительно преобладает заторможенная конформация: 99 % молекул этана находятся в этой конформации и лишь 1 % — в заслонённой[2].
Энергии крайних и промежуточных конформаций принято представлять в виде циклических графиков, где по оси абсцисс отложен торсионный угол, а по оси ординат — энергия.
Физические свойства
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса 30,07. Температура плавления −183,23 °C, температура кипения −88,63 °C. Плотность ρгаз. 0,001342 г/см3 или 1,342 кг/м3 (при нормальных условиях), ρжидк. 0,561 г/см3 (при температуре −100 °C). Давление паров при 0 °C 2,379 МПа. Растворимость в воде 4,7 мл в 100 мл (при 20 °C), в этаноле 46 мл в 100 мл (при 0 °C), хорошо растворяется в углеводородах. Точка вспышки этана −187,8 °C, температура самовоспламенения 595 °C. Этан образует с воздухом взрывоопасные смеси при содержании 5—15 об. % (при 20 °C). Октановое число 120,3[3][4][5].
Химические свойства
Этан вступает в типичные реакции алканов, прежде всего реакции замещения, проходящие по свободнорадикальному механизму. Среди основных химических свойства этана можно выделить:
- 1. Термическое дегидрирование при 550—650 °C с образованием этилена:
- Дальнейшее дегидрирование выше 800 °C, приводящее к ацетилену (в этой реакции также получаются бензол и сажа);
- 2. Хлорирование при 300—450 °C с образованием этилхлорида:
- 3. Нитрование в газовой фазе с образованием смеси нитроэтана и нитрометана (3:1)[4]:
Получение
В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объёму. Концентрация этана в ископаемых углеводородах существенно зависит от месторождения. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьём для получения этилена[4].
Также этан получают при гидрокрекинге углеводородов и ожижении углей[6].
В лабораторных условиях
В 1848 году Кольбе и Франкленд впервые синтетически получили этан, обработав пропионитрил металлическим калием. В 1849 году они получили этот газ электролизом ацетата калия и действием цинка и воды на иодэтан[7].
В лабораторных условиях, этан получают следующими способами:
- 1. Взаимодействием металлического натрия и иодметана (реакция Вюрца):
- 2. Электролизом раствора ацетата натрия:
- 3. Взаимодействием пропионата натрия с щёлочью:
- 4. Взаимодействием этилбромида с металлическим магнием, и последующим гидролизом образовавшегося реактива Гриньяра:
- 5. Гидрированием этилена (катализатор — палладий (Pd)) или ацетилена (в присутствии никеля Ренея)[4]:
Применение
Основное использование этана в промышленности — получение этилена методом парового крекинга. Именно из этилена далее получают важные промышленные продукты, однако в целях экономии разрабатываются методы превращения в них самого этана. Однако ни один из проектов пока не прошёл пилотную стадию. Проблемы в этой области связаны с низкой селективностью реакций. Одним из перспективных направлений является синтез винилхлорида напрямую из этана. Также применяется превращение этана в уксусную кислоту. Термическим хлорированием этана в различных условиях получают хлорэтан, 1,1-дихлорэтан и 1,1,1-трихлорэтан[6].
Физиологическое действие
Этан обладает слабым наркотическим действием (наркотическое действие ослаблено низкой растворимостью в жидкостях организма). Класс опасности — четвёртый[8]. В концентрациях 2—5 об. % он вызывает одышку, в умеренных концентрациях — головные боли, сонливость, головокружение, повышенное слюноотделение, рвоту и потерю сознания из-за недостатка кислорода. В высоких концентрациях этан может вызвать сердечную аритмию, остановку сердца и остановку дыхания. При постоянном контакте может возникнуть дерматит. Сообщается, что при 15—19 об. % этан вызывает повышение чувствительности миокарда к катехоламинам[9].
Интересные факты
Предположительно, на поверхности Титана (спутник Сатурна) в условиях низких температур (—180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси[10].
Примечания
- Ethane. Sigma-Aldrich. Дата обращения: 6 апреля 2019.
- Реутов О. А., Курц А. Л., Бутин К. П. Органическая химия : в 4 т.. — 5-е изд. — БИНОМ. Лаборатория знаний, 2014. — Т. 1. — С. 321—326. — ISBN 978-5-9963-1535-2.
- Ullmann, 2014, p. 3–5.
- Химическая энциклопедия, 1998.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Изд. 2-е. — Химия, 1978. — С. 199.
- Ullmann, 2014, p. 13.
- ЭСБЕ, 1904.
- Газохроматографическое измерение массовых концентраций углеводородов: метана, этана, этилена, пропана, пропилена, нбутана, альфа-бутилена, изопентана в воздухе рабочей зоны. Методические указания. МУК 4.1.1306-03 (недоступная ссылка)
- Ullmann, 2014, p. 61.
- Mousis O., Schmitt B. Sequestration of Ethane in the Cryovolcanic Subsurface of Titan (англ.) // The Astrophysical Journal : journal. — IOP Publishing, 2008. — April (vol. 677). — doi:10.1086/587141.
Литература
- Братков А. А. Этан // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 491. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- Schmidt R., Griesbaum K., Behr A., Biedenkapp D., Voges H.-W., Garbe D., Paetz C., Collin G., Mayer D., Höke H. Hydrocarbons (англ.) // Ullmann's Encyclopedia of Industrial Chemistry. — Wiley, 2014. — doi:10.1002/14356007.a13_227.pub3.
- The chemistry of alkanes and cycloalkanes / Ed. Saul Patai and Zvi Rappoport. — John Wiley & Sons, 1992. — ISBN 0-471-92498-9.
- Тутурин Н. Н. Этан // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1904. — Т. XLI.