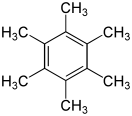
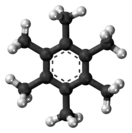
Гексаметилбензол
Гексаметилбензол, также известный как меллитен, представляет собой углеводород с молекулярной формулой C12H18 и конденсированной структурной формулой C6(CH3)6. Это ароматическое соединение и производное бензола, где шесть атомов водорода бензола заменены метильной группой. В 1929 году Кэтлин Лонсдейл сообщила о кристаллической структуре гексаметилбензола, продемонстрировав, что центральное кольцо является гексагональным и плоским, и тем самым закончила продолжающиеся дебаты о физических параметрах бензольной системы. Это был исторически значимый результат, как для области рентгеновской кристаллографии, так и для понимания ароматичности.[1][2]
| Гексаметилбензол | |||
|---|---|---|---|
| |||
 | |||
| Общие | |||
| Систематическое наименование |
Гексаметилбензол | ||
| Хим. формула | C12H18 | ||
| Физические свойства | |||
| Состояние | твёрдое | ||
| Молярная масса | 162,2742 г/моль | ||
| Плотность | 1,042 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 165,5 °C | ||
| • кипения | 263,4 °C | ||
| Классификация | |||
| Рег. номер CAS | 87-85-4 | ||
| PubChem | 6908 | ||
| Рег. номер EINECS | 201-777-0 | ||
| SMILES | |||
| InChI | |||
| RTECS | DA3200000 | ||
| ChEBI | 39001 | ||
| ChemSpider | 6642 | ||
| Безопасность | |||
| Пиктограммы СГС |
|
||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Соединение может быть получено путём взаимодействия фенола с метанолом при повышенных температурах над подходящим твёрдым катализатором, таким как оксид алюминия.[3][4][5] Механизм процесса был тщательно изучен, и было выявлено несколько промежуточных продуктов. Алкиновая тримеризация диметилацетилена также даёт гексаметилбензол в присутствии подходящего катализатора. Гексаметилбензол может быть окислен до меллитовой кислотой,[6] которая встречается в природе в виде соли алюминия в редком минеральном меллите. Гексаметилбензол может быть использован в качестве лиганда в металлоорганических соединениях. Пример из химии органоорганических соединений показывает структурные изменения в лиганде, связанные с изменениями в степени окисления металлического центра, хотя такое же изменение не наблюдается в аналогичной железоорганической системе.[7]
В 2016 году кристаллическая структура препарата гексаметилбензола была опубликована в Angewandte Chemie International Edition, где показана пирамидальная структура, в которой один атом углерода взаимодействует с шестью другими атомами углерода. Эта структура была «беспрецедентной», так как обычная максимальная валентность углерода равна четырём, и она привлекла внимание New Scientist, Chemical & Engineering News и Science News. Структура не нарушает правило октета, поскольку образующиеся углерод-углеродные связи не являются двухэлектронными связями и педагогически ценны для иллюстрации того, что атом углерода «может [непосредственно связываться] с более чем четырьмя атомами». Стивен Бахрах продемонстрировал, что соединение гиперкоординировано, но не гипервалентно, а также объяснил его ароматичность. Идея описания связи у таких видов через призму металлоорганической химии была предложена в 1975 году, вскоре после C6(CH3)2+6 впервые наблюдалось.[8][9][10]
Номенклатура и свойства
Согласно Синей книге, это химическое вещество может быть систематически названо как 1,2,3,4,5,6-гексаметилбензол. [Цитата необходима] Локанты (числа перед названием) являются лишними, однако, как название Гексаметилбензол однозначно идентифицирует одно вещество и, таким образом, является официальным названием IUPAC для соединения. Это ароматическое соединение с шестью π-электронами (удовлетворяющими правилу Хюккеля), делокализованными над циклической планарной системой; каждый из шести атомов углерода кольца гибридизуется с sp2 и имеет тригональную плоскостную геометрию, тогда как каждый метилуглерод является тетраэдрическим с sp3 гибридизацией, что согласуется с эмпирическим описанием его структуры. При перекристаллизации из этанола твёрдый гексаметилбензол образуется в виде бесцветных или белых кристаллических орторомбических призм или игл с температурой плавления 165–166 ° C, температурой кипения 268 ° C и плотностью 1,0630 г см-3. Сообщалось, что орторомбические оранжево-жёлтые кристаллы смеси пикрилхлорида и гексаметилбензола в соотношении 1: 1 содержат чередующиеся стопки каждого компонента, вероятно,[11] из-за π-укладки ароматических систем. Он нерастворим в воде, но растворим в органических растворителях, включая бензол и этанол.[12]

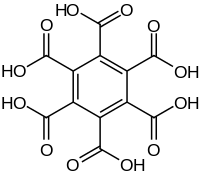
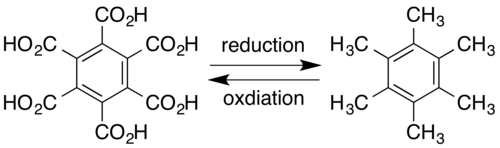
Гексаметилбензол иногда называют меллитеном, название происходит от меллита, редкого минерала медового цвета; μέλι meli (GEN μέλιτος melitos) - греческое слово «мёд». Меллит состоит из гидратированной алюминиевой соли бензолгексакарбоновой кислоты (меллитовой кислоты), с формулой Al2[С6(СО2)6] • 16H2O. Сама меллитовая кислота может быть получена из минерала, а последующее восстановление даёт меллитен. И наоборот, меллитен может быть окислен с образованием меллитовой кислоты:[6]
Обработка гексаметилбензола суперэлектрофильной смесью метилхлорида и трихлорида алюминия даёт гептаметилбензольный катион, один из первых карбокатионов, который будет наблюдаться непосредственно.
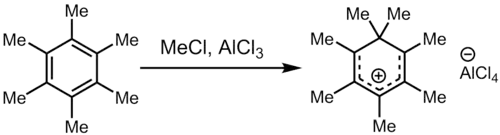
- Структура
В 1927 году Кэтлин Лонсдейл определила твёрдую структуру гексаметилбензола из кристаллов, предоставленных Кристофером Кельком Ингольдом. Её рентгеноструктурный анализ был опубликован в журнале Nature и впоследствии был описан как «замечательный ... для этой ранней даты». Лонсдейл описала работу в своей книге «Кристаллы и рентгеновские лучи», объяснив, что она признала, что, хотя элементарная ячейка была триклинной, дифракционная картина имела псевдогексагональную симметрию, что позволяло структурным возможностям быть достаточно ограниченным для метода проб и ошибок. подход к производству модели. Эта работа окончательно показала, что гексаметилбензол плоский и что расстояния между атомами углерода в кольце одинаковы,[2] что является важным доказательством в понимании природы ароматичности.
Получение
В 1880 году Джозеф Ахилле Ле Бел и Уильям Х. Грин сообщили[13] о том, что было описано как «экстраординарный» катализируемый хлоридом цинка синтез в одном сосуде гексаметилбензола из метанола. При температуре плавления катализатора (283 ° С) реакция имеет свободную энергию Гиббса (ΔG) -1090 кДж / моль и может быть идеализирована как:
Ле Бел и Грин рационализировали процесс как включающий ароматизацию путём конденсации метиленовых звеньев, образованных дегидратацией молекул метанола, с последующим полным метилированием Фриделя-Крафтса полученного бензольного кольца с образованием хлорметана in situ. Основными продуктами были смеси насыщенных углеводородов с гексаметилбензолом в качестве второстепенного продукта. Гексаметилбензол также образуется в качестве второстепенного продукта в реакции алкилирования дурена Фриделя-Крафтса из п-ксилола и может быть получен путём алкилирования с хорошим выходом из дурена или пентаметилбензола.
Гексаметилбензол обычно получают в газовой фазе при повышенных температурах над твёрдыми катализаторами. Ранний подход к получению гексаметилбензола заключался в реакции смеси паров ацетона и метанола на оксид алюминия с катализатором при 400 ° С. Объединение фенолов с метанолом над оксидом алюминия в сухой атмосфере углекислого газа при температуре 410–440 ° C также приводит к образованию гексаметилбензола, хотя и является частью сложной смеси анизола (метоксибензола), крезолов (метилфенолов) и других метилированных фенолов. Препарат органического синтеза с использованием метанола и фенола с оксидом алюминия при 530 ° С даёт выход приблизительно 66%, хотя также сообщается о синтезе в других условиях.
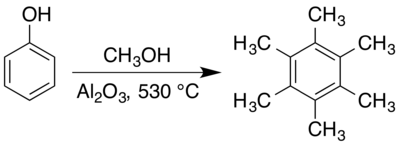
Механизмы таких поверхностно-опосредованных реакций были исследованы с целью достижения большего контроля над результатом реакции, особенно в поисках селективного и контролируемого орто-метилирования. Как анизол, так и пентаметилбензол были описаны в качестве промежуточных продуктов в этом процессе. Валентин Коптюг и его коллеги обнаружили, что оба изомера гексаметилциклогексадиенона (2,3,4,4,5,6- и 2,3,4,5,6,6-) являются промежуточными соединениями в процессе, подвергаясь миграции метила с образованием 1,2,3,4,5,6-гексаметилбензольный углеродный скелет.
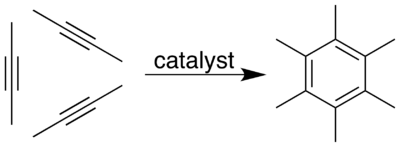
Тримеризация трёх молекул 2-бутина (диметилацетилена) даёт гексаметилбензол. Реакция катализируется три-тригидрофуранатом трифенилхрома или комплексом триизобутилалюминия и тетрахлорида титана.[14]
Источники
- Х. У. Эрхарт, Эндрю П. Комин: Энциклопедия химической технологии Кирка-Отмера. John Wiley & Sons, Inc., 2000, ISBN 978-0-471-23896-6, глава Polymethylbenzenes, doi: 10.1002 / 0471238961.1615122505011808.a01.
Примечания
- Newsletter January, 1993 // Anesthesia History Association Newsletter. — 1993-01. — Т. 11, вып. 1. — С. 1–16. — ISSN 1089-9634. — doi:10.1016/s1089-9634(93)50090-7.
- John Lydon. The postage stamps of analogia // Biochemistry and Molecular Biology Education. — 2006-01. — Т. 34, вып. 1. — С. 17–20. — ISSN 1539-3429 1470-8175, 1539-3429. — doi:10.1002/bmb.2006.49403401017.
- E. Briner, W. Plüss, H. Paillard. Recherches sur la déshydration catalytique des systèmes phénols-alcools (англ.) // Helvetica Chimica Acta. — 1924. — Vol. 7, iss. 1. — P. 1046–1056. — doi:10.1002/hlca.192400701132.
- HEXAMETHYLBENZENE // Organic Syntheses. — 1955. — Т. 35. — С. 73. — doi:10.15227/orgsyn.035.0073.
- Phillip S. Landis, Werner O. Haag. Formation of Hexamethylbenzene from Phenol and Methanol (англ.) // The Journal of Organic Chemistry. — 1963-02. — Vol. 28, iss. 2. — P. 585–585. — ISSN 1520-6904 0022-3263, 1520-6904. — doi:10.1021/jo01037a517.
- J. P. Wibaut, J. Overhoff, E. W. Jonker, K. Gratama. On the preparation of mellitic acid from hexa-methylbenzene and on the hexachloride of mellitic acid (англ.) // Recueil des Travaux Chimiques des Pays-Bas. — 1941. — Vol. 60, iss. 10. — P. 742–746. — doi:10.1002/recl.19410601005.
- Topics in organic electrochemistry. — New York: Plenum Press, 1986. — 1 online resource (xiv, 296 pages) с. — ISBN 978-1-4899-2034-8, 1-4899-2034-X.
- H. Hogeveen, P.W. Kwant. Direct observation of a remarkably stable dication of unusual structure: (CCH3)62⊕. (англ.) // Tetrahedron Letters. — 1973. — Vol. 14, iss. 19. — P. 1665–1670. — doi:10.1016/S0040-4039(01)96023-X.
- H. Hogeveen, P.W. Kwant, J. Postma, P.Th. van Duynen. Electronic spectra of pyramidal dications, (CCH362+ and (CH)62+. (англ.) // Tetrahedron Letters. — 1974. — Vol. 15, iss. 49-50. — P. 4351–4354. — doi:10.1016/S0040-4039(01)92161-6.
- H. Hogeveen, P. W. Kwant. Chemistry and spectroscopy in strongly acidic solutions. XL. (CCH3)62+, an unusual dication // Journal of the American Chemical Society. — 1974-04-01. — Т. 96, вып. 7. — С. 2208–2214. — ISSN 0002-7863. — doi:10.1021/ja00814a034.
- Sidney D. Ross, Morton Bassin, Manuel Finkelstein, William A. Leach. Molecular Compounds. I. Picryl Chloride-Hexamethylbenzene in Chloroform Solution (англ.) // Journal of the American Chemical Society. — 1954-01. — Vol. 76, iss. 1. — P. 69–74. — ISSN 1520-5126 0002-7863, 1520-5126. — doi:10.1021/ja01630a018.
- CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data, 2012-2013 / W.M. Haynes, David R. Lide, editors.. — 93rd edition. — Boca Raton, FL. — 1 online resource (volumes) с. — ISBN 978-1-4398-8050-0, 1-4398-8050-6.
- HENRY MONMOUTH SMITH. JOSEPH ACHILLE LE BEL: 1847–1930 // Torchbearers of Chemistry. — Elsevier, 1949. — С. 150. — ISBN 978-1-4831-9805-7.
- B. Franzus, P. J. Canterino, R. A. Wickliffe. TITANIUM TETRACHLORIDE-TRIALKYLALUMINUM COMPLEX—A CYCLIZING CATALYST FOR ACETYLENIC COMPOUNDS (англ.) // Journal of the American Chemical Society. — 1959-03. — Vol. 81, iss. 6. — P. 1514–1514. — ISSN 1520-5126 0002-7863, 1520-5126. — doi:10.1021/ja01515a061.