Правило октета
Правило октета (октетная теория) — предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Широко распространенное мнение, что правило октета выполняется лишь в ограниченном числе случаев, так же ошибочно, как и утверждение того, что Периодический закон элементов не имеет всеобщего характера. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы:
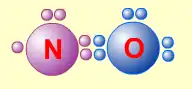
- Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример — молекула оксида азота NO.
- В данном случае сумма валентных электронов атома азота (5) и кислорода (6) равна 11, поэтому в этой молекуле атом кислорода достигает восьмиэлектронной оболочки, а атом азота — нет. В данном случае изначально невозможно достижение обоими атомами восьмиэлектронной оболочки. Стремление атома азота заполнить свою электронную оболочку объясняет химическую реакционную способность этой молекулы.
- Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6.
- В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(СО)8, Fe(C5H5)2 (ферроцен)и многие другие.

Таким образом, главным в правиле октетов Льюиса является не число 8 (или 18), а обобщение электронов как основа образования ковалентной химической связи[прояснить], и приближение за счет этого к электронной конфигурации инертного газа — восьмиэлектронной или восемнадцатиэлектронной.
История
В конце XIX века стало известно, что координационные структуры формируются атомами или молекулами таким образом, чтобы максимально удовлетворить валентность задействованных атомов. В 1893 Альфред Вернер показал, что число атомов или их групп, ассоциированных с центральным, часто равно 4 или 6, реже 8. В 1904 году Ричард Абегг сформулировал правило (известное как правило Абегга), утверждавшее, что максимальная разница между положительной и отрицательной валентностью элемента часто равна 8. Используя его Гилберт Ньютон Льюис в 1916 году записал правило октета для своей теории кубического атома.
Обзор
Валентная оболочка элемента полна и наиболее устойчива, если содержит 8 электронов (что является причиной низкой химической активности благородных газов).