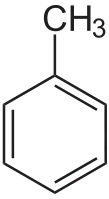
Толуол
Толуо́л (от исп. Tolu, толуанский бальзам) — фенилметан, метилбензол, сокращённое химическое обозначение — PhMe. Бесцветная жидкость с характерным запахом, относится к аренам.
| Толуол | |||
|---|---|---|---|
| |||
| Общие | |||
| Хим. формула | C7H8 | ||
| Физические свойства | |||
| Молярная масса | 92,14 г/моль | ||
| Плотность | 0,86694 г/см³ | ||
| Энергия ионизации | 8,82 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −95 °C | ||
| • кипения | 110,6 °C | ||
| • вспышки | 6 °C | ||
| Пределы взрываемости | от 1,1 до 7,1 об. % | ||
| Критическая точка | 320 °C (593 K), 4299 кПа | ||
| Энтальпия | |||
| • образования | 50 170 Дж/моль[2] и 12 180 Дж/моль[2] | ||
| • сгорания | −3910 кДж/моль[3] | ||
| Удельная теплота испарения | 364000 Дж/кг | ||
| Давление пара | 21 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,014 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | 108-88-3 | ||
| PubChem | 1140 | ||
| Рег. номер EINECS | 203-625-9 | ||
| SMILES | |||
| InChI | |||
| RTECS | XS5250000 | ||
| ChEBI | 17578 | ||
| ChemSpider | 1108 | ||
| Безопасность | |||
| Предельная концентрация | 50 мг/м3 (среднесменная, за 8 часов)[4] | ||
| Краткие характер. опасности (H) |
H225, H304, H315, H336, H361d, H373 |
||
| Меры предостор. (P) |
P210, P261, P280, P301+P310, P331 |
||
| Сигнальное слово | опасно | ||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
История
Толуол получен впервые П. Пеллетье в 1835 при перегонке сосновой смолы. В 1838 выделен А. Девилем из бальзама, привезенного из города Толу в Колумбии, в честь которого получил своё название[5].
Общая характеристика
Бесцветная подвижная летучая жидкость с характерным запахом, проявляет слабое наркотическое действие. Смешивается в неограниченных количествах с углеводородами, многими спиртами, простыми и сложными эфирами, плохо растворяется в воде. Показатель преломления для D-линии натрия 1,4969 при 20 °C. Горюч, горит коптящим пламенем.
Химические свойства
Для толуола характерны реакции электрофильного замещения в ароматическом кольце и замещения в метильной группе по радикальному механизму.
Электрофильное замещение в ароматическом кольце идёт преимущественно в орто- и пара-положениях относительно метильной группы.
Кроме реакций замещения, толуол вступает в реакции присоединения (гидрирование), озонолиза. Некоторые окислители (щелочной раствор перманганата калия, разбавленная азотная кислота) окисляют метильную группу до карбоксильной. Температура самовоспламенения 535 °C. Температура вспышки 4 °C.
При взаимодействии толуола с сильными окислителями образуется бензойная кислота:
- Взаимодействие с перманганатом калия в кислой среде:
- Взаимодействие с перманганатом калия в нейтральной среде
- Взаимодействие с галогенами на свету:
Получение и очистка
Продукт каталитического риформинга бензиновых фракций нефти. Выделяется селективной экстракцией и последующей ректификацией. Также хорошие выходы толуола достигаются при каталитическом дегидрировании гептана через метилциклогексан.
Очищают толуол аналогично бензолу, но в случае применения концентрированной серной кислоты следует учитывать, что толуол сульфируется легче бензола, а, значит, необходимо поддерживать более низкую температуру реакционной смеси (практически — менее 30 °C).
Толуол образует с водой азеотропную смесь[6][7].
Толуол можно получить из бензола по реакции Фриделя — Крафтса с использованием трибромида железа в качестве катализатора:
Возможны также другие способы.
Применение
Сырьё для производства бензола, бензойной кислоты, нитротолуолов (в том числе тринитротолуола), толуилендиизоцианатов (через динитротолуол и толуилендиамин) бензилхлорида и других органических веществ.
Применяется как растворитель для многих органических веществ и полимеров, входит в состав различных товарных растворителей для лаков и красок. Входит в состав растворителей марок: Р-40, Р-4, 645, 646, 647, 648. Применяется как растворитель в химическом синтезе.
Опасность и обращение
Пожароопасен, легковоспламеняющаяся жидкость. Концентрационные пределы взрываемости паровоздушной смеси 1,3—6,7 %.
Обладает слабым наркотическим действием. Пары толуола могут проникать через неповрежденную кожу и органы дыхания, вызывать поражение нервной системы (заторможенность, нарушения в работе вестибулярного аппарата), в том числе необратимое. Поэтому работать с толуолом и растворителями, в состав которых он входит, необходимо в прочных резиновых перчатках в хорошо проветриваемом помещении или с использованием вытяжной вентиляции.
Согласно другим источникам (САНПИН, меры предосторожности при работе с летучими органическими растворителями), толуол является сильно токсичным ядом, влияющим на функцию кроветворения организма, аналогично бензолу. Нарушение кроветворения проявляется в цианозе и гипоксии. Существует также толуольная токсикомания.
В целом, толуол, как и другие гомологи бензола, токсичен, его длительное воздействие на организм может привести к необратимым поражениям ЦНС, кроветворных органов и создать предпосылки для возникновения энцефалопатии.
Опыты на крысах не выявили рисков увеличения числа опухолей при долговременном воздействии толуола. Однако данные о канцерогенном воздействии на человека в настоящее время отсутствуют, и Агентство по охране окружающей среды США относит толуол к канцерогенам группы D («недостаточно данных для классификации»)[8].
При наблюдениях за токсикоманами каких-либо раковых заболеваний, вызванных толуолом, не замечено, но регулярное вдыхание паров толуолосодержащих веществ может вызвать ряд других заболеваний.
Токсичность

Толуол — токсичное вещество[9], его ПДК в воздухе рабочей зоны в РФ составляет[4] 50 мг/м3 (среднесменная, за 8 часов) и 150 мг/м3 (максимально-разовая). А порог восприятия запаха этого вещества может составлять (в среднем, в группе людей) ~ 260 мг/м3 [10], и даже ~ 590 мг/м3[11]; причём у отдельных людей он может быть значительно больше среднего значения. Поэтому можно ожидать, что использование широко распространённых фильтрующих СИЗОД в сочетании с «заменой фильтров по появлении запаха под маской» (как это почти всегда рекомендуется в РФ поставщиками) приведёт к чрезмерному воздействию паров толуола на, по крайней мере, часть работников — из-за запоздалой замены противогазных фильтров. Поэтому для защиты от толуола следует использовать более эффективные технологии и средства коллективной защиты.
Толуоловая токсикомания
Толуол и содержащие его смеси, например, Р-646, являются псевдогаллюциногенными веществами. Для борьбы против токсикомании фирма Хенкель исключила толуол из клея «Момент», заменив его ацетоном.
Примечания
- http://www.cdc.gov/niosh/npg/npgd0619.html
- Smith J. M., H.C. Van Ness, M.M. Abbott Introduction to Chemical Engineering Thermodynamics (англ.) // J. Chem. Educ. — American Chemical Society, 1950. — Vol. 27, Iss. 10. — P. 789. — ISSN 0021-9584; 1938-1328 — doi:10.1021/ED027P584.3
- https://sites.google.com/site/ellesmerealevelchemistry/module-3-periodic-table-energy/3-2-physical-chemistry-1/3-2-1-enthalpy-changes/3-2-1-d-enthalpy-change-definitions
- (Роспотребнадзор). № 1284. Метилбензол (толуол) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 91. — 170 с. — (Санитарные правила).
- Henri-Étienne Sainte-Claire Deville — биография Анри-Этьена Девиля на сайте NNDB (англ.)
- Толуол
- Гордон А., Форд Р. Спутник химика. Перевод на русский язык Розенберга Е. Л., Коппель С. И. М.: Мир, 1976. — 544 с.
- Toluene: Health Information Summary (2005). Дата обращения: 5 января 2015.
- Рашевская А.М. Толуол // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б.В. Петровский. — 3 изд. — Москва : Советская энциклопедия, 1985. — Т. 25. Теннис - Углекислота. — 544 с. — 150 000 экз.
- Johannes May. Odor Thresholds of Solvents for Assessment of Solvent Odors in the Air [Geruchsschwellen von Lösemitteln zur Bewertung von Lösemittelgerüchen in der Luft] (нем.) // Staub, Reinhaltung der Luft. — Düsseldorf: VDI-Verlag GmbH, 1966. — September (vol. 26 (H. 9). — S. 385–389. — ISSN 0039-0771., цитируется по: Office of Air Quality Planning and Standards. Reference Guide To Odor Thresholds For Hazardous Air Pollutants Listed In The Clean Air Act Amendments Of 1990 (англ.). — Research Triangle Park, North Carolina: United States Environmental Protection Agency, 1992. — P. 2—33 (65). — 89 p. — (EPA600/R-92/047).
- Enrique Cometto-Muñiz, William S. Cain, Michael H. Abraham. Dose-addition of individual odorants in the odor detection of binarymixtures (англ.) // Behavioural Brain Research. — Elsevier B.V., 2003. — Vol. 138. — Iss. 1. — P. 95—105. — ISSN 0166-4328. — doi:10.1016/S0166-4328(02)00234-6.
Ссылки
- Toxicological Profile for Toluene (ver. September 2000) // ATSDR
- ГОСТ 14710-78 Толуол нефтяной. Технические условия. Дата обращения: 31 мая 2013.