Иодэтан
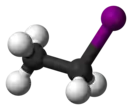
Иодэтан (этилиодид, иодистый этан) — органическое соединение с химической формулой С2H5I. Используется как алкилирующий агент в органическом синтезе.
| Иодэтан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Иодэтан | ||
| Традиционные названия | Этил иодистый, этилиодид | ||
| Хим. формула | С2H5I | ||
| Рац. формула | СH3СH2I | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 155.97 г/моль | ||
| Плотность | 1.940 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -108.5 °C | ||
| • кипения | 72.2 °C | ||
| • вспышки | 72 °C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,403 г / 100 мл (20 °C) | ||
| • в бензоле | растворим | ||
| • в диэтиловом эфире | растворим | ||
| • в хлороформе | растворим | ||
| Оптические свойства | |||
| Показатель преломления | 1.5133 (20°C) | ||
| Структура | |||
| Дипольный момент | 1.91 (20°C) | ||
| Классификация | |||
| Рег. номер CAS | 75-03-6 | ||
| PubChem | 6340 | ||
| Рег. номер EINECS | 200-833-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | KI4750000 | ||
| ChEBI | 42487 | ||
| ChemSpider | 6100 | ||
| Безопасность | |||
| ЛД50 | 330 мг/кг | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические и химические свойства
Бесцветная жидкость. При контакте с воздухом, особенно под воздействием света, оно разлагается и становится желтым или коричневым из-за наличия иода. Температура плавления: -110,9 °C, кипения: 72,2 °C, имеет плотность 1,993 г/см³(20 °C), показатель преломления: 1,5133(20 °C). Растворим в спирте, эфире, хлороформе, бензоле, плохо растворим в воде (0,403 г / 100 мл)[1].
- Иодэтан, как и другие галогеналканы могут вступать в Реакцию Вюрца, где галогеналканы реагируют с металлическим натрием по реакции:
- Иодэтан гидролизуется водным раствором щелочей:
- Иодэтан может реагировать со спиртовым раствором щелочей, по реакции дегидрогалогенирования, путём этих реакций получают алкены (углеводороды с двойной связью между атомами углерода):
Получение
В лаборатории иодэтан получают по реакции этилового спирта с иодом в присутствии красного фосфора.
Также иодэтан легко образуется при непосредственном воздействии иодоводорода на спирт. Для этого не требуется даже присутствия водоотнимающего средства. Достаточно прокипятить в колбе с обратным холодильником смесь спирта с концентрированной иодистоводородной кислотой в отношении примерно 1: 3 и затем разбавить водой, чтобы внизу выделился слой иодэтана.
Применение
Применяется как этилирующий агент в органическом синтезе[1].
Безопасность
Обладает слабым наркотическим действием[1]. Также, может являться канцерогеном как и другие моногалогенопроизводные углеводородов (становиться причиной злокачественных опухолей).
Примечания
Литература
- Голодников Г. В., Мандельштам Т. В. Практикум по органическому синтезу / под редакцией Оглоблина К. А.. — Л.: ИЛУ, 1976. — С. 188—189.
- Рабинович В. А., Хавин З. Я. Краткий химический справочник. — Л.: Химия, 1977. — С. 198.
- Этилиодид : статья // Химический энциклопедический словарь / Гл. ред. Кнунянц И. Л. — М. : Советская энциклопедия, 1983. — С. 720. — 792 с.