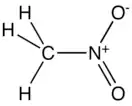
Нитрометан
Нитромета́н (нитрокарбóл) — органическое химическое соединение с формулой СН3-NO2. Простейший представитель нитросоединений алифатического ряда. Нитрометан следует отличать от метилнитрата (эфира метилового спирта и азотной кислоты с формулой СН3ONO2) и изомерного ему метилнитрита с той же брутто-формулой СН3ONO.
| Нитрометан | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
нитрометан | ||
| Традиционные названия | нитрометан, нитрокарбол[1] | ||
| Хим. формула | CH3NO2 | ||
| Рац. формула | CH3NO2 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 61 г/моль | ||
| Плотность | 1,138 г/см³ | ||
| Динамическая вязкость | 0.61 мПа·с | ||
| Энергия ионизации | 11,08 ± 0,01 эВ[2] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -28,5 °C | ||
| • кипения | 101,2 °C | ||
| • вспышки | 36 °C | ||
| Пределы взрываемости | 7,3 ± 0,1 об.%[2] | ||
| Тройная точка | 244,6 К, 1,4015·102 Па | ||
| Критическая точка | 588,15 К, 6,3·106 Па[3] | ||
| Энтальпия | |||
| • образования | -113,1 кДж/моль | ||
| Удельная теплота испарения | 38,28 Дж/моль | ||
| Удельная теплота плавления | 9,7 Дж/кг | ||
| Давление пара | 36,4 гПа (20 °C) | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 10.2 | ||
| Растворимость | |||
| • в воде | 10.5 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1,3817 | ||
| Структура | |||
| Дипольный момент | 3,50 Д | ||
| Классификация | |||
| Рег. номер CAS | 75-52-5 | ||
| PubChem | 6375 | ||
| Рег. номер EINECS | 200-876-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | PA9800000 | ||
| ChEBI | 77701 | ||
| ChemSpider | 6135 | ||
| Безопасность | |||
| Предельная концентрация | 30 мг/м³ | ||
| ЛД50 | 950 мг/кг (мыши) | ||
| Токсичность | Класс опасности по ГОСТ 12.1.007: 4-й[4] | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
Нитрометан представляет собой бесцветную высокополярную жидкость (ε=35,87), имеющую запах горького миндаля. Ограниченно растворим в воде — 10,5 г на 100 г воды, и растворяет 1,93 г воды в 100 г нитрометана, смешивается с обычными органическими растворителями; образует азеотропную смесь с водой (76,4 % нитрометана, tкип=83,6 °C)[5]. Не растворяется в предельных углеводородах. Максимальная температура горения 2177 °C при дефлаграции — реакции взрывного горения[6]:
Нитрометан горит желтым пламенем.
Исследования молекулы нитрометана показали, что во фрагменте C-NO2 все атомы расположены в одной плоскости, при этом угол связи O-N-O составляет 127±3°, в то время как угол связи C-N-O — 116±3°. Различие в величине угла объясняется взаимным отталкиванием отрицательно заряженных атомов кислорода[7].
Химические свойства
Нитрометан горюч и взрывоопасен. При соблюдении условий хранения может храниться при комнатной температуре неограниченно долго.
Благодаря наличию нитрогруппы атомы водорода в нитрометане подвижны, могут отщепляться в растворе при действии оснований (pKa = 10,2).
Нитрометан вступает во взаимодействие с кетонами, альдегидами в так называемой нитральдольной реакции или реакции Анри,

например с формальдегидом
При использовании избытка формальдегида замещаются все три атома водорода и образуется три(гидроксиметилен)нитрометан
который при восстановлении образует (CH2OH)3CNH2 — три(гидроксиметилен)метиламин («tris»), основной компонент трис-буфера.
Нитрометан также выступает как донор в реакции Михаэля, присоединясь к α,β-непредельным соединения по схеме 1,4-присоединения.
Взаимодействует с окисью этилена, и др. соединениями.
При замещении нитрогруппами других атомов водорода нитрометан образует динитрометан (СН2(NO2)2), тринитрометан (СН(NO2)3) и тетранитрометан (С(NO2)4). Все эти соединения также являются взрывчатыми веществами.
Получение
В химической промышленности нитрометан обычно получают деструктивным нитрованием низших алканов, например, пропана, 50-70 % азотной кислотой при 400—700 °C. В этом процессе также получается нитроэтан, 1-нитропропан, 2-нитропропан. Смесь нитросоединений разделяется ректификацией.
В лаборатории нитрометан может быть получен из хлорацетата натрия по следующей реакции (Г. Кольбе) с выходом 35-38 %:
или реакцией бромметана с нитритом серебра (реакция Мейера):
также реакцией диметилсульфата с нитритом натрия:
Применение
- Основное применение нитрометана — в качестве растворителя (например, эфироцеллюлозных лаков, виниловых полимеров, цианоакрилатов (суперклей), некоторых красок), для экстракции ароматических углеводородов, в производстве хлорпикрина, некоторых взрывчатых веществ.
- В качестве реактивного топлива
- Также используется как добавка к топливу для калильных двигателей внутреннего сгорания (например у радиоуправляемых моделей).
- В качестве топлива для гоночных болидов — «nitro», «Top fuel» (драгстеров).
Горение нитрометана
Нитрометан может быть использован как монотопливо, то есть топливо, способное гореть без присутствия кислорода. В числе продуктов сгорания могут быть угарный и углекислый газ, вода, молекулярный азот и оксиды азота. Уравнение этой реакции может быть представлено как:
Скорость ламинарного горения паров нитрометана составляет 0,5 м/с (немного выше чем у бензина), что делает его перспективным топливом для высокоскоростных двигателей. Кроме того, температура пламени несколько выше — 2400 °C. Высокая удельная теплота парообразования (0,56 МДж/кг) вместе с высокой скоростью течения приводит к сильному охлаждению подходящего топлива (примерно вдвое больше, чем у метанола), в результате получаются довольно низкие температуры.
Благодаря наличию кислорода в нитрометане он может гореть с много меньшим количеством атмосферного воздуха по сравнению с углеводородными топливами (бензин, керосин):
14,7 кг воздуха необходимо для сжигания килограмма бензина, но только 1,7 кг воздуха на один килограмм нитрометана. Так как цилиндр двигателя может содержать только ограниченное количество воздуха при каждом такте, в 8,7 раз больше нитрометана по сравнению с бензином может быть сожжено в один такт. Нитрометан, однако, имеет меньшую плотность энергии: бензин выделяет около 42-44 МДж/кг в то время как, нитрометан даёт 11,3 МДж/кг. Этот расчёт показывает, что нитрометан производит примерно в 2,3 раза больше мощности по сравнению с обычным топливом.
Нитрометан часто используют в богатых воздушно-топливных смесях, поскольку он даёт энергию даже при отсутствии атмосферного кислорода. При использовании богатой воздушно-топливной смеси, часть продуктов сгорания — водород и монооксид углерода. Эти газы часто воспламеняются, иногда впечатляюще, когда очень богатые смеси ещё горящего топлива покидают выхлопные трубы. Очень богатые смеси необходимы, чтобы снизить температуру камеры сгорания, для управления предварительным зажиганием и устранения возможной детонации.
Небольшое количество гидразина, смешанное с нитрометаном, может ещё больше увеличить выдаваемую мощность. Гидразин образует с нитрометаном взрывоопасную соль, тоже монотопливо. Из-за опасности взрыва эта смесь запрещена к применению как авиамодельное топливо.
В авиамоделизме и автомобильном калильном топливе основной ингредиент обычно метанол, с небольшой добавкой нитрометана (от 0 % до 65 %, но редко больше 30 %, так как нитрометан дороже метанола) и 10-20 % смазки (обычно касторовое масло и/или синтетическое масло). Даже умеренные количества нитрометана приводят к увеличению мощности, выдаваемой двигателем (поскольку обычно ограничивающий фактор — приток воздуха), упрощая настройку двигателя (оптимизацию соотношения воздух/топливо).
Взрывчатые свойства
Нитрометан как взрывоопасное вещество привлёк особое внимание в 1958 году, когда с разницей в полгода в США произошли взрывы цистерн с нитрометаном при транспортировке по железной дороге. До этого нитрометан считался горючей, но не взрывоопасной жидкостью[8][9].
Очистка
Нитрометан замораживают, образующиеся кристаллы промывают диэтиловым эфиром, затем перегоняют.
Токсичность

Нитрометан — токсичное вещество. В соответствии с ГОСТ 12.1.005-76 нитрометан является токсичным малоопасным веществом по степени воздействия на организм, 4-го класса опасности[10]. При вдыхании паров в большой концентрации нитрометан поражает печень и почки, вредно воздействует центральную нервную систему. Наркотик, обладающий также судорожным действием и последействием.
Правовой статус
Нитрометан в концентрации 40% или более считается прекурсором (Таблица III), оборот которого в Российской Федерации ограничен.
Примечания
- name=https://www.safework.ru_Nitromethane
- http://www.cdc.gov/niosh/npg/npgd0457.html
- Источник: CH3NO2 in Physical and Thermodynamic Properties of Pure Chemicals: Data Compilation, ed. T. E. Daubert, et al., Taylor & Francis, Washington, DC, 1997. В других справочниках приводятся другие значения для давления.
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.007-76. ССБТ. Вредные вещества. Классификация и общие требования
- Архивная копия от 20 февраля 2012 на Wayback Machine Азеотропные смеси с нитрометаном
- Корольченко, Пожаровзрывоопасность веществ, 2004, с. 199.
- Bollmeier A. F. Nitroparaffins // Kirk-Othmer Encyclopedia of Chemical Technology. — John Wiley & Sons, Inc., 2000. — doi:10.1002/0471238961.1409201802151212.a02.
- 30 years ago (недоступная ссылка). HCB Publishing Ltd. (2013). Дата обращения: 19 ноября 2014. Архивировано 29 ноября 2014 года.
- Interstate Commerce Commission: Ex Parte No 213. Accident Near Mt. Pulaski, ILL (недоступная ссылка) (1958). Дата обращения: 19 ноября 2014. Архивировано 7 января 2009 года.
- name=https://docs.cntd.ru_ГОСТ(недоступная+ссылка) 12.1.005-76. Воздух рабочей зоны. Общие санитарно-гигиенические требования
Литература
- Корольченко А. Я., Корольченко Д. А. Пожаровзрывоопасность веществ и материалов и средства их тушения. Справочник: в 2-х частях. Часть 2. — М.: Ассоциация «Пожнаука», 2004. — 774 с. — ISBN 5-901283-02-3.
- Nitromethane (ANGUS Technical Bulletin). ANGUS Chemical Company. Дата обращения: 27 ноября 2014.