Тетранитрометан
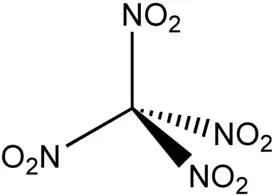
Тетранитрометан (устаревшее название: нитроформен) — химическое органическое соединение с формулой C(NO2)4, относящееся к алифатическим нитросоединениям. Молекула тетранитрометана симметрична и имеет форму тетраэдра, в центре которого расположен атом углерода, а по вершинам — четыре нитрогруппы NO2. При нормальных условиях чистый тетранитрометан представляет собой бесцветную маслянистую жидкость с резким запахом. Может применяться как сильный окислитель или нитрующий агент, поэтому основное применение находит в химической промышленности и как компонент ракетных топлив. В смесях с другими органическими веществами образует высокочувствительные и мощные взрывчатые вещества. Вещество токсично при вдыхании и попадании на кожу.
| Тетранитрометан | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Тетранитрометан |
| Сокращения | NSC 16146, TNM |
| Традиционные названия | Тетранитрометан; нитроформен |
| Хим. формула | C(NO2)4 |
| Рац. формула | CN4O8 |
| Физические свойства | |
| Состояние | бесцветная жидкость |
| Молярная масса | 196,04 г/моль |
| Плотность | 1,63944 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 14,2 °C |
| • кипения | 125,7 °C |
| • вспышки | 113 °C |
| Энтальпия | |
| • образования | –37,29 кДж/моль |
| Давление пара | 8,4 мм рт. ст. |
| Оптические свойства | |
| Показатель преломления | 1,4467 |
| Классификация | |
| Рег. номер CAS | 509-14-8 |
| PubChem | 24900040 |
| Рег. номер EINECS | 208-094-7 |
| SMILES | |
| InChI | |
| RTECS | PB4025000 |
| ChEBI | 82372 |
| Номер ООН | 1510 |
| ChemSpider | 13842838 |
| Безопасность | |
| Предельная концентрация | 0,3 мг/м3 (в воздухе) |
| ЛД50 | 130 мг/кг, крысы, перорально |
| Токсичность | ирритант, высокотоксичен |
| Фразы риска (R) | R8, R25, R26, R36/37/38, R40 |
| Фразы безопасности (S) | S17, S28, S36/37, S45 |
| Краткие характер. опасности (H) |
H271, H301, H319, H330, H335, H351 |
| Меры предостор. (P) |
P220, P260, P281, P284, P301+P310, P305+P351+P338 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Физические свойства
Тетранитрометан представляет собой бесцветную маслянистую высоколетучую жидкость с резким запахом. В различных справочниках физико-химические параметры тетранитрометана отличаются; в данном разделе приведены данные, принятые Международным бюро физико-химических эталонов и приведённые в обзоре по химии тетранитрометана 1976 года[1]. Плотность при 20 °С: 1,63944 г/см3. Температура плавления: 13,9 °С, температура кипения при нормальном давлении: 127,5 °С.
В воде не растворяется, также не растворяется в серной кислоте и многоатомных спиртах. Растворим в большом числе органических растворителей и в концентрированной азотной кислоте. При перегонке частично разлагается, его перегоняют с водяным паром.
Химические свойства
Ввиду наличия в одной молекуле четырёх нитрогрупп, тетранитрометан является сильным окислителем. Чистый тетранитрометан является слабым взрывчатым веществом, однако с органическими веществами образует взрывоопасные смеси, мощность которых больше, чем у нитроглицерина.
Тетранитрометан в воде или спиртовых растворах щелочей подвергается гидролизу с образованием тринитрометана или его солей:
Водные растворы щелочей полностью гидролизуют тетранитрометан:
Тетранитрометан в присутствии пиридина в щелочной среде нитрует органические соединения. При действии тетранитрометана корродируют медь и железо, устойчивы алюминий, нержавеющие сплавы и стекло.
Однако железо устойчиво к тетранитрометану, если к последнему добавить серную кислоту в количестве 0,2 % по массе. Это обстоятельство позволяет хранить и перевозить тетранитрометан в железной таре.
Получение
Впервые был синтезирован русским химиком Л. Н. Шишковым в 1857 году нитрованием тринитрометана[2]. Тетранитрометан получают различными способами[3][4], среди которых наиболее известны реакции деструктивного нитрования ацетилена, кетена или уксусного ангидрида концентрированной азотной кислотой.
Деструктивное нитрование уксусного ангидрида
Реакция деструктивного нитрования уксусного ангидрида протекает по уравнению:
Реагенты смешиваются в стехиометрическом соотношении и выдерживаются в течение 5-7 дней при температуре 25-28 оС. Выход продукта составляет 70-75 %. Образовавшийся в виде тяжёлой маслянистой жидкости тетранитрометан отделяют декантацией, перегоняют с водяным паром и сушат над хлоридом кальция. Этот метод удобен в лабораторных условиях. Его недостатком является длительность процесса нитрования[5]. Метод также применялся в промышленных масштабах в США компанией Nitroform Products, однако в 1953 году завод по производству тетранитрометана был полностью разрушен взрывом, вероятная причина которого — повышение температуры в реагирующей смеси вследствие неисправности мешалки или сенситизация смеси примесями катализатора[6].
Деструктивное нитрование ацетилена
Реакция деструктивного нитрования ацетилена концентрированной азотной кислотой протекает в соответствии со следующим глобальным уравнением:
При этом выход тетранитрометана составляет приблизительно 60 %. Этот метод применялся во время Второй мировой войны, при этом сам процесс нитрования проходил в две стадии. Сначала ацетилен нитровался до тринитрометана, который не выделялся из реакционной смеси. Затем на второй стадии, проводившейся с добавлением концентрированной серной кислоты, тринитрометан превращался в тетранитрометан, который отделялся от кислоты сепарацией. Реакция проводится при температуре 45-50 оС (но не выше 60 оС) в присутствии катализатора (нитрата ртути(II))[7].
Применение
В 1948 г. в НИИ-4 Академии Артиллерийских наук Министерства Вооружённых Сил СССР был испытан жидкостный ракетный двигатель, использующий тетранитрометан как окислитель. Руководителем работ был Н. Г. Чернышёв. Удельный импульс оказался на 20 % выше, чем у керосино-кислородных двигателей.
1 сентября 1949 г. в г. Чапаевск начал работу опытный завод Министерства сельскохозяйственного машиностроения (именно оно в те годы занималось выпуском ракет) по производству тетранитрометана.
Использованию тетранитрометана в качестве ракетного топлива мешает его высокая температура плавления.
Тетранитрометан применяется в основном для получения тринитрометана и в реакциях нитрования в лабораторной практике.
Безопасность
Чистый тетранитрометан — слабое взрывчатое вещество, малочувствительное к удару и другим способам инициирования. Однако при работе с ним необходимо строго соблюдать меры предосторожности, исключающие попадание в него органических примесей. Смеси тетранитрометана с органическими веществами являются мощными и высокочувствительными взрывчатыми веществами, чрезвычайно опасными в обращении[8].
Токсичность
Тетранитрометан является высокотоксичным веществом. В соответствии с ГОСТ 12.1.005-76 тетранитрометан по степени воздействия на организм человека относится к веществам второго класса опасности. Пороговая концентрация в воздухе — 0,003 мг/л, предельно допустимая концентрация — 0,001 мг/л[9] (в атмосферном воздухе); в воздухе рабочей зоны - составляет 0,3 мг/м3. При вдыхании вызывает раздражение дыхательных путей. При продолжительном воздействии вызывает метгемоглобинемию, отёк лёгких, поражает печень, почки и центральную нервную систему. Опасен при контакте со слизистыми и кожей, при подкожной инъекции может вызывать некроз тканей.
Опыты показали, что пары тетранитрометана могут вызывать образование злокачественных опухолей в лёгких (альвеолярные и бронхиальные аденомы и карциномы) у крыс и мышей. Также было отмечено возникновение редкой формы рака — плоскоклеточной карциномы. Вследствие этого, несмотря на отсутствие прямых экспериментальных подтверждений, тетранитрометан со значительной степенью вероятности считается канцерогенным веществом и для людей[10].
Примечания
- Алтухов, Перекалин, Химия тетранитрометана, 1976, с. 2052-2053.
- Алтухов, Перекалин, Химия тетранитрометана, 1976, с. 2051.
- Синтезы органических препаратов. Сборник 3. / Под ред. акад. Б. А. Казанского. — М.: Издательство иностранной литературы, 1952. — С. 411-413. — 581 с.
- Poe Liang. Tetranitromethane // Org. Synth.. — 1941. — Т. 21. — С. 105. — doi:10.15227/orgsyn.021.0105.
- Орлова, Химия и технология бризантных и взрывчатых веществ, 1973, с. 407.
- Urbansky, 1964, p. 593.
- Urbansky, 1964, p. 594.
- Орлова, Химия и технология бризантных и взрывчатых веществ, 1973, с. 406.
- Алтухов, Перекалин, Химия тетранитрометана, 1976, с. 2054.
- Tetranitromethane. (англ.) // Report on carcinogens : carcinogen profiles / U.S. Dept. of Health and Human Services, Public Health Service, National Toxicology Program. — 2011. — Vol. 12. — P. 402—403. — PMID 21863104.
Литература
- Алтухов К. В., Перекалин В. В. Химия тетранитрометана // Успехи химии. — 1976. — Т. 45, № 11. — С. 2050—2076.
- Химическая энциклопедия в пяти томах. Пол — Три. — М.: «Большая Российская Энциклопедия», 1995. — Т. 4. — С. 1102. — ISBN 5-85270-092-4.
- Кантемиров Б. Н. . Николай Гаврилович Чернышёв. — М.: Наука, 2012. — 175 с. — ISBN 978-5-02-037988-6.
- Нейланд О. Я. . Органическая химия: Учеб. для хим. спец. вузов. — М.: Высшая школа, 1990. — 751 с. — ISBN 5-06-001471-1.
- Орлова Е. Ю. . Химия и технология бризантных и взрывчатых веществ. — 2-е издание, переработанное и дополненное. — Л.: Химия, 1973. — 688 с.
- CRC Handbook of Chemistry and Physics / Ed. by D. R. Lide.. — 90th Edition. — CRC Press (Taylor and Francis Group), 2009. — 2804 p. — ISBN 978-1-4200-9084-0.
- Urbansky T. . Chemistry and Technology of Explosives. Vol. 1. — Pergamon Press, 1964. — 635 с. — ISBN 978-0080102382.
Ссылки
- Sigma-Aldrich. ИК-спектр тетранитрометана. Дата обращения: 5 декабря 2014.
