Бронхиальная астма
Бронхиа́льная а́стма[2] (от др.-греч. ἆσθμα — «тяжёлое дыхание, одышка», лат. Asthma bronchiale) — хроническое неинфекционное заболевание дыхательных путей. Ключевым звеном является бронхоспазм (сужение просвета бронхов), обусловленный специфическими иммунологическими (сенсибилизация и аллергия) или неспецифическими механизмами, проявляющийся повторяющимися эпизодами свистящих хрипов, одышки, приступов удушья, чувства стеснения в груди и кашля. Бронхиальная обструкция обратима частично или полностью, спонтанно или под влиянием лечения.
| Бронхиальная астма | |
|---|---|
 Различные ингаляторы, используемые при бронхиальной астме | |
| МКБ-11 | CA23 |
| МКБ-10 | J45 |
| МКБ-10-КМ | J45.90, J45 и J45.909 |
| МКБ-9 | 493 |
| МКБ-9-КМ | 493[1] и 493.9[1] |
| OMIM | 600807 |
| DiseasesDB | 1006 |
| MedlinePlus | 000141 |
| eMedicine | med/177 emerg/43 |
| MeSH | D001249 |
По оценкам ВОЗ, 339 миллионов человек страдают от астмы[3]. Для лечения используются симптоматические препараты, предназначенные для купирования приступа, и препараты базовой терапии, воздействующие на патогенетический механизм заболевания. Грозное осложнение заболевания — астматический статус[4]. Основополагающим документом является «GINA» — глобальная стратегия лечения и профилактики бронхиальной астмы[5].
История изучения
_constriction-animated.gif)
Слова ἆσθμα и ἀσθμαίνω в значениях «тяжёлое дыхание» и «задыхаться» встречаются в древнегреческой литературе начиная с поэм Гомера и продолжали использоваться в этом значении у Гиппократа, однако в «Corpus Hippocraticum» слово ἆσθμα употреблялось и как общее название заболеваний, сопровождающихся затруднением дыхания[6] — включая затруднения, сопровождающиеся сильным сердцебиением (сердечная астма) и заболевания дыхательных путей с выделением вязкой мокроты. Гиппократ также описал вынужденное «выпрямленное» положение больного во время приступов удушья — ортопноэ (др.-греч. ὀρθόπνοια), поместив описание симптомов астмы в своём труде об эпилепсии «О священной болезни»[7] — из-за спастического характера приступов эпилепсии и астмы.
В дальнейшем в греческой медицине были выделены три формы удушья: лёгкая хроническая форма — диспноэ (др.-греч. δύσπνοια); тяжёлая, сопровождающаяся приступами — астма; и тяжёлая с приступами и усилением удушья в лежачем положении — ортопноэ. В этой форме описания вошли и в римскую медицину: Авл Корнелий Цельс в своём труде «О медицине» описывал эти формы, ссылаясь на греков и используя греческие термины[8].
Более подробную и точную клиническую картину астмы описал Аретей Каппадокийский (I век н. э.) в своём сочинении «О причинах и симптомах хронических болезней», посвятив ей отдельную главу. Аретей в своём сочинении описал две формы болезни, сопровождающейся затруднением дыхания, отметив, что одна из них, характеризующаяся ортопноэ, связана с болезнью сердца; вторая же, провоцируемая холодным влажным воздухом и сопровождающаяся спастическим затруднением дыхания и хрипами, является заболеванием лёгких[9] — т. о. Аретей разделил астму на две формы: сердечную и бронхиальную. Клавдий Гален, написавший среди прочих сочинений работу «О затруднениях дыхания» (лат. De difficultate respirationis), придерживался гиппократова подхода к объяснению причин астмы, объясняя их накоплением в бронхах вязкой мокроты и, вслед за Аретеем, приняв разделение астмы на две формы.
Ибн Сина (X—XI вв.) в «Каноне врачебной науки» дал описание астмы, близкое к гиппократовому — как хроническую болезнь, сопровождающуюся внезапными приступами удушья, сходными своим спастическим характером с приступами эпилепсии; «Канон» Ибн Сины в переводе Герарда Кремонского на латынь получил распространение в средневековой Европе и стал одним из основных текстов, использовавшихся для обучения медиков в Италии на протяжении средневековья и Возрождения.
Первым отошёл от традиции Гиппократа основатель пневмохимии Ван Гельмонт (XVII век), выделивший в две формы затруднённого дыхания: «мокрую», сопровождающуюся отхаркиванием флегмы, и «сухую». Он также отметил, что приступы астмы провоцируются пылью и «жаренной на масле рыбой» и впервые провёл параллель между одновременной подверженностью приступами астмы и дерматитам — то есть, в современной терминологии, различными клиническими проявлениями аллергической реакции[10].
Этому заболеванию до середины XVIII века уделялось довольно мало внимания; по-видимому, врачи того времени не выделяли приступы удушья у больных в какую-то одну болезнь. Большой вклад в новое время в изучение астмы внесли немецкие учёные Куршман и Лейден. Именно они систематизировали и описали клинические проявления астмы, выделив ряд случаев внезапного удушья в отдельную болезнь. К сожалению, технический уровень того времени не позволял эффективно бороться с болезнью и однозначно установить её причину.
В начале XX века произошло создание аллергической теории бронхиальной астмы. Принадлежала она русским учёным Манойлову и Голубеву. К 1905 году относится первое задокументированное использование адреналина в лечении бронхиальной астмы[11]. Советские учёные А. Д. Адо и П. К. Булатов в 1969 году первыми предложили классификацию бронхиальной астмы по причинам её возникновения[12]. Оральные кортикостероиды начали применяться в 1950-х годах, селективные β2-адреномиметики короткого действия вошли в широкое применение в 1960-е годы[13][14].
Определение
Согласно глобальной стратегии GINA 2006, бронхиальная астма — «хроническое воспалительное заболевание дыхательных путей, в котором принимают участие многие клетки и клеточные элементы. Хроническое воспаление обусловливает развитие бронхиальной гиперреактивности, которая приводит к повторяющимся эпизодам свистящих хрипов, одышки, чувства заложенности в груди и кашля, особенно по ночам и ранним утром. Эти эпизоды обычно связаны с распространённой, но изменяющейся по своей выраженности обструкции дыхательных путей в лёгких, которая часто бывает обратима либо спонтанно, либо под действием лечения»[5].
По определению экспертов ВОЗ, бронхиальная астма — «хроническое заболевание, основой которого является воспалительный процесс в дыхательных путях с участием разнообразных клеточных элементов, включая тучные клетки, эозинофилы и Т-лимфоциты. У предрасположенных лиц этот процесс приводит к развитию генерализованной бронхиальной обструкции различной степени выраженности, полностью или частично обратимой спонтанно или под влиянием лечения. Воспалительный процесс вызывает также содружественное усиление ответа дыхательных путей в виде бронхиальной обструкции на различные внешние и внутренние стимулы»[15].
В конце XX века в СССР и России была популярна формулировка Г. Б. Федосеева (1982), согласно которому бронхиальная астма — «самостоятельное хроническое, рецидивирующее заболевание, основным и обязательным патогенетическим механизмом которого является изменённая реактивность бронхов, обусловленная специфическими иммунологическими (сенсибилизация и аллергия) или неспецифическими механизмами, а основным (обязательным) клиническим признаком — приступ удушья вследствие бронхоспазма, гиперсекреции и отёка слизистой оболочки бронхов»[16].
Эпидемиология
Заболеваемость бронхиальной астмой в мире составляет от 4 до 10 % населения[15]. В России, по разным данным, распространённость среди взрослого населения колеблется от 2,2[17] до 5—7 %, а в детской популяции этот показатель составляет около 10 %[18]. Заболевание может возникнуть в любом возрасте; примерно у половины больных бронхиальная астма развивается до 10 лет, ещё у трети — до 40 лет. Среди детей, больных бронхиальной астмой, мальчиков в два раза больше, чем девочек. К 30 годам соотношение полов выравнивается[16].
В исследованиях отмечаются относительно высокие показатели заболеваемости в Новой Зеландии, Великобритании, на Кубе. Это связывают с тем, что над островами повышается концентрация аллергенов как благодаря местной флоре, так и за счёт аллергенов, приносимых океаническими воздушными потоками[16].
С середины 1980-х годов отмечается рост заболеваемости бронхиальной астмой. Согласно проведённому анализу 34 исследований заболеваемости в Европе, в Австрии с 1992 по 2002 год заболеваемость среди детей увеличилась в 4 раза, в Италии с 1974 по 1998 — выросла с 7 до 13 %, во многих странах Европы (Великобритания, Финляндия, Швейцария) — росла до середины 1990-х годов, а в последнее время несколько снизилась. Напротив, в Германии с 1992 по 2001 год этот показатель остался на уровне 5 %. Рост заболеваемости связывают с загрязнением окружающей среды, малоактивным образом жизни, а снижение её в последние годы объясняют успехами базисной терапии. Так, внедрение профилактического лечения и обучения больных в Ирландии повлекло за собой снижение более чем в 5 раз заболеваемости школьников тяжёлой астмой за период с 1992 по 2002 год[19].
Этиология
Факторы развития заболевания
Существует целый ряд факторов риска, способствующих возникновению и развитию бронхиальной астмы у определённых лиц.
Наследственность
Генетическому фактору уделяется большое внимание. Описаны случаи конкордантности, то есть когда оба однояйцевых близнеца болели бронхиальной астмой. Часто в клинической практике встречаются случаи астмы у детей, матери которых больны астмой; или случаи в нескольких поколениях одной и той же семьи. В результате клинико-генеалогического анализа обнаружено, что у 1/3 больных заболевание носит наследственный характер. Существует термин атопическая бронхиальная астма — аллергическая (экзогенная) бронхиальная астма, имеющая наследственный характер. В этом случае, при наличии астмы у одного из родителей, вероятность астмы у ребёнка составляет 20—30 %, а если больны оба родителя, эта вероятность достигает 75 %[16].
Исследование «PASTURE», в рамках которого наблюдали за формированием атопии у новорождённых в семьях фермеров и у монозиготных близнецов показало, что, несмотря на генетическую предрасположенность, развитие заболевания можно предотвратить, исключая провоцирующие аллергены и путём коррекции иммунного ответа в период беременности. Норвежскими учёными (Matthias Wjst et al.) установлено, что место и время рождения не влияют на формирование аллергических реакций и бронхиальной астмы[19].
Профессиональные факторы
Влияние биологической и минеральной пыли, вредных газов и испарений на возникновение респираторных заболеваний исследовалось у 9144 человек в 26 центрах в исследовании ECRHS. Женщины в основном контактировали с биологической пылью, а мужчины в 3—4 раза чаще, чем женщины, — с минеральной пылью, вредными газами и испарениями. Хронический кашель с выделением мокроты чаще возникал у лиц, контактировавших с вредными факторами, именно в этой популяции зарегистрированы случаи впервые возникшей бронхиальной астмы. С течением времени неспецифическая гиперреактивность бронхов у лиц с профессиональной астмой не исчезает, даже при уменьшении контакта с вредным профессиональным фактором. Установлено, что тяжесть профессиональной астмы в основном определяется продолжительностью заболевания и выраженностью симптомов, не зависит от возраста, пола, вредного профессионального фактора, атопии, курения[19].
Экологические факторы
9-летнее эпидемиологическое исследование ECRHS-II, включившее 6588 здоровых лиц, подвергавшихся в течение указанного периода воздействию ряда неблагоприятных факторов (выхлопные газы, дым, повышенная влажность, вредные испарения и др.), показало, что у 3 % наблюдаемых в конце исследования возникли жалобы, соответствующие поражению дыхательной системы. После статистического анализа демографических, эпидемиологических и клинических данных был сделан вывод, что от 3 до 6 % новых случаев заболевания провоцируются воздействием поллютантов[19].
Питание
Исследования во Франции, Мексике, Чили, Великобритании, Италии по влиянию характера питания на течение заболевания показали, что лица, употребляющие продукты растительного происхождения, соки, богатые витаминами, клетчаткой, антиоксидантами, имеют незначительную тенденцию к более благоприятному течению бронхиальной астмы, в то время как употребление продуктов животного происхождения, богатых жирами, белками и рафинированными легкоусваемыми углеводами, связано с тяжёлым течением заболевания и частыми обострениями[19].
Моющие средства
10-летнее исследование ECRHS в 10 странах Евросоюза показало, что моющие средства для пола и чистящие аэрозоли содержат вещества, провоцирующие астму у взрослых; с применением этих средств связывают около 18 % новых случаев[19].
Микроорганизмы
Долгое время существовало представление о существовании астмы инфекционно-аллергической природы (классификация Адо и Булатова).
Избыточный вес
По данным различных исследований, у детей, которые страдают от ожирения, риск развития бронхиальной астмы увеличивается на 52 %[20].
Триггеры
Триггерами, то есть факторами, вызывающими приступы удушья и обострения заболевания, являются аллергены для экзогенной бронхиальной астмы и НПВП для аспириновой бронхиальной астмы, а также холод, резкие запахи, физическое напряжение, химические реагенты.

Аллергены
Большинство аллергенов содержится в воздухе. Это пыльца растений, микроскопические грибы, домашняя и библиотечная пыль, слущивающийся эпидермис, клещей домашней пыли, шерсть собак, кошек и других домашних животных. Степень реакции на аллерген не зависит от его концентрации[16]. В некоторых исследованиях показано, что взаимодействие с аллергенами клеща, домашней пыли, перхоти кошек и собак и грибка рода Aspergillus вызывает сенсибилизацию к этим аллергенам у детей до 3 лет. Связь между контактом с аллергеном и сенсибилизацией зависит от вида аллергена, дозы, длительности контакта, возраста ребёнка, а возможно, и от генетической предрасположенности[5].
Нестероидные противовоспалительные препараты
У некоторых больных приём НПВП вызывает удушье. Если непереносимость аспирина сочетается с рецидивирующими синуситами и полипозом носа, то говорят об астматической триаде. У этих больных можно наблюдать крапивницу, отёк Квинке, пищевую непереносимость, но поиски специфических антител реагиновой природы оказались безуспешными[16].
Астма нередко проявляется при недостатке витаминов В1 и D.
Патогенез
Ключевое звено бронхиальной астмы любого генеза — повышенная реактивность бронхиального дерева. Она обусловлена нарушением вегетативной регуляции тонуса гладких мышц и действием медиаторов воспаления и приводит к периодической обратимой обструкции бронхов, которая проявляется повышением сопротивления дыхательных путей, перерастяжением лёгких, гипоксемией, вызванной очаговой гиповентиляцией и несоответствием между вентиляцией и перфузией лёгких, гипервентиляцией[21].
Роль вегетативной нервной системы.
На гладкомышечных клетках находятся β1-, β2- и α- адренорецепторы. Преобладают β2-адренорецепторы, по сравнению с ними β1-адренорецепторов в 3 раза меньше. Стимуляция β2-адренорецепторов снижает реактивность бронхов у больных бронхиальной астмой, однако блокада β-адренорецепторов у здоровых лиц не вызывает заметного изменения реактивности бронхов, стимуляция α-адренорецепторов почти не влияет на тонус гладких мышц бронхов[21].
В норме тонус бронхиальной гладкой мускулатуры регулируют преимущественно парасимпатические волокна блуждающего нерва. Использование препаратов, блокирующих проведение возбуждения по парасимпатическим волокнам, приводит к расширению бронхов, а стимуляция этих волокон вызывает бронхоспазм. Тонус гладких мышц бронхов меняется и под действием афферентных волокон, идущих от рецепторов бронхов и входящих в состав блуждающего нерва. Симпатическая нервная система в норме играет незначительную роль в регуляции бронхиальной мускулатуры, но при бронхиальной астме её роль возрастает. Стимуляция немиелинизированных волокон (афферентных волокон типа C, расположенных в стенке бронхов и альвеол) медиаторами воспаления приводит к высвобождению нейропептидов, например вещества P, которые вызывают сужение бронхов, отёк слизистой и увеличение секреции слизи[21].
Биохимические факторы
Кальций играет важную роль в сокращении бронхиальной мускулатуры, так как АТФ-зависимый кальциевый насос, выводящий кальций из клетки, участвует в поддержании мембранного потенциала покоя гладкомышечных клеток. Повышение концентрации кальция внутри клетки приводит к сокращению, а уменьшение — к расслаблению гладкомышечной мускулатуры. Кроме того, повышение внутриклеточной концентрации кальция вызывает высвобождение гистамина, анафилактического фактора хемотаксиса эозинофилов и анафилактического фактора хемотаксиса нейтрофилов из тучных клеток. Предполагается, что в регуляции уровня кальция в тучных клетках участвуют адренорецепторы.
Циклические нуклеотиды (цАМФ и цГМФ) участвуют в регуляции сокращения гладкомышечных клеток бронхов и дегрануляции тучных клеток. Выброс медиаторов тучными клетками под действием M-холиностимуляторов и простагландина F2α опосредован повышением уровня цГМФ. Стимуляция α-адренорецепторов приводит к снижению уровня цАМФ, что также вызывает дегрануляцию тучных клеток. Стимуляция β-адренорецепторов приводит к повышению уровня цАМФ и, как следствие, к угнетению дегрануляции тучных клеток. Полагают, что блокада аденозиновых рецепторов также угнетает дегрануляцию.
В патогенезе экзогенной бронхиальной астмы также участвуют гепарин, тромбоксаны, серотонин, свободные радикалы кислорода, кинины, нейропептиды, протеазы и цитокины[21].
Участие клеток воспаления
Тучные клетки. Активация тучных клеток происходит при взаимодействии аллергенов с IgE, фиксированными на поверхности тучных клеток при экзогенной бронхиальной астме. В случае эндогенной астмы активация тучных клеток может происходить под влиянием осмотических стимулов, как например при астме физического усилия. Будучи активированными, они высвобождают медиаторы (гистамин, цистеиниловые лейкотриены, простагландин D2), вызывающие бронхоспазм[5]. Параллельно с этим, из фосфолипидов мембраны тучных клеток образуются арахидоновая кислота и фактор активации тромбоцитов. Из арахидоновой кислоты в свою очередь образуются лейкотриены и простагландины[21].
Эозинофилы. Количество эозинофилов в дыхательных путях повышено. Эти клетки выделяют основные белки, повреждающие бронхиальный эпителий, а также участвуют в высвобождении факторов роста и ремоделировании дыхательных путей[5].
T-лимфоциты. Их количество в дыхательных путях также повышено. Они высвобождают специфические цитокины (IL-4, IL-5, IL-9 и IL-13 и др.), влияющие на процесс эозинофильного воспаления и выработку IgE B-лимфоцитами. Регуляторные T-клетки угнетают Th2-лимфоциты, поэтому повышение активности Th2-клеток может происходить при снижении количества регуляторных T-клеток. Возможно увеличение числа inKT-клеток, выделяющих Th1- и Th2-цитокины в большом количестве[5].
Дендритные клетки захватывают аллергены с поверхности слизистой бронхов и приносят их в региональные лимфатические узлы, где взаимодействуя с регуляторными T-клетками стимулируют дифференцировку T-лимфоцитов в Th2-клетки[5].
Макрофаги. Количество макрофагов, как эозинофилов и T-лимфоцитов, повышено в дыхательных путях. Они могут активироваться при взаимодействии аллергенов с IgE с низкой аффинностью, в результате высвобождаются медиаторы воспаления и цитокины[5].
Нейтрофилы. Количество их в дыхательных путях и мокроте повышено у больных тяжёлой БА и курящих больных. Роль этих клеток в патогенезе не выяснена. Возможно повышение их количества является следствием терапии глюкокортикостероидами[5].
Медиаторы воспаления
Гистамин и лейкотриены относятся к медиаторам ранней фазы аллергической реакции немедленного типа. В результате действия гистамина возникает мгновенный и кратковременный бронхоспазм, лейкотриены же вызывают отсроченный и более длительный бронхоспазм. К медиаторам поздней фазы аллергической реакции немедленного типа относят факторы хемотаксиса и фактор активации тромбоцитов. Последние вызывают хемотаксис, активацию клеток воспаления в слизистой бронхов и стимулируют синтез лейкотриенов в этих клетках. Бронхоспазм, вызываемый ими, возникает через 2—8 часа после начала аллергической реакции и может длиться несколько суток[21].
Участие структурных клеток дыхательных путей
Структурные клетки дыхательных путей также вносят свой вклад в развитие воспаления. Так клетки бронхиального эпителия при распознавании своего механического окружения экспрессируют различные белки и высвобождают цитокины, хемокины и липидные медиаторы. Аналогичные воспалительные белки продуцируются гладкомышечными клетками. Эндотелиальные клетки участвуют в процессах миграции клеток воспаления в дыхательные пути. Фибробласты и миофибробласты, за счёт выработки коллагена, протеогликанов и других компонентов соединительной ткани, участвуют в ремоделировании дыхательных путей[5].
Бронхиальная обструкция
Патологические изменения, приводящие к обструкции бронхов, затрагивают слизистую оболочку, подслизистый слой и мышечную оболочку бронхиального дерева. Патологический процесс распространяется от трахеи и крупных бронхов к терминальным бронхиолам. К сужению бронхов приводят следующие причины:
- Образование слизистых пробок. При астме образуется густая, вязкая слизь, содержащая слущенный эпителий бронхов, эозинофилы, кристаллы Шарко-Лейдена. Слизь может частично или полностью закупоривать просвет бронхов. С длительностью и тяжестью приступа из-за дегидратации слизь становится более вязкой.
- Изменения стенки бронхов. При астме количество клеток мерцательного эпителия уменьшается, а бокаловидные клетки, секретирующие слизь, количественно увеличиваются и подвергаются гиперплазии. Возникают также эозинофильная инфильтрация, отёк и утолщение базальной мембраны, в подслизистом слое наблюдаются инфильтрация эозинофилами, нейтрофилами, лимфоцитами и макрофагами, гипертрофия и отёк желёз. Мышечная оболочка бронхов гипертрофируется.
- Спазм гладкой мускулатуры бронхов является наиболее вероятной причиной острых кратковременных приступов. Длительность приступов и невосприимчивость к лечению обусловлены закупоркой бронхов слизистыми пробками и отёком слизистой бронхов.
Обструкция усиливается на выдохе, так как в этом случае происходит динамическое сужение дыхательных путей.
Из-за обструкции бронхов часть воздуха задерживается в альвеолах, что приводит к перерастяжению лёгких и удлинению выдоха. Избыточное сопротивление дыхательных путей приводит к увеличению работы дыхания, что ведёт к включению вспомогательных мышц, одышке. В процесс могут быть вовлечены крупные и средние бронхи, однако чаще на первый план выступает обструкция мелких бронхов. Шумное, свистящее дыхание — признак обструкции крупных бронхов, а приступы одышки и кашля чаще возникают при обструкции мелких бронхов. Обструкция ведёт к увеличению остаточного объёма, уменьшению ЖЕЛ и повышению общей ёмкости лёгких. Вследствие обструкции дыхательных путей снижается их вентиляция. В норме снижается перфузия плохо вентилируемых участков, но при астме это происходит далеко не всегда, равновесие между вентиляцией и перфузией нарушается, что приводит к снижению paO2. При лёгких и среднетяжелых приступах бронхиальной астмы возникает гипервентиляция, которая приводит к уменьшению paCO2 и дыхательному алкалозу. При тяжёлых и длительных приступах развивается гиповентиляция, повышается paCO2 и возникает дыхательный ацидоз. Перерастяжение лёгких и снижение paO2 в альвеолах вызывают капилляроспазм альвеол и повышение давления в лёгочной артерии[21].
Клиническая картина
Основными симптомами бронхиальной астмы являются эпизоды одышки, свистящие хрипы, кашель и заложенность в грудной клетке. Существенное значение имеет появление симптомов после контакта с аллергеном, сезонная вариабельность симптомов и наличие родственников с бронхиальной астмой или другими атопическими заболеваниями. При сочетании с ринитом симптомы астмы могут либо появляться только в определённое время года, либо присутствовать постоянно с сезонными ухудшениями. У некоторых пациентов сезонное увеличение уровня в воздухе определённых аэроаллергенов (например, пыльца Alternaria, берёзы, травы и амброзии) вызывает развитие обострений.
Указанные симптомы могут также развиваться при контакте с неспецифическими ирритантами (дымом, газами, резкими запахами) или после физической нагрузки, могут обостряться в ночные часы и уменьшаться в ответ на базисную терапию[5].
Приступ удушья — наиболее типичный симптом астмы. Характерно вынужденное положение (часто сидя, держась руками за стол), поза больного - с приподнятым верхним плечевым поясом, грудная клетка приобретает цилиндрическую форму. Больной делает короткий вдох и без паузы продолжительный мучительный выдох, сопровождаемый дистанционными хрипами. Дыхание происходит с участием вспомогательной мускулатуры грудной клетки, плечевого пояса, брюшного пресса. Межрёберные промежутки расширены, втянуты и расположены горизонтально. Перкуторно определяется коробочный лёгочный звук, смещение вниз нижних границ лёгких, экскурсия лёгочных полей едва определяется.
Часто, особенно при затяжных приступах, возникает боль в нижней части грудной клетки, связанная с напряжённой работой диафрагмы. Приступу удушья может предшествовать аура приступа, проявляющаяся чиханием, кашлем, ринитом, крапивницей, сам приступ может сопровождаться кашлем с небольшим количеством стекловидной мокроты, также мокрота может отделяться в конце приступа. При аускультации определяется ослабленное дыхание, сухие рассеянные хрипы. Сразу же после кашлевых толчков слышно увеличение количества свистящих хрипов, как в фазе вдоха, так и на выдохе, особенно в задненижних отделах, что связано с секрецией мокроты в просвет бронхов и её пассажем. По мере отхождения мокроты количество хрипов уменьшается и дыхание из ослабленного становится жёстким[16].
Хрипы могут отсутствовать у больных с тяжёлыми обострениями вследствие тяжёлого ограничения воздушного потока и вентиляции. В период обострения отмечаются также цианоз, сонливость, затруднения при разговоре, тахикардия. Вздутая грудная клетка является следствием повышенных лёгочных объёмов — необходимо обеспечивать «расправление» дыхательных путей и раскрытие мелких бронхов. Сочетание гипервентиляции и бронхиальной обструкции значительно увеличивает работу дыхательных мышц[5].
Между приступами у больных может не наблюдаться никаких признаков болезни. В межприступный период у пациентов чаще всего выявляются свистящие хрипы при аускультации, подтверждающие наличие остаточной бронхиальной обструкции. Иногда (и порой одновременно с выраженной обструкцией бронхов) свистящие хрипы могут отсутствовать или обнаруживаться только во время форсированного выдоха[5].
Особым клиническим вариантом является кашлевой вариант астмы, при котором единственным проявлением заболевания является кашель. Этот вариант чаще распространён у детей, наиболее выраженные симптомы обычно отмечаются в ночное время при частом дневном отсутствии симптомов. Важность в диагностике имеет исследование вариабельности показателей функции дыхания или бронхиальной гиперреактивности, а также эозинофилия мокроты. Кашлевой вариант астмы следует различать с эозинофильным бронхитом, при котором отмечаются кашель и эозинофилия мокроты, однако показатели функции дыхания и бронхиальная реактивность остаются в норме[5].
Бронхиальная астма физического усилия. У некоторых пациентов единственным триггером приступа является физическая активность. Приступ обычно развивается через 5—10 мин после прекращения нагрузки и редко — во время нагрузки. Пациенты иногда отмечают длительный кашель, который самостоятельно проходит в течение 30—45 мин. Приступы чаще провоцируются бегом, имеет значение при этом вдыхание сухого холодного воздуха. В пользу диагноза бронхиальной астмы говорит прекращение приступа после ингаляции β2-агонистов или предотвращение симптомов благодаря ингаляции β2-агонистами до нагрузки. Основной метод диагностики — тест с 8-минутным бегом[5].
Исследование функции внешнего дыхания
Для определения функции внешнего дыхания повсеместно у пациентов в возрасте старше 5 лет используются спирометрия (позволяющая выявить объём форсированного выдоха за 1-ю секунду (ОФВ1) и форсированную жизненную ёмкость лёгких (ФЖЕЛ)) и пикфлоуметрия (позволяющая выявить пиковую скорость выдоха (ПСВ)).
Существуют т. н. должные показатели ОФВ1, ФЖЕЛ и ПСВ, которые были получены в результате проведения популяционных исследований. Они зависят от возраста, пола и роста исследуемого. Эти показатели постоянно пересматриваются. Показатели, полученные у конкретного пациента выражаются в процентном соотношении к должным величинам. Для ПСВ характерны очень широкие границы колебаний должных значений.
Термином «обратимость» обозначается прирост ОФВ1 (или реже ПСВ) через несколько минут после ингаляции бронхолитика быстрого действия (200—400 мкг сальбутамола, или беротека). Иногда под обратимостью понимают улучшение функции лёгких, развивающееся через несколько дней или недель после назначения или коррекции базисной терапии.
Спирометрия является методом выбора для оценки выраженности и обратимости бронхиальной обструкции. Показатели ОФВ1 и ФЖЕЛ измеряют с использованием спирометра при форсированном выдохе. Общепринятым критерием диагностики бронхиальной астмы служит прирост ОФВ1 на 12 % и более по сравнению со значением до ингаляции бронхолитика. Чувствительность теста низкая, особенно когда пациент получает какую-то (бронхолитическую или базисную) терапию. Пациентов необходимо обучить правильности выполнения форсированного выдоха, требуется провести дыхательный манёвр трижды и зафиксировать лучший из полученных результатов. Для дифференцирования бронхиальной обструкции от других заболеваний лёгких, сопровождающихся изменением ОФВ1 важно определять отношение ОФВ1/ФЖЕЛ, называемое индексом Тиффно (ИТ). В норме ИТ >0,75—0,80, а у детей может быть >0,9. Снижение этого отношения ниже указанных значений позволяет заподозрить бронхиальную обструкцию, характерную для ХОБЛ и бронхиальной астмы.
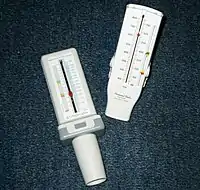
Пикфлоуметрия, позволяющая определить пиковую скорость выдоха, является важным методом диагностики и оценки эффективности лечения.
Современные пикфлоуметры недорого стоят, портативные, они являются идеальным выбором для ежедневной оценки выраженности бронхиальной обструкции пациентами в домашних условиях. Измерением ПСВ нельзя подменять определение других показателей функции лёгких, при определении ПСВ без ОФВ1 возможна недооценка тяжести обструкции, особенно при нарастании тяжести бронхиальной обструкции и появлении «воздушных ловушек». Так как использование разных пикфлоуметров может приводить к разнице значений ПСВ (учитывая также, что диапазон должных значений ПСВ очень широк), предпочтительно сравнивать результаты ПСВ у конкретного пациента с его собственными лучшими показателями с использованием личного пикфлоуметра пациента. Лучший показатель обычно регистрируют в период ремиссии заболевания. Так как результаты зависят от усилия выдоха пациента, следует тщательно инструктировать пациента. ПСВ обычно измеряют утром (после пробуждения и до приёма препаратов) и вечером (перед сном). Суточную вариабельность ПСВ определяют следующим образом, где A — суточная вариабельность ПСВ, V1 — ПСВ утром, V2 — ПСВ вечером:
Чем выше вариабельность ПСВ, тем хуже контролируется астма. Определяют также отношение разности ПСВ за сутки к усреднённой ПСВ за 1—2 недели. Другой способ определения вариабельности ПСВ является определение минимальной за 1 неделю ПСВ в процентах от самого лучшего в этот же период показателя. Этот способ, возможно, является лучшим для оценки лабильности просвета бронхов в клинической практике, поскольку полученный показатель проще рассчитать, и он лучше других параметров коррелирует с бронхиальной гиперреактивностью, и требует измерение ПСВ только один раз в день. Определение ПСВ и различных вариантов её вариабельности используют для оценки проводимой терапии, выявления провоцирующих факторов, прогноза обострений[5].
Диагностика
При постановке диагноза бронхиальной астмы учитываются следующие ключевые моменты:
- жалобы (кашель, одышка, приступы удушья, затруднение при выполнении физической нагрузки), анамнез заболевания, клинические проявления (прерывистая речь, положение ортопноэ);
- результаты физикального обследования (ускорение или замедление ЧСС, одышка, сухие свистящие хрипы, усиливающиеся на выдохе);
- исследование функции внешнего дыхания (снижение значений ОФВ1, и увеличении ОФВ1 после пробы с броходилятаторами более чем на 12 % от начального, уменьшение ФЖЕЛ, снижение ПСВ и увеличение её суточной вариабельности);
- наличие эозинофилов в мокроте или бронхиальном секрете, эозинофилия крови, мокрота вязкая, трудноотделяемая, чаще двухслойная, с большим количеством эозинофилов, спиралей Куршмана (переплетения мелких бронхов), кристаллов Шарко-Лейдена (некротизированные нейтрофилы, ранее инфильтрировавшие стенку бронха);
- аллергологический статус: кожные (аппликационные, скарификационные, внутрикожные) пробы, назальные, конъюнктивальные, ингаляционные пробы, радиоаллергосорбентный тест, определение общего и специфического IgE[15].
Очень часто врач может поставить диагноз бронхиальной астмы на основе клинической картины.
При подозрении на наличие у больного бронхиальной астмы оценивают следующие клинические критерии:
- возникают ли у пациента эпизоды свистящих хрипов, в том числе и повторяющиеся;
- беспокоит ли пациента кашель по ночам;
- возникают ли у пациента свистящие хрипы и кашель через 10—20 минут после физической нагрузки;
- бывают ли у пациента эпизоды кашля, сухих хрипов, одышки после встречи с провоцирующими факторами (аллергенами, поллютантами);
- отмечает ли пациент переход инфекции на нижние дыхательные пути, если ОРВИ длится более 10 дней;
- уменьшается ли выраженность жалоб после приёма специфических противоастматических препаратов.
Наличие одного или нескольких данных симптомов позволяет врачу убедиться в необходимости дальнейшего обследования для окончательного уточнения диагноза[5].
Клинически бронхиальная астма вне обострения может не проявлять себя или протекать по кашлевому варианту, когда единственным признаком заболевания будет кашель с отхождением незначительного количества мокроты. Зачастую кашлевой вариант бронхиальной астмы без проведения инструментально — лабораторных методов исследования диагностируется как бронхит. На первый план в таких случаях выходят функциональные дыхательные пробы с бронходилятаторами и лабораторные исследования крови и мокроты[5].
Постановка диагноза бронхиальная астма, особенно на ранних этапах, при слабо выраженной клинике требует проведения функциональных проб с бронходилятаторами, которые позволяют выявить наличие клинически не выраженного бронхоспазма и определить степень обратимой бронхиальной обструкции.
У пациентов с характерными жалобами, с нормальными показателями функции лёгких, для достоверной постановки диагноза проводится исследование бронхиальной реактивности, что включает исследование функции внешнего дыхания с проведением фармакологических проб с гистамином, метахолином или бронходилататорами[5]. У большинства больных с атопической астмой имеется аллергия, которую можно выявить с помощью кожных скарификационных тестов. Они также позволяют обнаружить провоцирующий фактор.
У некоторых больных с бронхиальной астмой можно найти гастроэзофагеальную рефлюксную болезнь. Другие исследования (например рентгенография грудной клетки или компьютерная томография) могут понадобиться для исключения других заболеваний лёгких.
Классификация
Бронхиальная астма классифицируется в зависимости от происхождения, тяжести заболевания, выделяются также особые формы бронхиальной астмы.
Этиологическая классификация
В зависимости от причин, вызывающих приступы, выделяют:
- экзогенную бронхиальную астму — приступы вызываются при воздействии на дыхательные пути аллергена, поступающего из внешней среды (пыльца растений, плесневые грибки, шерсть животных, мельчайшие клещи, находящиеся в домашней пыли); особым вариантом является атопическая бронхиальная астма, вызванная наследственно-обусловленной предрасположенностью к аллергическим реакциям;
- эндогенную бронхиальную астму — приступ вызывают такие факторы, как инфекция, физическая нагрузка, холодный воздух, психо-эмоциональные раздражители;
- бронхиальную астму смешанного генеза — приступы могут возникать как при воздействии на дыхательные пути аллергена, так и при воздействии перечисленных выше факторов.
| Признаки | Атопический вариант | Инфекционно-зависимый вариант |
|---|---|---|
| Аллергические заболевания в семье | Часто | Редко (кроме астмы) |
| Атопические болезни у пациента | Часто | Редко |
| Связь приступа с внешним аллергеном | Часто | Редко |
| Особенности приступа | Острое начало, быстрое развитие, обычно малая длительность и лёгкое течение | Постепенное начало, большая длительность, часто тяжёлое течение |
| Патология носа и придаточных пазух | Аллергический риносинусит или полипоз без признаков инфекции | Аллергический риносинусит, часто полипоз, признаки инфекции |
| Бронхолёгочный инфекционный процесс | Обычно отсутствует | Часто хронический бронхит, пневмония |
| Эозинофилия крови и мокроты | Как правило, умеренная | Часто высокая |
| Специфические антитела IgE к неинфекционным аллергенам | Присутствуют | Отсутствуют |
| Кожные пробы с экстрактами неинфекционных аллергенов | Положительные | Отрицательные |
| Тест с физической нагрузкой | Чаще отрицательный | Чаще положительный |
| Элиминация аллергена | Возможна, часто эффективна | Невозможна |
| Бета-адреностимуляторы | Очень эффективны | Умеренно эффективны |
| Холинолитики | Малоэффективны | Эффективны |
| Эуфиллин | Очень эффективен | Умеренно эффективен |
| ИнталТайлед | Очень эффективен | Эффективен реже |
| Кортикостероиды | Эффективны | Эффективны |
Стратификация тяжести
При оценке тяжести заболевания учитывают
- количество ночных симптомов в месяц, неделю, сутки;
- количество дневных симптомов в неделю, день;
- выраженность нарушений физической активности и сна;
- лучшие показатели ОФВ1 и ПСВ за сутки;
- суточные колебания ОФВ1 и ПСВ.
В стратификации астмы по степени тяжести имеется понятие ступени, соответствующей определённым градациям признаков симптомокомплекса астмы. Выделяют четыре ступени, если пациент не принимает базисных препаратов, то каждая из этих ступеней соответствует одной из четырёх степеней тяжести:[23]
Ступень 1. Интермиттирующая астма
- Приступы болезни возникают редко (менее одного раза в неделю).
- Короткие обострения.
- Ночные приступы болезни возникают редко (не чаще двух раз в месяц).
- ОФВ1 или ПСВ более 80 % от нормы.
- Разброс ПСВ менее 20 %.
Ступень 2. Лёгкая персистирующая астма
- Симптомы болезни возникают чаще 1 раза в неделю, но реже 1 раза в день.
- Обострения могут нарушать сон больного, угнетать физическую активность.
- Ночные приступы болезни возникают, по меньшей мере, 2 раза в месяц.
- ОФВ1 или ПСВ более 80 % от нормы.
- Разброс ПСВ 20—30 %.
Ступень 3. Персистирующая астма средней тяжести
- Приступы астмы возникают практически ежедневно.
- Обострения нарушают сон больного, снижают физическую активность.
- Ночные приступы болезни случаются очень часто (чаще 1 раза в неделю).
- ОФВ1 или ПСВ снижаются до показателей от 60 % до 80 % от нормальной величины.
- Разброс ПСВ более 30 %
Ступень 4. Тяжёлая персистирующая астма
- Приступы болезни возникают ежедневно.
- Ночные приступы астмы случаются очень часто.
- Ограничение физической активности.
- ОФВ1 или ПСВ составляют около 60 % от нормы.
- Разброс ПСВ более 30 %.
Если пациент находится на базисной терапии, степень тяжести заболевания определяется ступенью и дозировкой базисного препарата (о низких, средних и высоких дозах смотрите в разделе ИГКС):[23]
| Ступень | низкие дозы | средние дозы | высокие дозы |
|---|---|---|---|
| Ступень 1 | Интермиттирующая | Лёгкая персистирующая | Персистирующая средней тяжести |
| Ступень 2 | Лёгкая персистирующая | Персистирующая средней тяжести | Тяжёлая персистирующая |
| Ступень 3 | Персистирующая средней тяжести | Тяжёлая персистирующая | Тяжёлая персистирующая |
| Ступень 4 | Тяжёлая персистирующая | Тяжёлая персистирующая | Тяжёлая персистирующая |
Классификация тяжести обострения астмы
Обострения бронхиальной астмы — это эпизоды прогрессивного нарастания одышки, кашля, свистящих хрипов, чувства сдавления грудной клетки. В это время просвет бронхов сужается, что сопровождается снижением пиковой скорости выдоха (ПСВ), объёма форсированного выдоха за 1 секунду (ОФВ1), форсированной жизненной ёмкости лёгких (ФЖЕЛ). Для оценки тяжести обострения проводят физикальное обследование, исследование функции внешнего дыхания, исследование газов артериальной крови, ЭКГ, рентгенографию органов грудной клетки[24].
| Признаки | Лёгкое обострение | Среднетяжёлое обострение | Тяжёлое обострение | Угроза апноэ |
|---|---|---|---|---|
| Ограничение двигательной активности | Нет | Есть (предпочитают сидеть) | Выраженное (двигаются с трудом) | |
| Разговор | Не затруднён (предложения) | Короткие фразы | Отдельные слова | |
| Сознание | Возможно возбуждение | Обычно возбуждён | Обычно возбуждён | Спутанность |
| ЧДД | Норма или повышена (До 30 % от N) | Повышена на 30—50 % от N | Более 30 в мин (на 50 % превышает норму) | |
| Участие вспомогательной мускулатуры в акте дыхания, втяжение яремной ямки | Обычно нет | Обычно есть | Есть, резко выражено | Парадоксальные торакоабдоминальные движения |
| Свистящее дыхание | Умеренное, в конце выдоха | Громкое, весь выдох | Обычно громкое, на вдохе и выдохе | Отсутствие свистов |
| Аускультация | Сухие хрипы на выдохе | Дыхание мозаичное, хрипы на вдохе и выдохе | Ослабленное дыхание | «Немое лёгкое» |
| Пульс | Менее 100 | 100—120 | Более 120 | Брадикардия |
| Парадоксальный пульс | Отсутствует, <10 мм рт. ст. | Может быть, 10—25 мм рт. ст. | Часто бывает, >25 мм рт. ст. | Отсутствует (свидетельство мышечного утомления) |
| ПСВ после приёма бронходилятатора | Более 80 % от должной | 60—80 % от должной | Менее 60 % от должной или ПСВ менее 100 л в минуту, или улучшение сохраняется менее 2 часов | |
| Газы артериальной крови: кислород, РаО2 | Норма (95 мм рт. ст) | Более 60 мм рт. ст. | Менее 60 мм рт. ст., возможен цианоз | |
| Газы артериальной крови: двуокись углерода, РаСО2 | Менее 45 мм рт.ст (в норме — 40 мм рт. ст.) | Менее 45 мм рт. ст. | Более 45 мм рт. ст. Возможно дыхательное утомление | |
| Насыщение крови кислородом, SaO2 | Более 95 % | 91—95 % | Менее 90 % |
Особые формы бронхиальной астмы
Существует несколько обособленных клинико-патогенетических вариантов: рефлюкс-индуцированная бронхиальная астма, аспириновая бронхиальная астма, бронхиальная астма физического усилия, профессиональная астма, ночная астма.
Рефлюкс-индуцированная бронхиальная астма
Приступ удушья, связанный с аспирацией желудочного содержимого, впервые описал канадский врач Уильям Ослер (1849—1919) в 1892 году. В дальнейшем был предложен термин рефлюкс-индуцированная астма. Особый интерес представляет патологический гастроэзофагеальный рефлюкс (ГЭР), рассматриваемый в качестве причины приступов астмы, чаще всего в ночное время. Гастроэзофагеальный рефлюкс имеется у 50—60 % детей и более, страдающих бронхиальной астмой[25].
Согласно современным представлениям, патогенез лёгочных заболеваний, в том числе и бронхиальной астмы, возникающих на фоне ГЭРБ, связан с двумя механизмами. Первый — аспирационный, когда развитие бронхоспазма происходит в результате заброса желудочного содержимого в просвет бронхиального дерева; второй — рефлекторный, когда агрессивные компоненты рефлюксата, попадая в пищевод при рефлюксе, стимулируют вагусные рецепторы пищевода, индуцируя, в результате, приступы удушья.
Микроаспирация в результате ГЭР может стать причиной развития таких состояний, как хронический бронхит, повторные пневмонии, лёгочный фиброз, эпизоды удушья, апноэ сна. Микроаспирация кислого содержимого ведёт к формированию воспалительных процессов в бронхиальном дереве, повреждению слизистой оболочки дыхательных путей, ведущее к развитию бронхоспазма, увеличению выработки секрета бронхиального дерева.
При подозрении на рефлюксную природу бронхиальной астмы проводят диагностику ГЭРБ (суточную pH-метрию) и, если диагноз подтверждается, лечение ГЭРБ[26].
Формулировка диагноза
Диагноз бронхиальной астмы выставляется по следующей схеме:
Бронхиальная астма, <происхождение>, <степень тяжести>, <ремиссия или обострение с указанием степени тяжести обострения>
В случае необходимости эта схема уточняется эпитетами, такими как «аспириновая», «стероидозависимая» и т. п. Далее формулируются сопутствующие синдромы и заболевания[27].
Примеры диагнозов:
- Бронхиальная астма, экзогенная, интермиттирующее течение, ремиссия. Аллергический интермиттирующий ринит, вне обострения.
- Бронхиальная астма, смешанная, лёгкое течение, обострение средней степени тяжести. Аллергический персистирующий риноконъюнктивит, обострение. Хронический бронхит, обострение
- Бронхиальная астма, экзогенная, средней степени тяжести, лёгкое обострение. Аллергическая реакция по типу острой крапивницы.
- Бронхиальная астма, эндогенная, стероидозависимая, тяжёлое течение, тяжёлое обострение. ХОБЛ II стадии, средней степени тяжести, смешанный тип с преобладанием эмфиземы, обострение II типа по N. Anthonisen. ВН III. ДН I.
- Аспириновая бронхиальная астма, эндогенная, средней степени тяжести, тяжёлое обострение. Хронический полипозный гаймороэтмоидит с полипами в носу. Непереносимость препаратов пиразолонового ряда.
Лечение
Для лечения бронхиальной астмы используются препараты базисной терапии, воздействующие на механизм заболевания, посредством которых пациенты контролируют астму, и симптоматические препараты, влияющие только на гладкую мускулатуру бронхиального дерева и снимающие приступ.
К препаратам симптоматической терапии относят бронходилятаторы:
- β2-адреномиметики
- ксантины
К препаратам базисной терапии относят
- кромоны
- ингаляционные глюкокортикостероиды
- антагонисты лейкотриеновых рецепторов
- моноклональные антитела
Если не принимать базисную терапию, со временем будет расти потребность в ингаляции бронходилататоров (симптоматических средств). В этом случае и в случае недостаточности дозы базисных препаратов рост потребности в бронходилататорах является признаком неконтролируемого течения заболевания[28].
Кромоны
К кромонам относят кромогликат натрия (Интал) и недокромил натрия (Тайлед). Эти средства показаны в качестве базисной терапии бронхиальной астмы интермиттирующего и лёгкого течения. Кромоны уступают по своей эффективности ИГКС[29]. Так как существуют показания для назначения ИГКС уже при лёгкой степени бронхиальной астмы[23], кромоны постепенно вытесняются более удобными в использовании ИГКС. Не оправдан также переход на кромоны с ИГКС при условии полного контроля над симптомами минимальными дозами ИГКС[30].
Глюкокортикостероиды
При астме применяются ингаляционные глюкокортикостероиды, которым не свойственно большинство побочных действий системных стероидов. При неэффективности ингаляционных кортикостероидов добавляют глюкокортикостероиды для системного применения.
Ингаляционные глюкокортикостероиды (ИГКС)
ИГКС — основная группа препаратов для лечения бронхиальной астмы. Ниже представлена классификация ингаляционных глюкокортикостероидов в зависимости от химической структуры:
- Негалогенированные
- будесонид (Пульмикорт, Бенакорт, Буденит Стери-Неб)
- циклесонид (Альвеско)
- Хлорированные
- беклометазона дипропионат (Бекотид, Беклоджет, Кленил, Беклазон Эко, Беклазон Эко Лёгкое Дыхание)
- мометазона фуроат (Асманекс)
- Фторированные
- флунизолид (Ингакорт)
- триамценолона ацетонид
- азмокорт
- флутиказона пропионат (Фликсотид)
Противовоспалительный эффект ИГКС связан с подавлением деятельности клеток воспаления, уменьшением продукции цитокинов, вмешательством в метаболизм арахидоновой кислоты и синтез простагландинов и лейкотриенов, снижением проницаемости сосудов микроциркуляторного русла, предотвращением прямой миграции и активации клеток воспаления, повышением чувствительности b-рецепторов гладкой мускулатуры. ИГКС также увеличивают синтез противовоспалительного белка липокортина-1, путём ингибирования интерлейкина-5 увеличивают апоптоз эозинофилов, тем самым снижая их количество, приводят к стабилизации клеточных мембран. В отличие от системных глюкокортикостероидов, ИГКС липофильны, имеют короткий период полувыведения, быстро инактивируются, обладают местным (топическим) действием, благодаря чему имеют минимальные системные проявления. Наиболее важное свойство — липофильность, благодаря которому ИГКС накапливаются в дыхательных путях, замедляется их высвобождение из тканей и увеличивается их сродство к глюкокортикоидному рецептору. Лёгочная биодоступность ИГКС зависит от процента попадания препарата в лёгкие (что определяется типом используемого ингалятора и правильностью техники ингаляции), наличия или отсутствия носителя (лучшие показатели имеют ингаляторы, не содержащие фреон) и от абсорбции препарата в дыхательных путях.
До недавнего времени главенствующией концепцией назначения ИГКС была концепция ступенчатого подхода, что означает что при более тяжёлых формах заболевания назначаются более высокие дозы ИГКС.
| Эквивалентные дозы ИГКС, мкг | ||||
|---|---|---|---|---|
| Международное название | Низкие дозы | Средние дозы | Высокие дозы | |
| Беклометазона дипропионат | 200—500 | 500—1000 | 1000 | |
| Будесонид | 200—400 | 400—800 | 800 | |
| Флунизолид | 500—1000 | 1000—2000 | 2000 | |
| Флутиказона пропионат | 100—250 | 250—500 | 500 | |
| Триамсинолона ацетонид | 400—1000 | 1000—2000 | 2000 | |
Основой терапии для длительного контроля воспалительного процесса являются ИГКС, которые применяются при персистирующей бронхиальной астме любой степени тяжести и по сей день остаются средствами первой линии терапии бронхиальной астмы. Согласно концепции ступенчатого подхода: «Чем выше степень тяжести течения БА, тем большие дозы ингаляционных стероидов следует применять». В ряде исследований показано, что у пациентов, начавших лечение ИГКС не позже 2 лет от начала заболевания, отмечены существенные преимущества в улучшении контроля над симптомами астмы, по сравнению с начавшими такую терапию по прошествии 5 лет и более[23].
Комбинации ИГКС и пролонгированных β2-адреномиметиков
Существуют фиксированные комбинации ИГКС и пролонгированных β2-адреномиметиков, сочетающие в себе средство базисной терапии и симптоматическое средство. Согласно глобальной стратегии GINA, фиксированные комбинации являются наиболее эффективными средствами базисной терапии бронхиальной астмы, так как позволяют снимать приступ и одновременно являются лечебным средством[5]. В России наибольшей популярностью пользуются две такие фиксированные комбинации:
- сальметерол + флутиказон (Серетид — 25/50, 25/125 и 25/250 мкг/доза, Серетид Мультидиск — 50/100, 50/250 и 50/500 мкг/доза, Тевакомб — 25/50, 25/125 и 25/250 мкг/доза);
- формотерол + будесонид (Симбикорт Турбухалер — 4,5/80 и 4,5/160 мкг/доза, Форадил Комби — 12/200 и 12/400 мкг/доза).
В состав препарата Серетид входит салметерол в дозе 25 мкг/доза в дозированном аэрозольном ингаляторе и 50 мкг/доза в аппарате «Мультидиск». Симбикорт содержит формотерол, максимально-допустимая суточная доза которого составляет 24 мкг, делает возможным ингалироваться Симбикортом до 8 раз в сутки. В исследовании «SMART» выявлен риск, связанный с применением салметерола и формотерола по сравнению с плацебо[31]. Формотерол начинает действовать через 5 минут, сальметерол через 20 минут после ингаляции[32].
Серетид существует как в виде аэрозоли, так и в виде мультидиска. Преимуществом аэрозоли является более мелкий размер частиц лекарственного вещества, что обеспечивает более глубокое попадание в мелкие бронхи. Размер частичек дозированного аэрозоля 2 мкм, а турбухалера или дискхалера чуть менее или равно 5 мкм[33].
В сравнении турбухалера и дискхалера небольшим преимуществом обладает дискахалер, так как обладает меньшим сопротивлением вдыхаемого воздуха[34].
Β-агонисты длительного действия могут ухудшать контроль над астмой посредством механизма отрицательной обратной связи β-адренергической системы, который является адаптивным ответом на стимуляцию рецепторов. Стимуляция приводит к расцеплению и интернализации рецепторов, которая известна как десенсибилизация , сопровождаемая снижением плотности рецепторов и экспрессии генов рецепторов, которая известна как подавление. Было показано, что регулярное использование β-агонистов увеличивает гиперреактивность бронхов, несмотря на поддержание некоторой степени бронходилатации. Эти эффекты, наряду с уменьшением реакции на последующее спасательное применение β-агонистов, могут ухудшить контроль над астмой, не предупреждая об усилении симптомов. В связи с этим в последнее десятилетие активно обсуждается вопрос о замене адреномиметиков препаратами антихолинергического действия и использования их в комбинации с ИГКС [35].
Концепция гибкого дозирования препарата
Ступенчатый подход чётко определяет дозу базисной терапии при той или иной степени выраженности симптомокомплекса. Исследования в Европе и Америке показали, что уровень контроля над симптомами астмы даже в странах с развитой системой здравоохранения невысок.
Концепция гибкого дозирования проверялась в исследованиях с препаратом симбикорт (будесонид 80 или 160 мкг + формотерол 4,5 мкг). Безопасно ингалироваться симбикортом до 8 раз в сутки, поэтому если возникает необходимость увеличить дозу ИГКС, можно просто увеличить число ингаляций препарата. Ингаляция симбикорта или фостера обеспечивает незамедлительный бронхолитический эффект и увеличение дозы ИГКС. Пациент после обучения может сам регулировать свою дозу ИГКС, применяя симбикорт то чаще, то реже — от 1 до 8 раз в день. Таким образом концепция гибкого дозирования заключается в том, что пациент начинает лечение со средних доз и затем, исходя из собственного самочувствия, повышает или снижает дозу с помощью одного и того же ингалятора. В случае применения препарата «Фостер» тот же эффект может быть достигнут применением меньших доз ИГКС.
Авторы концепции гибкого дозирования выдвигают следующие тезисы:
- гибкое дозирование более удобно для больного;
- можно уменьшить общую дозу ИГКС, так как после улучшения состояния больной быстро уменьшает число ингаляций, а значит, можно снизить; риск НЛР при использовании ИГКС;
- снижается общая стоимость лечения;
- снижается количество обострений, поскольку временное увеличение дозы симбикорта позволяет предотвратить их развитие.
Проведённые рандомизированные клинические исследования, посвящённые гибкому дозированию симбикорта, свидетельствуют, что применение гибкого дозирования позволяет быстрее достичь контроля над симптомами астмы по сравнению с фиксированными дозами препаратов, существенно снизить частоту обострений астмы, уменьшить материальные затраты на лечение. Так же теоретически для гибкого дозирования могут быть использованы и другие препараты, но в настоящее время не имеется данных независимых многоцентровых рандомизированых исследований, об эффективности их применения[36]. Сравнительные комбинированные исследования показывают одинаковую эффективность препаратов «Фостер» и «Симбикорт Турбухалер»[37].
На первый взгляд данная концепция представляется золотым решением для пациентов с бронхиальной асмой, Тем не менее, обзоры вышеупомянутых исследований показали, что несмотря на снижение частоты обострений, у многих пациентов не достигался ежедневный контроль БА согласно критериям GINA[38][39][40]. В одном из исследований было обнаружено нарастание содержания эозинофилов в подслизистом слое бронхов через 1 год терапии будесонидом/формотеролом в режиме единого ингалятора[41].
Существует определённый риск того, что больные БА, которым назначен ИГКС/формотерол в режиме единого ингалятора начнут применять препарат только по потребности, упуская обязательные ингаляции 2 раза в сутки. С другой стороны, вопреки назначениям врача больные могут продолжать использовать β2-агонисты короткого действия (КДБА)[40].
В 2016 году были опубликованы результаты более крупного исследования, в которое были включены данные о 14 818 больных БА, получивших рецепт на будесонид/формотерол. Исследование проводилось с 2009 по 2013 годы. Авторы провели анализ терапии, получаемой пациентами в реальной практике в течение 1 года после даты назначения будесонида/формотерола. Из общего числа пациентов только 173 (1,2 %) препарат был назначен в режиме единого ингалятора.
Из 173 пациентов, получавших терапию в режиме единого ингалятора, 53 % дополнительно назначались КДБА в течение 1 года после выдачи первого рецепта. В группе стабильного дозирования КДБА получали 82 % пациентов. Эти данные указывают на то, что большинство пациентов, которым назначили терапию в режиме SMART не контролировали свою астму по критериям GINA[38][42].
Глюкокортикостероиды для системного применения
Глюкокортикостероиды для системного применения или системные глюкокортикостероиды (СГКС) могут применяться внутривенно небольшими дозами при обострениях астмы, перорально короткими курсами или длительно. Значительно реже используется внутривенное введение больших доз СГКС (пульс-терапия).
СГКС могут применяться длительно при неэффективности ингаляционных глюкокортикостероидов. При этом бронхиальная астма характеризуется как стероидозависимая и присваивается тяжёлое течение заболевания.
Побочные действия СГКС включают остеопороз, артериальную гипертензию, сахарный диабет, подавление функциональной активности гипоталамо-гипофизарно-надпочечниковой системы, катаракту, глаукому, ожирение, истончение кожи с образованием стрий и повышенной капиллярной проницаемостью, мышечную слабость. С момента назначения СГКС следует начать терапию по предупреждению остеопороза. Для перорального применения используются преднизон, преднизолон, метилпреднизолон (Метипред), гидрокортизон. Эти препараты обладают меньшими, чем другие ГКС, минералокортикоидной активностью, нерезко выраженным действием на поперечнополосатую мускулатуру и относительно коротким периодом полувыведения. Длительный приём препарата триамцинолон (Полькортолон) чреват побочными эффектами, такими как развитие мышечной дистрофии, похудение, слабости, поражения желудочно-кишечного тракта. Дексаметазон не применяется длительно перорально при бронхиальной астме из-за выраженного подавления функции коры надпочечников, способности задерживать жидкости и низкого сродства к лёгочным рецепторам ГКС.
Важным является установление причин, приведших к необходимости данного вида лечения. Вот перечень наиболее важных из них:
- ятрогенные
- неназначение ИГКС,
- недооценка степени тяжести на предшествующих этапах,
- попытка контроля воспаления в период обострения низкими дозами ГКС, что приводит к назначению системных ГКС на длительный срок,
- применение неселективных и слабоселективных β-блокаторов (пропранолол, атенолол),
- неправильный подбор системы доставки для ИГКС,
- некорректный диагноз бронхиальной астмы, где респираторные симптомы являются следствием другой патологии (системные васкулиты, системная склеродермия, дерматомиозит, бронхолёгочный аспергиллёз, гастроэзофагеальная рефлюксная болезнь, истерия и т. д.);
- низкий комплайнс;
- продолжающаяся экспозиция аллергенов.
В 5 % случаев встречается стероидорезистентность (резистентность стероидных рецепторов к стероидным препаратам). Выделяют два типа пациентов:
- тип II — больные с истинной стероидной резистентностью, не имеющие побочных эффектов при длительном приёме высоких доз системных глюкокортикоидов;
- тип I — пациенты с приобретённой резистентностью, имеющие побочные эффекты от приёма системных стероидов; в этом случае резистентность скорее всего можно преодолеть повышением дозы ГКС и назначением препаратов, имеющих аддитивный эффект.
При снижении дозы СГКС врач должен правильно оценить клиническую картину заболевания, предположить возможные причины стероидозависимости и назначить максимальные дозы высокоэффективных ИГКС. Обязателен контроль функций дыхания, ежедневная пикфлоуметрия и учёт приёма β2-агонистов по потребности. Следует снижать СГКС постепенно на фоне приёма максимальных доз ИГКС, например уменьшая дозу не ранее чем каждые 3—4 нед, во избежание развития осложнений. Целесообразно при каждом уменьшении дозы проводить анализ крови (нарастание СОЭ и эозинофилии может свидетельствовать о проявлении системного заболевания, в том числе васкулита), исследовать базальный уровень кортизола, так как после прекращения длительной терапии подавляющими дозами СГКС возможно развитие надпочечниковой недостаточности. Снижать дозы ИГКС допускается только после полной отмены СГКС[23]. Для минимизации срока применения системных и наружных глюкокортикостероидов в терапию включают потенцирующие действие стероидных препаратов лекарства (например, аммония глицирризинат[43]).
Антилейкотриеновые препараты
В настоящее время известны следующие антагонисты лейкотриенов:
- зафирлукаст (Аколат)
- монтелукаст (Сингуляр)
- пранлукаст
- Реглисам (аммония глицирризинат)
Препараты этой группы быстро устраняют базальный тонус дыхательных путей, создаваемый лейкотриенами вследствие хронической активации 5-липоксигеназной ферментной системы. Благодаря этому широкое применение эта группа препаратов получила при аспириновой бронхиальной астме, в патогенезе которой имеет место усиленная активация 5-липоксигеназной системы и повышенная чувствительность рецепторов к лейкотриенам. Антагонисты лейкотриенов особенно эффективны при этой форме астмы, терапия которой нередко вызывает трудности.
Зафирлукаст способствует достоверному улучшению по сравнению с плацебо показателей ОФВ1, ПСВ и устранению симптомов при добавлении к ИГКС[44].
Применение монтелукаста в сочетании с ИГКС и пролонгированными β2-агонистами, особенно при наличии аллергического ринита, позволяет быстрее улучшить контроль над заболеванием, снизить дозу ИГКС[19].
Недавно проведённое в Великобритании исследование показало, что антагонисты рецепторов к лейкотриенам также эффективны, как и ингаляторы, содержащие глюкортикостероиды. Антилейкотриеновые препараты, такие как Монтелукаст (Сингуляр) и Зафирлукаст (Аколат), подвергнулись рандомизированному контролируемому исследованию в группе из 650 больных бронхиальной астмой в течение 24 месяцев. Результаты исследования опубликованы в New England Journal of Medicine. Авторы исследования полагают, что применение антилейкотриеновых препаратов возможно у 4-х из 5 больных бронхиальной астмой, в особенности у тех пациентов, которые не хотят применять ГКС-ингаляторы из-за их побочных эффектов или из-за стероидофобии. [45]
Моноклональные антитела
Разрабатываются способы лечения астмы с помощью моноклональных антител, воздействующих на сигнальный путь воспаления II типа. Эффективным способом воздействия считаются специфическое блокирование провоспалительных цитокинов интерлейкина 5 (меполизумаб, реслизумаб, бенрализумаб), интерлейкина 13 (тралокинумаб, лебрикизумаб), а также одновременное блокирование интерлейкина 4 и интерлейкина 13 путём селективного воздействия на субъединицу α рецептора интерлейкина 4 (IL-4Rα) дупилумабом[46]. Анрукинзумаб блокирует взаимодействие интерлейкина 13 с рецептором IL13Ra1.
Омализумаб — моноклональное антитело к IgE, связывающее свободный IgE в крови, тем самым препятствуя дегрануляции и выходу БАВ, которые запускают ранние аллергические реакции. Это средство может применяться у лиц старше 12 лет со средней и тяжёлой формами персистирующей бронхиальной астмы, с аллергической астмой, триггерами которой являются круглогодичные аллергены, подтверждённой кожными тестами или исследованием специфического IgE[5].
β2-адреномиметики длительного действия
Без сочетания с гормональными лекарственными средствами (в монотерапии) все адреномиметики длительного действия экспертами FDA предложено исключить из протокола лечения астмы в связи с побочными действиями![47].
К β2-адреномиметикам длительного действия в настоящее время относят:
- формотерол (Оксис, Форадил)
- салметерол (Серевент)
- индакатерол
По данным исследования «SMART», определяется небольшое, но статистически значимое увеличение смертельных случаев в группе формотерола и салметерола при лечении ХОБЛ[48], связанных с респираторными осложнениями (24 по сравнению с 11 в группе плацебо; относительный риск [RR]=2,16; 95 % доверительный интервал [CI] составил 1,06—4,41), случаев смерти, обусловленных астмой (13 по сравнению с 3 в группе плацебо; RR=4,37; 95 % CI составил 1,25—15,34), а также комбинированных случаев смерти, связанных с астмой (37 по сравнению с 22 в группе плацебо; RR=1,71; 95 % CI составил 1,01—2,89)[49]. При этом ряд исследований, в которых участвовал формотерол, демонстрировали безопасность формотерола в суточной дозе до 24 мкг как в отношении респираторных, так и сердечно-сосудистых осложнений[50]. В исследовании FACET, где использовался Оксис, выяснилось, что добавление формотерола снижает частоту лёгких и тяжёлых приступов бронхиальной астмы как к низком дозам будесонида (на 26 % для тяжёлых приступов и на 40 % для лёгких приступов), так и к высоким (высокие дозы будесонида без формотерола снижали частоту тяжёлых приступов на 49 % и лёгких на 39 %, с формотеролом — соответственно на 63 и 62 %)[51].
β2-адреномиметики короткого действия

Ассортимент β2-адреномиметиков короткого действия представлен следующими препаратами:
- фенотерол (беротек),
- сальбутамол (вентолин, Саламол Стери-Неб),
- тербуталин (бриканил).
Являются наиболее эффективными из существующих бронхолитиков, и поэтому им принадлежит первое место среди препаратов купирования острых симптомов астмы в любом возрасте. Предпочтителен ингаляционный путь введения, так как он обеспечивает более быстрый эффект при более низкой дозе и меньших побочных эффектах. Ингаляция β2-агониста обеспечивает выраженную защиту от бронхоспазма на фоне физической нагрузки и других провоцирующих факторов, в течение 0,5-2 ч[5].
Ксантины
К ксантинам относят эуфиллин, используемый для экстренного купирования приступа и теофиллин с длительным действием, принимаемый перорально. Эти препараты использовались до β2-адреномиметиков и в некоторых ситуациях используются в настоящее время. Показана эффективность теофиллина в качестве монотерапии и терапии, назначаемой в дополнение к ИГКС или даже СГКС у детей в возрасте старше 5 лет. Он эффективнее плацебо, устраняет дневные и ночные симптомы и улучшает функцию лёгких, а поддерживающая терапия им обеспечивает защитный эффект при нагрузке. Добавление теофиллина у детей с тяжёлой астмой, позволяет улучшить контроль и снизить дозу ГКС. Предпочтение отдаётся препаратам замедленного высвобождения с изученным всасыванием и полной биодоступностью вне зависимости от приёма пищи (Теопек, Теотард). В настоящее время терапия производными ксантинов имеет вспомогательное значение, как метод купирования приступов при малой эффективности, или отсутствии других групп препаратов[5].
Препараты других групп
Отхаркивающие препараты улучшают отделение мокроты. Они, особенно при применении их через небулайзер, снижают вязкость мокроты, способствуют разрыхлению слизистых пробок и замедлению их образования. Для усиления эффекта при вязкой мокроте рекомендуется приём жидкости в объёме 3—4 л жидкости в сутки. Имеет эффект после приёма отхаркивающих препаратов через небулайзер проведение постурального дренажа, перкуссионного и вибрационного массажа грудной клетки. В качестве основных отхаркивающих препаратов используют препараты йода, гвайфенезин, N-ацетилцистеин, амброксол.
Антибиотики используют при осложнении астмы бактериальными инфекциями, чаще всего это синуситы, бронхит и пневмония. У детей до 5 лет астма чаще осложняется вирусной инфекцией, в этих случаях антибиотики не назначают. В возрасте от 5 до 30 лет может быть микоплазменная пневмония, при этом назначают тетрациклин или эритромицин. Наиболее распространённый возбудитель пневмонии у лиц старше 30 лет — Streptococcus pneumoniae, против которого эффективны пенициллины и цефалоспорины. При подозрении на пневмонию обязательно проводят микроскопию мазка мокроты, окрашенного по Граму, и её посев[21].
Аллергенспецифическая иммунотерапия (АСИТ)
Один из традиционных способов лечения бронхиальной астмы, влияющий на её иммунологическую природу. АСИТ обладает таким терапевтическим действием, которое распространяется на все этапы аллергического процесса и отсутствует у известных фармакологических препаратов. Действие АСИТ охватывает собственно иммунологическую фазу и приводит к переключению иммунного ответа с Th2-типа на Th1-тип, тормозит как раннюю, так и позднюю фазы IgE-опосредованной аллергической реакции, угнетает клеточную картину аллергического воспаления и неспецифическую тканевую гиперреактивность. Проводится пациентам от 5 до 50 лет при экзогенной бронхиальной астме. Через определённые промежутки времени вводят подкожно аллерген, постепенно увеличивая дозу. Продолжительность курса — не менее 3 месяцев. Наиболее эффективна АСИТ с аллергенами домашних клещей, тогда как АСИТ с аллергенами домашней пыли малоэффективна. Допускается одновременное использование не более 3 видов аллергенов, вводимых с интервалом не менее 30 минут.
Кроме аллергенов для лечения бронхиальной астмы также используются введения гистаглобулина. В течение последнего десятилетия вводятся в практику назальный и сублингвальный способы введения аллергенов. К настоящему времени в России зарегистрировано несколько видов оральных аллергенов для проведения АСИТ (пыльца деревьев, грибы, клещи)[52][53].
Использование небулайзеров
При бронхиальной астме важным моментом в осуществлении успешной терапии является доставка лекарственного препарата к очагу воспаления в бронхах, чтобы добиться этого результата нужно получить аэрозоль заданной дисперсности. Для этого применяются специальные аппараты, называемые небулайзерами, по сути представляющие собой ингалятор, производящий аэрозоль с частицами заданного размера. Общий принцип работы аппарата состоит в создании мелкодисперсного аэрозоля введённого в него вещества, который за счёт малых размеров частиц проникнет глубоко в мелкие бронхи, которые преимущественно и страдают от обструкции.
В России наиболее распространены два типа небулайзеров — ультразвуковые и компрессорные. Каждый из них имеет как свои достоинства, так и недостатки.
Ультразвуковые, более компактные и малошумные, пригодны для ношения с собой, с их помощью можно вводить масляные растворы. Компрессорные за счёт воздушного насоса относительно велики, они требуют стационарного питания от сети переменного тока, за счёт работы того же компрессора довольно шумные, но они обладают немаловажным достоинством, с их помощью можно вводить суспензии, и они примерно на 40—50 % дешевле аналогичных ультразвуковых моделей[54].
Устранение факторов риска
Элиминация (устранение) факторов риска позволяет значительно улучшить течение заболевания. У пациентов с аллергической астмой в первую очередь имеет значение устранение аллергена. Имеются данные, что в городских районах у детей с атопической бронхиальной астмой индивидуальные комплексные мероприятия по удалению аллергенов в домах привели к снижению болезненности бронхиальной астмой. Элиминация аллергенов и поллютантов (токсических веществ) на долговременной основе, является необходимым условием сохранения и укрепления здоровья людей, профилактики и лечения астмы. Основными антропоидными загрязнениями воздуха в городах, отягчающими течение болезни, являются взвешенная пыль, оксиды азота NO, NO2, оксиды серы SO2, озон O3, атомарный кислород О, фенол, формальдегид, бензопирен, угарный газ CO.
Лечение астмы путём элиминации аллергенов и поллютантов осуществляется с помощью бесшумных фильтрующих очистителей воздуха с недорогими HEPA и угольными фильтрами (с периодической раз в месяц их заменой). Удаление токсичных газов с низкой молекулярной массой (NO2, SO2, O3, фенол, формальдегид) происходит в этих очистителях за счёт взаимодействия потока воздуха с водой. Исключаются аллергические кризы, снижается частота приступов астматического удушья на 60 %-90 %.
Домашние клещи живут и размножаются в различных частях дома, поэтому полное их уничтожение невозможно. В одном из исследований показано, что использование чехлов для матрацев позволило несколько уменьшить бронхиальную гиперреактивность у детей. Использование чехлов, удаление пыли и уничтожение очагов обитания клещей показало уменьшение частоты симптомов в популяциях детей в детских домах.
Домашние животные. При наличии повышенной реактивности к шерсти животных следует удалить животных из дома, однако полностью избежать контакта с аллергенами животных невозможно. Аллергены проникают во многие места, в том числе в школы, транспорт и здания, в которых никогда не содержали животных.
Курение. Пассивное курение увеличивает частоту и тяжесть симптомов у детей, поэтому необходимо полностью исключить курение в комнатах, где бывают дети. Помимо увеличения выраженности симптомов астмы и ухудшения функции лёгких в отдалённом периоде, активное курение сопровождается снижением эффективности ИГКС, поэтому всем курящим пациентам следует настоятельно советовать бросить курить.
Грипп и другие инфекции. Необходимо проводить по возможности ежегодную вакцинацию против гриппа. Инактивированные гриппозные вакцины редко осложняются побочными эффектами и обычно безопасны у лиц с астмой старше 3 лет, даже при трудно поддающейся лечению астме. Больным следует обезопасить себя и от других инфекций (риниты, синуситы), особенно в холодное время года.
Лекарственные препараты. Больным с аспириновой астмой следует остерегаться приёма аспирина и НПВП. Также нежелателен приём β-блокаторов, особенно неселективных[5].
Оконные фильтры. В настоящее время появились конструкции для установки в оконные рамы, которые фильтруют входящий с улицы в помещение воздух, при этом само окно остаётся закрытым. Такие конструкции бывают оснащены простым фильтром очистки воздуха от пыли и, в дополнение, угольным фильтром, впитывающим вредные эмиссии. Рекомендуется периодически заменять фильтры, в зависимости от места расположения жилья.
Немедикаментозное
Занятия лечебной физической культурой снижают тонус гладкой мускулатуры и отёчность слизистой бронхов[55].
Лечебный массаж стимулирует рефлекс, способствующий расширению бронхов. Проводится в период стихания воспалительного процесса[56].
Дыхательные упражнения, такие как метод Papworth и Метод Бутейко. Метод Papworth, разработанный в одноименной клинике в Англии предполагает использование определённых характера дыхания, исключающего гипо- и гипервентиляцию и как следствие повышение уровня CO2. Это направлено на уменьшение влияния гипокапнии и других симптомов, свойственных обострению астмы. Дыхательная гимнастика Бутейко схожа с предыдущим методом. Метод включает применение дыхательных упражнений, направленных на уменьшение альвеолярной гипервентиляции и/или дозированную физическую нагрузку. Во время дыхательных упражнений пациенту предлагают с помощью различных дыхательных техник постепенно уменьшить глубину вдоха до нормы[57][58]. Клинические исследования показывают, что дыхательные упражнения при астме в целом безопасны. Отдельные исследования показывают положительные эффекты у больных астмой, однако недостатки методов этих исследований не позволяют сделать вывод об их эффективности при лечении астмы[58].
Спелеотерапия (греч. speleon «пещера») — метод лечения длительным пребыванием в условиях своеобразного микроклимата естественных карстовых пещер, гротов, соляных копей, искусственно пройденных горных выработок металлических, соляных и калийных рудников. Применяется при бронхиальной астме вне фазы резкого обострения и в случае недостаточности внешнего дыхания не выше I и II степени[59]. Однако имеющиеся экспериментальные работы, в силу своих недостатков, не дают возможности сделать вывод об эффективности спелеотерапии и её длительных эффектах у больных астмой[60]
Галотерапия — метод основанный на пребывании в искусственно созданном микроклимате соляных пещер, где основным действующим фактором является высокодисперсный сухой солевой аэрозоль (галоаэрозоль). Аэрозоли солей тормозят размножение микрофлоры дыхательных путей, предотвращая развитие воспалительного процесса. У пациентов с бронхиальной астмой галотерапия способствует удлинению периода ремиссии и переходу пациента на более низкую степень тяжести, что влечёт за собой и возможность перехода к меньшим дозам и более щадящим средствам базисной медикаментозной терапии [61].
Прогноз
Характер и отдалённый прогноз заболевания определяются возрастом, когда возникло заболевание. У подавляющего большинства детей с аллергической астмой болезнь протекает относительно легко, однако возможно возникновение тяжёлых форм бронхиальной астмы, выраженных астматических статусов и даже летальные исходы, особенно при недостаточной дозе базисной терапии. Отдалённый прогноз бронхиальной астмы, начавшейся в детском возрасте, благоприятен. Обычно к пубертатному периоду дети «вырастают» из астмы, однако, у них сохраняется ряд нарушений лёгочной функции, бронхиальная гиперреактивность, отклонения в иммунном статусе. Описаны случаи неблагоприятного течения бронхиальной астмы, начавшейся в подростковом возрасте.
Если заболевание началось в зрелом и пожилом возрасте, то характер развития и прогноз его более предсказуем. Тяжесть течения заболевания определяется, в первую очередь, его формой. Аллергическая астма протекает легче и прогностически более благоприятна. «Пыльцевая» астма как правило протекает легче, чем «пылевая». У заболевших в пожилом возрасте отмечается первично тяжёлое течение, особенно у больных с аспириновой бронхиальной астмой.
В целом заболевание является хроническим и медленно прогрессирующим, адекватное лечение может полностью устранять симптомы, но не влияет на причину их возникновения. Прогноз для жизни и трудоспособности при адекватной терапии условно благоприятный. Периоды ремиссии могут продолжаться в течение нескольких лет[62].
Для того чтобы оценить, достигнут ли контроль над астмой, можно использовать Тест по контролю над астмой (ACT). В России этот тест одобрен Российским респираторным обществом, Союзом педиатров России, Российской ассоциацией аллергологов и клинических иммунологов. Тест разработан для регулярной оценки состояния, чтобы проверить, есть ли необходимость обратиться за консультацией к специалисту и изменить терапию. Существует как взрослый (с 12 лет), так и детский вариант Теста (с 4 до 11 лет). Представляет собой несколько вопросов в зависимости от ответа на которые начисляются баллы, их сумма указывает на уровень контроля заболевания[63].
Альтернативная медицина и новые исследования
Гигиеническая гипотеза
Данная гипотеза была сформулирована в 1989 году Strachan D.P. (Hay fever, hygiene, and household size). Согласно гигиенической гипотезе, уменьшение контакта с бактериальными антигенами уменьшает возможность переключения сформировавшегося в антенатальном и неонатальном периоде Th2-клеточного иммунного ответа с преобладанием его над Th1-клеточным ответом в направлении сбалансированного соотношения Th1- и Th2-ответов, что способствует персистированию аллергического ответа. В менее развитых странах меньше астмы, чем в западном мире, потому что там ниже уровень гигиены и больше случаев инфекции. В западном мире, наоборот, всеобщая озабоченность чистотой ведёт к уменьшению подверженности детей микробам, и их иммунной системе не приходится справляться с потенциальными инфекциями[64][65].
Генетическая гипотеза
В одном из исследований была показана ассоциация более ста генов с предрасположенностью к развитию астмы[66]. В конце 2005 было показано, что 25 генов ассоциируются с астмой в шести и более популяциях[66]. К ним относятся, например, гены интерлейкинов 4, 10, 13; фактора некроза опухолей и другие. Многие из них кодируют белки иммунной системы или модулируют воспаление. Однако даже для этих генов результаты исследований не имеют достаточной воспроизводимости среди всех исследованных популяций. Это указывает на то, что данные гены не ассоциированы с развитием астмы при всех условиях. Есть гипотеза, что астма — несколько различных заболеваний, и разные гены играют роль в разных типах. Например, было показано, что одно из генетических различий (однонуклеотидный полиморфизм 17q21) ассоциировано с развитием астмы в детстве[67].
Лечение с помощью антиконвульсантов
Показано, что противоэпилептические средства, такие как карбамазепин и вальпроаты при длительном применении могут предотвращать приступы астмы [68][69]. В связи с этим грузинской исследовательской группой под руководством Мераба Ломиа выдвигается теория о схожести патогенеза астмы и пароксизмальных расстройств (эпилепсия, невралгия тройничного нерва и мигрень)[70] и предлагается использовать эти препараты для поддерживающего лечения астмы.
Примечания
- база данных Disease ontology (англ.) — 2016.
- Адрианова Н. В., Злыдников Д. М., Зонис Я. М., Иванов С. М., Кодолова И. М., Коркушко О. В., Петров В. И., Трещинский А. И., Тюрин Н. А., Шейна А. Н. Бронхиальная астма // Большая медицинская энциклопедия : в 30 т. / гл. ред. Б. В. Петровский. — 3-е изд. — М. : Советская энциклопедия, 1976. — Т. 3 : Беклемишев — Валидол. — С. 414—428. — 584 с. : ил.
- Астма. . Всемирная организация здравоохранения. Дата обращения: 20 мая 2020.
- Shah R., Saltoun C. A. Chapter 14: Acute severe asthma (status asthmaticus). (англ.) // Allergy and asthma proceedings : the official journal of regional and state allergy societies. — 2012. — Vol. 33 Suppl 1. — P. 47—50. — doi:10.2500/aap.2012.33.3547. — PMID 22794687.
- Глобальная стратегия лечения и профилактики бронхиальной астмы = Global Initiative for Asthma. — 2006. — 106 с. Архивированная копия (недоступная ссылка). Дата обращения: 25 ноября 2008. Архивировано 21 сентября 2014 года.
- Hippocrates. Aphorisms III.26 (недоступная ссылка). Дата обращения: 5 ноября 2010. Архивировано 24 августа 2014 года.
- Hippocrates. De Morbo Sacro 9 (недоступная ссылка)
- De Medicina, Liber IV, 8
- De causis et signis diuturnorum morborum, I.XI (недоступная ссылка). Дата обращения: 5 ноября 2010. Архивировано 25 апреля 2014 года.
- Jackson, Mark. Asthma: the biography (англ.). — Oxford University Press, 2009. — ISBN 9780199237951.
- Doig R.L. Epinephrin; especially in asthma (англ.) // Western Journal of Medicine. — 1905. — February (vol. 3, no. 2). — P. 54—5. — PMID 18733372.
- чл.-кор. РАМН Г.Б,Федосеев. Классификация бронхиальной астмы. Вклад академика А.Д.Адо и профессора П.К.Булатова в формирования представления о бронхиальной астме.. Санкт-Петербургский государственный медицинский университет им. акад. И. П. Павлова. Дата обращения: 17 марта 2013. Архивировано 21 марта 2013 года.
- Crompton G. A brief history of inhaled asthma therapy over the last fifty years. (англ.) // Primary care respiratory journal : journal of the General Practice Airways Group. — 2006. — Vol. 15, no. 6. — P. 326—331. — doi:10.1016/j.pcrj.2006.09.002. — PMID 17092772.
- von Mutius E., Drazen J. M. A patient with asthma seeks medical advice in 1828, 1928, and 2012. (англ.) // The New England journal of medicine. — 2012. — Vol. 366, no. 9. — P. 827—834. — doi:10.1056/NEJMra1102783. — PMID 22375974.
- Овчаренко С. И. Бронхиальная астма: диагностика и лечение. — РМЖ, 2002. — Т. 10, № 17. Архивировано 9 ноября 2008 года.
- Чучалин А. Г. Бронхиальная астма. — 1985.
- M. Masoli, D. Fabian, S. Holt, R. Beasley. Global Burden of Asthma. — 2003. — 20 с. Архивированная копия (недоступная ссылка). Дата обращения: 26 ноября 2008. Архивировано 31 января 2009 года.
- Б. А. Черняк, И. И. Воржева. Агонисты beta2-адренергических рецепторов в терапии бронхиальной астмы: вопросы эффективности и безопасности // Consilium Medicum. — 2006. — Т. 8, № 10. Архивировано 7 марта 2022 года.
- Бронхиальная астма – проблемы и достижения. По материалам 15-го ежегодного конгресса европейского респираторного общества // «Клиническая иммунология. Аллергология. Инфектология». Издательский дом «Здоров’я України». — 2005. — № 1. Архивировано 7 марта 2022 года.
- Детское ожирение и бронхиальная астма. www.buildbody.org.ua. Дата обращения: 14 августа 2016.
- Г. Лолор-младший, Д. Тэшкин. Клиническая иммунология и аллергология. Глава 7. Бронхиальная астма.. Официальный сайт иммунологической службы Тверской области. Дата обращения: 24 ноября 2008.
- В. Е. Ноников. Антибактериальная терапия при инфекционно-зависимой бронхиальной астме // Consilium Medicum. — 2002. — Т. 4, № 9. Архивировано 7 марта 2022 года.
- Н. П. Княжеская, М. О. Потапова. Глюкокортикостероидная терапия бронхиальной астмы // Consilium-Medicum. — 2003. — Т. 5, № 4. Архивировано 7 марта 2022 года.
- Т. В. Барановская. Лечение обострений бронхиальной астмы. Дата обращения: 27 ноября 2008. Архивировано 18 августа 2011 года.
- Sontag S.J. Gastroesophageal reflux disease and asthma. J. Clin. Gastroenterol. 2000 Apr; 30 (3 Suppl): p. 9-30. (англ.)
- Бейтуганова И. М., Чучалин А. Г. Рефлюкс-индуцированная бронхиальная астма // РМЖ. — 1998. — Т. 6, № 17.
- Г. Б. Федосеев. Классификация бронхиальной астмы. Вклад академика А. Д. Адо и профессора П. К. Булатова в формирование представления о бронхиальной астме. Дата обращения: 4 декабря 2008. Архивировано 18 августа 2011 года.
- Ю. И. Фещенко. Основные принципы современного лечения бронхиальной астмы.
- ИГКС — ингаляционные глюкокортикостероиды.
- С. Ю. Терещенко, Н. А. Смирнов, С. В. Бычковская, С. Н. Буйнова, Т. Г. Голосова, И. В. Петрова. Эффективность различных режимов поддерживающей противовоспалительной терапии при лёгком/среднетяжёлом течении бронхиальной астмы у детей. Результаты проспективного многоцентрового рандомизированного исследования кадет (контролируемая астма у детей) // Аллергология. — 2006. — № 2.
- Beta-agonist Inhalers More than Double Death Risk in COPD (англ.) (10 July 2006). Дата обращения 18 февраля 2018.
- https://www.thoracic.org/patients/patient-resources/resources/copd-medicines.pdf.
- АЭРОЗОЛЬНЫЕ УСТРОЙСТВА И ЛЕЧЕНИЕ АСТМЫ. www.provisor.com.ua. Дата обращения: 18 февраля 2018.
- Современный уровень технического устройства ингаляторов сухого порошка (DPI) (недоступная ссылка). silver-pharm.ru. Дата обращения: 18 февраля 2018. Архивировано 19 февраля 2018 года.
- Shelley R. Salpeter, Nicholas S. Buckley, Thomas M. Ormiston, Edwin E. Salpeter. Meta-Analysis: Effect of Long-Acting β-Agonists on Severe Asthma Exacerbations and Asthma-Related Deaths (англ.) // Annals of Internal Medicine. — 2006-06-20. — Vol. 144, iss. 12. — P. 904. — ISSN 0003-4819. — doi:10.7326/0003-4819-144-12-200606200-00126.
- А. Н. Цой, В. В. Архипов. Бронхиальная астма. Комбинированная терапия бронхиальной астмы: перспективы гибкого дозирования препарата // Consilium-Medicum. — 2004. — Т. 6, № 10. Архивировано 7 марта 2022 года.
- Оценка эффетивности и безопасности применения в клинической практике препарата Фостер у больных бронхиальной астмой (Реферат).. (недоступная ссылка). Consilium Medicum, том 12, № 11, стр. 67-71, ISSN 2075-1753. Архивировано 20 октября 2014 года.
- Global Initiative for Asthma (англ.), Global Initiative for Asthma - GINA. Дата обращения 20 мая 2018.
- Chapman, K. R., Barnes, N. C., Greening, A. P., Jones, P. W. & Pedersen. Single maintenance and reliever therapy (SMART) of asthma: a critical appraisal (англ.) // Thorax. — 2010. — No. 65. — P. 747—752.
- Czarnecka, K. & Chapman, K. R. The clinical impact of single inhaler therapy in asthma // Clin. Exp. Allergy. — 2012. — № 42. — С. 1006—1013.
- Pavord I. D. Airway inflammation in patients with asthma with high-fixed or low-fixed plus as-needed budesonide/formoterol//J // All Clin Imunnol. — 2009. — № 123(5). — С. 1083—1089.
- DiSantostefano R.L. The frequency of, and adherence to, single maintenance and reliever therapy instructions in asthma: a descriptive analysis (англ.) // NPJ Prim Care Respir Med. — 2016. — 21 июль.
- Моренко М. А. Обоснование целесообразности использования препаратов глицирризиновой кислоты в комплексной терапии бронхиальной астмы у детей // Медицина и экология. — 2010. — № 2. — С. 97—100.
- Княжеская Н. П. Аспириновая бронхиальная астма и антагонисты лейкотриенов // РМЖ. — 2000. — Т. 8, № 12. Архивировано 10 октября 2008 года.
- Asthma Pill As Effective As Inhalers And Easier To Use
- Gandhi N. A.; Bennett B. L.; Graham N. M. H.; Pirozzi G.; Stahl N.; Yancopoulos G. D. Targeting key proximal drivers of type 2 inflammation in disease (англ.) // Nat. Rev. Drug Discov.. — 2016. — Vol. 15, no. 1. — P. 35—50. — doi:10.1038/nrd4624.
- Harris, Gardiner. F.D.A. Panel Votes to Ban Asthma Drugs (англ.), The New York Times (11 December 2008). Дата обращения 20 февраля 2018.
- Beta-agonist Inhalers More than Double Death Risk in COPD (англ.) (10 July 2006). Дата обращения 20 февраля 2018.
- Harold S. Nelson, MD; Scott T. Weiss, MD, MS; Eugene R. Bleecker, MD; Steven W. Yancey, MS; Paul M. Dorinsky, MD; the SMART Study Group. The Salmeterol Multicenter Asthma Research Trial // Chest. — 2006. Архивировано 7 марта 2022 года.
- Н. П. Княжеская, М. О. Потапова. Пролонгированный бета2-агонист формотерол (Форадил) в терапии бронхиальной астмы и хронической обструктивной болезни лёгких // Medlinks.ru.
- Pauwels R. A., Löfdahl C. G., Postma D. S., et al. Formoterol and Corticosteroids Establishing Therapy (FACET) International Study Group. Effect of inhaled formoterol and budesonide on exacerbations of asthma // N Engl J Med. — 1997; 337:1405—11.
- Аллерген-специфическая иммунотерапия. Medlinks.ru. Дата обращения: 3 декабря 2008.
- М. М. Маркатун. Аллерген-специфическая иммунотерапия при аллергии и бронхиальной астме (недоступная ссылка). Аллерголог.ру — Аллергия и Астма. Дата обращения: 3 декабря 2008. Архивировано 25 августа 2011 года.
- Небулайзерная терапия (недоступная ссылка). Дата обращения: 3 декабря 2008. Архивировано 17 ноября 2009 года.
- Лечебная физическая культура / Под ред. С.Н. Попова. — Учебник для студ. учреждений высш. образования. — М.: Издательский центр «Академия», 2014. — С. 100. — 416 с.
- Бирюков А.А. Лечебный массаж. — Учебник для студ. учреждений высш. образования. — М.: Издательский центр «Академия», 2015. — С. 298. — 368 с.
- А. Е. Новожилов. Описание метода Бутейко (недоступная ссылка). Клиника Бутейко. Дата обращения: 4 декабря 2008. Архивировано 16 августа 2011 года.
- Freitas, D. A., Holloway, E. A., Bruno, S. S., Chaves, G. S., Fregonezi, G. A., & Mendonça, K. M. (2013). Breathing exercises for adults with asthma. The Cochrane Library.
- Улащик В.С. Спелеотерапия // Физиотерапия. Универсальная медицинская энциклопедия. — Мн.: Книжный дом, 2008. — С. 456—457. — 640 с.
- ЮBeamon, S. P., Falkenbach, A., Fainburg, G., & Linde, K. (2001). Speleotherapy for asthma. The Cochrane Library.
- Улащик В.С. Галотерапия // Физиотерапия. Универсальная медицинская энциклопедия. — Мн.: Книжный дом, 2008. — С. 148—150. — 640 с.
- Г. Б. Федосеев, М. А. Петрова. Бронхиальная астма. Современные представления. Мир Медицины. Дата обращения: 3 декабря 2008.
- Тест по контролю над астмой.
- Астма. Лечение астмы (недоступная ссылка). Киевский городской аллергоцентр. Архивировано 2 августа 2008 года.
- Инфекционные заболевания, перенесённые в раннем детском возрасте, не предотвращают развитие аллергии (недоступная ссылка). Antibiotic.ru. Дата обращения: 4 декабря 2008. Архивировано 27 ноября 2011 года.
- Ober C.,Hoffjan S. Asthma genetics 2006: the long and winding road to gene discovery (англ.) // Genes Immun : journal. — 2006. — Vol. 7, no. 2. — P. 95—100. — doi:10.1038/sj.gene.6364284. — PMID 16395390.
- Bouzigon E., Corda E., Aschard H., et al. Effect of 17q21 Variants and Smoking Exposure in Early-Onset Asthma (англ.) // The New England Journal of Medicine : journal. — 2008. — October. — doi:10.1056/NEJMoa0806604. — PMID 18923164.
- Bronchial asthma as neurogenic paroxysmal inflammatory disease: A randomized trial with carbamazepine Respiratory Medicine Volume 100, Issue 11 , Pages 1988—1996, November 2006
- Bronchial asthma as neurogenic paroxysmal inflammatory disease: Do some antiepileptic drugs have antiasthmatic properties? Medical Hypotheses Volume 69, Issue 4 , Pages 858—859, 2007
- Бронхиальная астма как нейрогенное воспалительное пароксизмальное заболевание: теория и практика
Литература
- Исаев Ю., Мойсюк Л. Бронхиальная астма: Конвенциональные и неконвенциональные методы лечения. — М.: КУДИЦ-ПРЕСС, 2008. — 168 с. — ISBN 978-5-91136-044-3.
- Глобальная стратегия лечения и профилактики бронхиальной астмы / под ред. А. Г. Чучалина. — М.: Атмосфера, 2007. — 104 с.
- Солопов В. Н. Астма. Истинная причина болезни. — М.: Европолиграфик, 2006. — 160 с. — ISBN 5-902728-03-7.
- Фадеев П. А. Бронхиальная астма. — М.: Оникс, Мир и Образование, 2010. — 160 с. — (Как победить болезнь). — ISBN 978-5-488-02586-8, ISBN 978-5-94666-591-9.
- Чучалин А. Г. Бронхиальная астма. — М.: Медицина, 1985. — 160 с. — (Б-ка практ. врача). — 100 000 экз.
- Чучалин А. Г. Бронхиальная астма. — М.: Рус. врач, 2001. — 144 с. — (Практическому врачу). — ISBN 5-7724-0035-5.
Ссылки
- Бронхиальная астма как нейрогенное воспалительное пароксизмальное заболевание. (недоступная ссылка). — Патогенетические нейрогенные механизмы и лечение. Дата обращения: 16 июня 2007. Архивировано 28 сентября 2007 года.
- Вакцинопрофилактика аллергии
- Перевод руководства GINA для пациентов