Аспириновая бронхиальная астма
Аспириновая бронхиальная астма — вариант эндогенной или смешанной бронхиальной астмы, при которой одним из факторов, способствующих сужению бронхов, являются нестероидные противовоспалительные препараты (НПВП), в том числе и ацетилсалициловая кислота. Складывается из триады симптомов (триада Фернанда Видаля): полипозный риносинусит, приступы удушья и непереносимость НПВП[1].
| Аспириновая бронхиальная астма | |
|---|---|
| МКБ-11 | CA23.20 |
| МКБ-10 | J45.1, J45.8 |
| МКБ-9 | 493.1 |
| OMIM | 208550 |
| MeSH | D055963 |
История вопроса
В 1903 году, через 4 года после внедрения аспирина, Franke (Германия) наблюдал у себя реакцию в виде ларингоспазма и шока на приём аспирина. В 1905 году Barnett сообщил о 2 случаях удушья на аспирин. В 1919 году Francis выявил зависимость между полипозным ринитом и гиперчувствительностью к аспирину, а в 1922 году Widal впервые установил зависимость всех симптомов триады. В 1968 году Samter и Beers описали симптомокомплекс и назвали «аспириновой триадой».
Параллельно с этим развивалось представление и о патогенезе заболевания. В 1938 году была открыта медленнореагирующая субстанция анафилаксии (МРС-А), когда Felberg и Kellaway вводили яд кобры в лёгкие морских свинок и показали, что при этом наблюдается бронхоспазм, не связанный гистамином, с более медленным развитием и более длительный. В 1960-х годах Brockehurst et al. заявили об исключительной важности МРС-А как медиатора аллергических реакций. Исследование химической структуры МРС-А показало, что её компоненты являются лейкотриенами[1].
Эпидемиология
Хотя убедительных данных о наследственной предрасположенности аспириновой астмы нет, имеются отдельные данные о нескольких семьях с повторяющимися случаями аспириновой астмы. Возникает в возрасте 30—50 лет, чаще у женщин[2]. Составляет 9—22 %, а по последним данным — до 40 %, всех случаев бронхиальной астмы[1]. Складываясь из триады симптомов, аспириновая астма может порой не проявляться одним из своих симптомов, и тогда говорят о неразвёрнутой астматической триаде[3].
Этиология
Основные провоцирующие факторы — аспирин и НПВП. Переносимость различных препаратов во многом зависит от антициклооксигеназной активности препарата. К препаратам с высокой активностью относятся салицилаты (ацетилсалициловая кислота — аспирин, салициловая кислота), полициклические кислоты (индометацин, толметин), ненасыщенные жирные кислоты (диклофенак, ибупрофен, кетопрофен, тиапрофеновая кислота), эноловые кислоты (пироксикам). Степень реакции также зависит от дозы препарата и пути введения — при ингаляционном, внутривенном или внутримышечном введении интенсивность реакции обычно максимальная[1].
Приступы удушья могут быть связаны с употреблением в пищу фруктов и овощей, содержащих природные салицилаты, а также консервированных с помощью ацетилсалициловой кислоты продуктов. У некоторых тем не менее эти реакции маскируются противоастматическими и противоаллергическими препаратами[3].
Имеются исследования роли наследственности: Lockey et al. в 1973 году наблюдал 2 семьи, в одной из которых заболеваемость аспириновой астмой напоминало аутосомно-рецессивный тип наследования, а Von Maur et al. в 1974 году описал семейный случай с предположительно аутосомно-доминантным типом наследования. Miller в 1971 году описал случай у сестёр. Jinnai et al. в 2004 году исследовал генотипы 198 больных аспириновой астмы и 274 лиц контрольной группы и обнаружил корреляцию заболевания с однонуклеотидной заменой гуанина на аденин в 5'-конце промотора гена рецептора простагландина E (PTGER2, 14q22), в зоне, ответственной за связыванием с белком STAT1, активирующим транскрипцию. Akahoshi et al. в 2005 году обнаружил связь аспириновой астмы и однонуклеотидной замены гена маркера Th1-хелперов (TBX21, 17q21.3). Эта же мутация коррелирует и с полипозом носа[4].
Патогенез
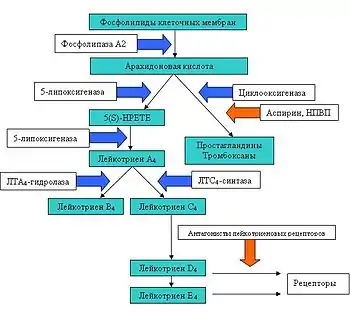
Среди медиаторов воспаления, вызывающих сокращение гладких мышц бронхов, наиболее важное значение при аспириновой астме имеют цистеиновые лейкотриены. Эти вещества вызывают также отёк и гиперреактивность бронхов, гиперсекрецию слизи.
Лейкотриены синтезируются из арахидоновой кислоты, которая высвобождается из мембран клеток воспаления при их активации. Она представляет собой полиненасыщенную жирную кислоту. Её метаболизм представляет собой каскад ферментативных реакций:
- Под действием циклооксигеназной системы из арахидоновой кислоты образуются простагландины и тромбоксаны, а с помощью системы ферментов 5-липоксигеназы она окисляется до лейкотриенов. Для работы 5-липоксигеназы требуется 5-липоксигеназ-активирующий белок, связанный с мембраной. 5-липоксигеназа после окисления одной молекулы арахидоновой кислоты в лейкотриены разрушается и инактивируется.
- Образующийся сразу после окисления лейкотриен А4 (ЛТА4) — нестабильный эпоксид, под действием фермента ЛТА4-гидролазы присоединяет воду и превращается в лейкотриен В4 (ЛТВ4), а при помощи фермента ЛТА4-синтазы соединяется с глутатионом, вследствие чего образуется цистеиновый лейкотриен С4 (ЛТС4).
- ЛТС4 в свою очередь с помощью γ-глютамилтрансферазы превращается в ЛТD4
- Далее под действием дипептидаз ЛТD4 переходит в ЛТЕ4, который подвергается дальнейшему метаболизму.
Эозинофилы, базофилы, тучные клетки и альвеолярные макрофаги синтезируют преимущественно ЛТС4, тогда как нейтрофилы — преимущественно ЛТВ4. У человека небольшая, но постоянная часть ЛТЕ4 экскретируется в неизменённом виде с мочой.
ЛТВ4 предположительно участвуют в привлечении и активации клеток воспаления, в первую очередь нейтрофилов и эозинофилов. ЛТВ4 играет важную роль в развитии гнойного воспаления, ревматоидного артрита и других воспалительных заболеваний. Однако в исследованиях показано, что при астме назначение антагонистов рецепторов к ЛТВ4 не оказывают влияния на раннюю и отсроченную фазы реакции на воздействие антигена. При аспириновой бронхиальной астме повышено содержание ЛТЕ4 в моче приблизительно в 3—6 раз и ЛТС4 в назальном секрете по сравнению с другими формами бронхиальной астмы, что вызывается провокацией аспирином.[1]
Лейкотриены связываются с рецепторами плазматических мембранах клеток. Выделяют три основных типа рецепторов лейкотриенов:[5]
- Рецептор LT1 к лейкотриенам ЛТC/D/E4. Расположен на гладкой мускулатуре бронхов и опосредует бронхоспазм
- Рецептор LT2 к ЛТC/D/E4. Играет роль в изменении сосудистой проницаемости, опосредует отёк
- Рецептор к ЛТB4. Опосредует хемотаксический эффект лейкотриенов
В дыхательных путях обнаруживают персистирующее воспаление, характерны эозинофилия, нарушение целостности бронхиального эпителия, усиленная продукция цитокинов и молекул адгезии. Также в дыхательных путях повышается экспрессия интерлейкина-5 (IL-5). Он стимулирует хемотаксис эозинофилов и увеличивает их продолжительность жизни. Активация цистеинилового лейкотриенового каскада возможно связана с полиморфизмом гена LTC4-синтазы, обнаруживаемого примерно у 70 % пациентов[6]. Cowburn et al. в 1998 году, исследуя бронхиальные биоптаты больных аспириновой и «неаспириновой» астмой и здоровых людей, обнаружил, что количество клеток, продуцирующих ЛТС4-синтазу у больных аспириновой астмой в 5 раз больше чем у больных «неаспириновой астмой» и в 18 раз больше чем у здоровых людей.[4]
Фермент циклооксигеназа представлена двумя формами: ЦОГ-1 и ЦОГ-2. Неселективные НПВП способствуют тому, что из арахидоновой кислоты образуются лейкотриены, вызывающие дальнейшие реакции. Теоретически при использовании селективных ингибиторов ЦОГ-2 (мелоксикам, нимесулид, целекоксиб) часть арахидоновой кислоты расходуется в реакции с ЦОГ-1, однако эти НПВП могут также вызывать реакции у 6—30 % пациентов с непереносимостью НПВП.[3]
Тромбоцитарная теория. Обнаружено также, что тромбоциты больных аспириновой астмой активируются in vitro под действием НПВП, что ведёт к освобождению цитотоксических и провоспалительных медиаторов из тромбоцитов, и это нехарактерно для тромбоцитов здоровых лиц. Блокада циклооксигеназы под действием НПВП приводит к угнетению продукции простагландина Н2. Авторы этой теории связывают его снижение с активацией тромбоцитов у больных асприновой астмы[1].
Клиническая картина
Одним из наиболее ранних проявлений аспириновой астмы является нарушение функции эндокринной и иммунной систем. У женщин могут быть различные нарушения менструального цикла, невынашивание беременности, раннее наступление менопаузы. У каждого шестого больного выявляется патология щитовидной железы[7].
Для аспириновой астмы характерно тяжёлое упорное течение заболевания.
Наиболее часто аспириновая астма начинается с длительного ринита, в 20—25 % случаях переходящего в полипозную риносинусопатию. Её проявления: ринорея, заложенность носа, отсутствие восприятия запахов, боли в проекции придаточных пазух носа, головные боли. Около половины больных полипозным риносинуситом со временем начинают реагировать удушьем на приём НПВП. Часто приступы удушья начинают беспокоить после хирургических вмешательств (полипэктомия, радикальные операции на придаточных пазухах носа). Назальные симптомы обычно протекают тяжело и плохо поддаются терапии.
Непереносимость аспирина проявляется в виде покраснения лица, удушья, кашля, ринита, конъюнктивита, уртикарных высыпаний, отёка Квинке, подъёма температуры, диареи, боли в животе, сопровождающейся тошнотой и рвотой. Наиболее тяжёлыми проявлениями является астматический статус, остановка дыхания, потеря сознания и шок.
В 1919 году Francis отметил, что фенацетин не вызывает побочных реакций у лиц с непереносимостью аспирина. Он сходен по механизму действия с парацетамолом, но в настоящее время его применение ограничено из-за побочных явлений. Парацетамол хорошо переносится и не вызывает бронхоспазма. Назначая парацетамол больным аспириновой астмой, следует назначать не более 500 мг и наблюдать за больным в течение 2—3 часов, так как у 5 % больных могут возникать приступы удушья и на парацетамол.[1]
Диагностика
Так же как и при других формах бронхиальной астмы, проводят сбор жалоб и анамнеза, физикальное исследование, оценку функции внешнего дыхания с измерением объёма форсированного выдоха за 1 секунду (ОФВ1), жизненной ёмкости лёгких (ЖЁЛ), пиковой скорости выдоха (ПСВ).
Обычно при сборе анамнеза ответом на вопрос о переносимости аспирина или НПВС пациенты указывают предшествовавшие реакции. Отсутствие подобных указаний связано с относительно низкой степенью гиперчувствительности к этим препаратам, одновременным приёмом медикаментов, устраняющих вызванных НПВП бронхоспазм (к ним относятся антигистаминные препараты, симпатомиметики, препараты теофиллина), а также с замедленной реакцией на НПВП или их редким приёмом. При уточнении эффекта теофедрина, больные отмечают его неэффективность, а иногда — двухстадийное действие: вначале наступает некоторое уменьшение одышки, а затем одышка вновь нарастает, что связано с присутствием в теофедрине амидопирина[1]. Следует также уточнять, имел ли место приём комбинированных препаратов, содержащих НПВП: андипал, баралгин, спзаган и др. содержат анальгин, индовазин — индометацин, цитрамон и др. — ацетилсалициловую кислоту и т. д.
Существует также провокационная аспириновая проба, однако она не рекомендована к широкому применению вследствие высокого риска опасных для жизни последствий. Проба может проводиться только в учреждениях, оснащённых набором для проведения сердечно-лёгочной реанимации и у пациентов ОФВ1 которых составляет не менее 70 % от должных (или индивидуальных лучших) величин[6].
Лечение
Профилактические мероприятия
Категорически исключается аспирин, нестероидные противовоспалительные препараты вне зависимости от их селективности, гидрокортизона гемисукцинат[6]. Следует также принимать парацетамол с осторожностью[1].
Из пищевого рациона исключаются следующие продукты:[3]
- Консервы, продукты длительного хранения
- Гастрономические изделия: колбасы, колбасные изделия, ветчина, буженина и т. д.
- Содержащие природные салицилаты фрукты (яблоки, абрикосы, апельсины, грейпфрут, лимоны, виноград, персики, дыни, сливы, ежевика, малина, клубника, вишня, чёрная смородина, чернослив, изюм), орехи (миндаль), овощи (артишок, помидоры, огурцы, перец)
- Пиво
- Тартразин — кислый жёлтый краситель Е102 — подобен по своей химической структуре аспирину; нередко используется в фармацевтической промышленности. Не следует принимать препараты (таблетки, драже) жёлтого цвета или покрытые оболочкой жёлтого цвета. Тартразин часто входит в состав теста кексов, тортов, пирожных, крема жёлтого цвета, фруктовых напитков, конфет, мармелада и драже.
- Не рекомендуется употребление продуктов, содержащих пищевые красители (тартразин Е102, желто-оранжевый S Е110, азорубин Е122, амарант Е123, красная кошениль Е124, эритрозин Е127, бриллиантовая чернь BN E151) ароматизаторы (глутаматы В 550—553), консерванты (сульфиты и их производные Е220-227, нитриты Е249-252, производные бензойной кислоты Е210-219), антиоксиданты (Е321).
Медикаментозное лечение
Для лечения аспириновой астмы, как и при других формах бронхиальной астмы, используются бронходилататоры и препараты базисной терапии, причём ингаляционные глюкокортикостероиды занимают лидирующее место в терапии. Для лечения ринита используются назальные глюкокортикостероиды: альдецин (в основе — беклометазон), фликсоназе (флутиказон), назонекс (мометазон). Ввиду преимущества тяжёлого течения, чаще, чем при других формах бронхиальной астмы возникает необходимость в использовании системных глюкокортикостероидов.
Преимущественно при аспириновой астме используются антагонисты лейкотриеновых рецепторов. К ним относят зафирлукаст (Аколат, субстанция 1С1204219) пранлукаст (субстанция ONO-1078), побилукаст (субстанция SKF 104353), монтелукаст (Сингуляр, субстанция МЛ-0476). Они имеют срдоство к рецепторам ЛТD4 и ЛТE4, тем самым блокируют эти рецепты от активации лейкотриенами[5]. Результаты исследований указывают, что эти препараты быстро устраняют бронхиальную обструкцию, создаваемую лейкотриенами вследствие активации 5-липоксигеназной ферментной системы.
Зафирлукаст при назначении внутрь приводит к значительному увеличению ОФВ1 даже у пациентов, резистентных к ИГКС. Исследования показали, что подключение зафирлукаста к терапии аспириновой астмы способствует улучшению показателей функции лёгких, уменьшению ночных приступов удушья в сравнении с плацебо. Этот препарат эффективен как в монотерапии, так и в сочетании с другими базисными препаратами. Проводились также исследования у пациентов, получающих пероральные ГКС. Таким образом зафирлукаст способствует эффективному контролю над симптомами астмы и оказывает аддитивный клинический эффект, что позволяет уменьшить дозу ИГКС[1].
Knorr BA et al, в исследованиях 1998, 2000 годов показали хорошую переносимость препарата Монтелукаст у детей от 2 до 5 лет, а также значимые различия по сравнению с плацебо по таким конечным точкам, как количество дней с симптомами, потребность в β2-агонистах, эозинофилия крови, а также динамика ОФВ1[8].
Десенситизация аспирином
Возникают случаи, когда нельзя отказаться от аспирина и НПВП по жизненным показаниям (ИБС, ревматические болезни), и тогда проводят десенситизацию аспирином. Это метод воздействия на патогенетический механизм заболевания, основанный на феномене развития невосприимчивости больного к повторным дозам НПВП в период 24—72 часов после приступа удушья, вызванного первой дозой. Stevenson показал, что метод улучшает контроль симптомов риносинусита и бронхиальной астмы. Десенситизацию проводят больным при необходимости назначения НПВП при других состояниях (ИБС, ревматические болезни). Схему терапии подбирают индивидуально. Начинают с 5—10 мг аспирина, достигают дозы 650 мг и выше, затем в течение длительного времени вводят поддерживающие дозы аспирина, составляющие 325—650 мг в сутки. Проводят в стадию ремиссии бронхиальной астмы, противопоказаниями для проведения также являются кровоточивость, язвенная болезнь, тяжёлые заболевания печени и почек, беременность[1].
Хирургическое лечение
В качестве хирургического метода используется эндоскопическая полипэктомия — удаление полипов из носовой полости. Цели и задачи операции: восстановление свободного носового дыхания, удаление полипозной ткани, максимальное сохранение здоровой слизистой оболочки. Чаще выполняется коагулирующей петлёй, перерезанием ножки полипа. Метод травматичный, так как при случайном прикосновении повреждается и здоровая ткань. Более щадящий и эффективный метод оперативного лечения — эндоскопическая эндоназальная операция с использованием полой присасывающей трубки, внутри которой вращается лезвие. Исследуется также методика лазерной деструкции полипов[9].
McMains, K. Christopher; Kountakis, Stilianos E., использовавшие в своих исследованиях эндоскопический метод удаления полипов показали, что полипэктомия идёт на пользу больным, однако пациенты, получавшие десенситизацию аспирином, не нуждаются в оперативном вмешательстве по крайней мере в течение двух лет[10]
Прогноз
Прогноз при аспириновой астме такой же, как при других формах эндогенной бронхиальной астмы. Отказ от аспирина не приводит к выздоровлению, но снижает частоту приступов удушья[11].
Примечания
- Княжеская Н. П. Аспириновая бронхиальная астма и антагонисты лейкотриенов // РМЖ. — 2000. — Т. 8, № 12. Архивировано 10 октября 2008 года.
- Аспириновая астма — причины, признаки, лечение и профилактика. Легочные заболевания (21 января 2019). Дата обращения: 25 января 2019.
- Лечение аспириновой бронхиальной астмы в ЦВЛ "Беловодье". Дата обращения: 1 января 2008.
- Asthma, nasal polyps, and aspirin intolerance (англ.). OMIM. Дата обращения: 29 ноября 2008.
- Голубев Л. А., Бабак С. Л., Григорьянц Г. А. Антагонисты леикотриеновых рецепторов в лечении бронхиальной астмы // Южно-Российский медицинский журнал. — 2001. — № 1—2.
- Глобальная стратегия лечения и профилактики бронхиальной астмы = Global Initiative for Asthma. — 2006. — 106 с. Архивированная копия (англ.) (недоступная ссылка). Дата обращения: 18 декабря 2008. Архивировано 21 сентября 2014 года.
- Аспириновая бронхиальная астма. Medy.ru. Дата обращения: 25 июля 2021.
- Montelukast use in children aged 2 to 5 (англ.) (недоступная ссылка). UK Medicines Information Pharmacists Group. Архивировано 12 ноября 2008 года.
- Овчинников А. Ю., Колбанова И. Г., Овчаренко С. И. Современный взгляд на лечение больных полипозным риносинуситом в сочетании с бронхиальной астмой // Доктор.ру. — 2006. — № 2 (27). — С. 34—39. — ISSN 1727-2378.
- McMains, K. Christopher; Kountakis, Stilianos E. Medical and surgical considerations in patients with Samter's triad // OceanSide Publications, Inc. — American Journal of Rhinology, 2006. — Т. 20, № 6. — С. 573—576. (недоступная ссылка)
- Аспириновая бронхиальная астма: патогенез, диагностика, лечение. «Биология и медицина». Дата обращения: 18 мая 2019.