Сероуглерод
Сероуглерод CS2 — соединение серы с углеродом.
| Сероуглерод | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
сульфид углерода(IV) | ||
| Традиционные названия | Сероуглерод | ||
| Хим. формула | CS2 | ||
| Физические свойства | |||
| Состояние | бесцветная жидкость | ||
| Молярная масса | 76.1 г/моль | ||
| Плотность | 1.26 г/см³ | ||
| Энергия ионизации | 10,08 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −111.6 °C | ||
| • кипения | 46 °C | ||
| • разложения | 300 °C | ||
| • вспышки | −22 ± 1 ℉[1] | ||
| • самовоспламенения | 90 °C | ||
| Пределы взрываемости | 1,3 ± 0,1 об.%[1] | ||
| Энтальпия | |||
| • образования | 89,41 (ж) кДж/моль | ||
| Давление пара | 297 ± 1 мм рт.ст.[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | (при 20 °C) 0.29 г/100 мл | ||
| Оптические свойства | |||
| Показатель преломления | 1.6295 | ||
| Структура | |||
| Кристаллическая структура | линейная | ||
| Дипольный момент | 0 Д | ||
| Классификация | |||
| Рег. номер CAS | 75-15-0 | ||
| PubChem | 6348 | ||
| Рег. номер EINECS | 200-843-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | FF6650000 | ||
| ChEBI | 23012 | ||
| Номер ООН | 1131 | ||
| ChemSpider | 6108 | ||
| Безопасность | |||
| ЛД50 | 3188 мг/кг | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Свойства
Чистый сероуглерод представляет собой бесцветную жидкость с приятным «эфирным» запахом. Технический продукт, полученный сульфидированием угля, имеет неприятный «редечный» запах. Молекула CS2 линейна, длина связи С—S = 0,15529 нм; энергия диссоциации 1149 кДж/моль.
Сероуглерод токсичен, огнеопасен, имеет самый широкий диапазон концентрационных пределов взрываемости[2].
Подобно диоксиду углерода, CS2 является кислотным ангидридом и при взаимодействии с некоторыми сульфидами может образовывать соли тиоугольной кислоты (Н2СS3). При реакции с щелочами образуются соли дитиоугольной кислоты и продукты их диспропорционирования.
Однако сероуглерод, в отличие от диоксида углерода, проявляет большую реакционную способность по отношению к нуклеофилам и легче восстанавливается.
Так, сероуглерод способен реагировать с C-нуклеофилами, его взаимодействие с фенолятами активированных метиларилкетонов идет с образованием бис-тиолятов арилвинилкетонов, которые могут быть проалкилированы до бис-алкилтиоарилвинилкетонов; эта реакция имеет препаративное значение[3]:
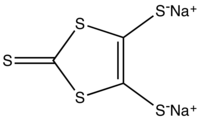
При взаимодействии с натрием в диметилформамиде сероуглерод образует 1,3-дитиол-2-тион-4,5-дитиолят натрия, использующийся в качестве предшественника в синтезе тетратиафульваленов[4]:
При взаимодействии с первичными или вторичными аминами в щелочной среде образуются соли дитиокарбаматы:
Для растворимых дитиокарбаматов характерно образование комплексов с металлами, что используется в аналитической химии. Они также имеют большое промышленное значение в качестве катализаторов вулканизации каучука.
Со спиртовыми растворами щелочей образует ксантогенаты:
Такими сильными окислителями, как, например, перманганат калия, сероуглерод разлагается с выделением серы.
С оксидом серы (VI) сероуглерод взаимодействует с образованием сульфоксида углерода:
С оксидом хлора(I) образует фосген:
Сероуглерод хлорируется в присутствии катализаторов до перхлорметилмеркаптана CCl3SCl[5], использующегося в синтезе тиофосгена CSCl2:
Избытком хлора сероуглерод хлорируется до четырёххлористого углерода:
Фторирование сероуглерода фторидом серебра в ацетонитриле ведет к образованию трифторметилтиолята серебра, эта реакция имеет препаративное значение[6]
При температурах выше 150 °C протекает гидролиз сероуглерода по реакции:
Получение
В промышленности получают по реакции метана с парами серы в присутствии силикагеля при 500—700 °C в камере из хромоникелевой стали:
Также сероуглерод можно получить взаимодействием древесного угля и паров S при 750—1000 °C.
Применение
Хорошо растворяет жиры, масла, смолы, каучук, используют как экстрагент; растворяет серу, фосфор, иод, нитрат серебра.
Большая часть (80 %) производимого сероуглерода идёт в производство вискозы — сырья в производстве вискозного волокна («искусственного шелка»). Его применяют для получения различных химических веществ (ксантогенатов, четырёххлористого углерода, роданидов).
Токсическое действие

Сероуглерод ядовит. Полулетальная доза при поступлении внутрь составляет 3188 мг/кг. Высокотоксичная концентрация в воздухе — свыше 10 мг/л. Оказывает местное раздражающее, резорбтивное действия. Обладает психотропными, нейротоксическими свойствами, которые связаны с его наркотическим воздействием на центральную нервную систему.
При отравлении возникают головная боль, головокружение, судороги, потеря сознания. Бессознательное состояние может сменяться психическим и двигательным возбуждением. Могут наблюдаться рецидивы судорог с потерей сознания, угнетение дыхания. При приёме внутрь наступают тошнота, рвота, боли в животе. При контакте с кожей наблюдаются гиперемия и химические ожоги.
Первая помощь и лечение
Прежде всего необходимо удалить пострадавшего из поражённой зоны. При попадании сероуглерода внутрь необходимо выполнить промывание желудка с использованием зонда, форсированный диурез, ингаляцию кислорода. Обычно проводят симптоматическую терапию. При судорогах вводят 10 мг диазепама внутривенно.
Примечания
- http://www.cdc.gov/niosh/npg/npgd0104.html
- Кипер Руслан. [www.chemister.ru/Chemie/records.htm Рекорды веществ] (недоступная ссылка). Рекорды для неорганических веществ. www.chemister.ru (Дата последнего изменения 13.10.2010). Дата обращения: 17 октября 2010. Архивировано 11 января 2012 года.
- Kevin T. Potts et al. 2,2' : 6',2' -Terpyridine. Org. Synth. 1986, 64, 189 DOI: 10.15227/orgsyn.064.0189
- Thomas K. Hansen et al. 4,5-Dibenzoyl-1,3-dithiole-1-thione. Org. Synth. 1996, 73, 270 DOI: 10.15227/orgsyn.073.0270
- Губен И. Методы органической химии. Том 3 — М.: Химическая литература, 1935. — 676 c.
- Jiansheng Zhu et al. Preparation of N-Trifluoromethylthiosaccharin: A Shelf-Stable Electrophilic Reagent for Trifluoromethylthiolation. Org. Synth. 2017, 94, 217—233 DOI: 10.15227/orgsyn.094.0217
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2 (Даф-Мед). — 671 с. — ISBN 5-82270-035-5.