Фторид рения(VII)
Фторид рения(VII) — неорганическое соединение, соль металла рения и плавиковой кислоты с формулой ReF7, очень легкоплавкие жёлтые кристаллы, реагирует с водой, в расплавленном состоянии разъедает стекло.
| Фторид рения(VII) | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Фторид рения(VII) |
| Традиционные названия |
фтористый рений, гептафторид рения |
| Хим. формула | ReF7 |
| Физические свойства | |
| Состояние | жёлтые кристаллы |
| Молярная масса | 319,19 г/моль |
| Плотность | 3,65 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 48,3 °C |
| • кипения | 73,3; 73,7 °C |
| Мол. теплоёмк. | 132,4 Дж/(моль·К) |
| Энтальпия | |
| • образования | -1412 кДж/моль |
| Классификация | |
| Рег. номер CAS | 17029-21-9 |
| PubChem | 123369 |
| SMILES | |
| InChI | |
| ChemSpider | 26323924 и 26520563 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- При нагреве порошка рения и фтора при атмосферном давлении и температуре 600—700 °C образуется смесь гексафторида и гептафторида рения:
- При нагреве полученной смеси или порошка рения (400 °C) при высоком давлении в атмосфере фтора получается чистый ReF7[1]:
- .
Физические свойства
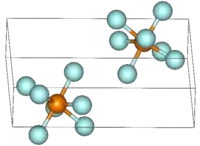
Фторид рения(VII) — образует жёлтые кристаллы кубической сингонии, параметры ячейки a = 0,626 нм. Спектроскопически установлено, что его молекула имеет форму пентагональной бипирамиды.
Химические свойства
- Реагирует с водой:
- Реагирует с разбавленными щелочами:
- Восстанавливается водородом:
- Реагирует с диоксидом кремния:
- С фторидами щелочных металлов образует фторокомплексы:
- С кислородом воздуха образует оксофториды рения(VII) различного состава (ReO3F, ReO2F3, ReOF5 и другие соединения нестехиометрического состава).
Примечания
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- Неорганическая химия / под ред. Ю.Д. Третьякова. — М.: Академия, 2007. — Т. 3. — 352 с.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. Additional terms may apply for the media files.