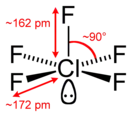
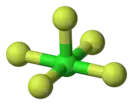
Фторид хлора(V)
Фтори́д хло́ра(V) (пентафтори́д хло́ра, пятифто́ристый хлор) — ClF5, соединение хлора с фтором, представляющее собой при комнатной температуре бесцветный ядовитый тяжёлый газ с сильным раздражающим запахом. Конденсируется при охлаждении до −13 °C (или при увеличении давления) в бесцветную жидкость. Впервые синтезирован в 1963 году.
| Фторид хлора(V) | |||
|---|---|---|---|
 | |||
| Общие | |||
| Систематическое наименование |
Пентафторид хлора | ||
| Хим. формула | ClF5 | ||
| Физические свойства | |||
| Состояние | бесцветный газ или жидкость | ||
| Молярная масса | 130,445 г/моль | ||
| Плотность | 4,5 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −103 °C | ||
| • кипения | −13,1 °C | ||
| Энтальпия | |||
| • образования | −238,49 кДж/моль | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | гидролиз | ||
| Классификация | |||
| Рег. номер CAS | 13637-63-3 | ||
| PubChem | 61654 | ||
| Рег. номер EINECS | 237-123-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | FO2975000 | ||
| ChemSpider | 55559 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Физические свойства
Температура плавления −103 °C, кипения −13,1 °C. В газовой фазе бесцветен, конденсируется в мутно-белую жидкость и в белые кристаллы. Давление паров в диапазоне от −80 до +25 °C зависит от абсолютной температуры как lg Pмм рт.ст. = 7,2683 − 1137,16/T. Плотность в жидкой фазе при −23 °C равна 1,922 г/см3, в диапазоне от −80 до −23 °C изменяется как 2,696 г/см3 − 3,08⋅10−3 T (K)[1].
Химические свойства
Сильный окислитель и очень сильный фторирующий агент. Реагирует с водой, взаимодействует со всеми элементами, кроме фтора, кислорода, азота и инертных газов[1].
- При нагревании разлагается в ClF3 и F2:
- Под действием ультрафиолетового излучения вступает во взаимодействие с PtF6, при этом образуется смесь ClF6PtF6 и ClF4PtF6[2]:
Получение
- Реакция трифторида хлора с газообразным фтором при высоких температуре и давлении:
- Синтез из элементов при 350 °C и давлении 250 атм (фотохимическая активация позволяет снизить давление синтеза до 1 атм).
- Фторирование соединений вида Me[ClF4] (Me = K, Rb, Cs).
- Электролиз раствора ClF3 в HF.
Применение
Применяется как фторирующий агент, но используется редко, так как не имеет преимуществ перед трифторидом хлора. В США было предложено использовать его как компонент ракетного топлива, высококипящий окислитель, однако по данным на 1981 года работы по этой теме находились на стадии стендовых и лабораторных испытаний[3].
Токсичность
Очень токсичен, ядовитый (удушающий) газ.
См. также
Примечания
- Pilipovich D., Maya W., Lawton E. A., Bauer H. F., Sheehan D. F., Ogimachi N. N., Wilson R. D., Gunderloy F. C., Bedwell V. E. Chlorine pentafluoride. Preparation and Properties (англ.) // Inorganic Chemistry : journal. — 1967. — Vol. 6, no. 10. — P. 1918—1919. — doi:10.1021/ic50056a036.
- FreePatentsOnline — Ionic Interhalogen Oxidizing Agent and Method
- Пентафторид хлора // Космонавтика. Энциклопедия / Гл. ред. В. П. Глушко. — Москва: Советская энциклопедия, 1985. — С. 290. — 528 с.
Литература
- Николаев Н. С., Суховерхов В. Ф., Шишков В. Д., Аленчикова И. Ф. Химия галоидных соединений фтора. М.: Наука, 1968.