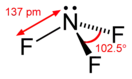Фторид азота(III)
Трифтори́д азо́та (фторид азота(III), трёхфтористый азот) — бинарное неорганическое соединение азота и фтора с формулой , бесцветный ядовитый тяжёлый газ, негорюч, вызывает коррозию металлов, имеет характерный затхлый запах плесени, плохо растворяется в воде.
| Фторид азота(III) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Фторид азота(III) | ||
| Традиционные названия | трифторид азота; трёхфтористый азот | ||
| Хим. формула | |||
| Рац. формула | |||
| Физические свойства | |||
| Состояние | бесцветный газ | ||
| Молярная масса | 71,0019 г/моль | ||
| Плотность | 3,003 кг/м³ (газ, 15 °C); 1,54−129 (жидкий при температуре кипения) | ||
| Энергия ионизации | 12,97 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −206,79 °C | ||
| • кипения | −129,01 °C | ||
| Критическая точка | |||
| • температура | −39,26 °C | ||
| • давление | 44,72 атм | ||
| Критическая плотность | 7,92 см³/моль | ||
| Энтальпия | |||
| • образования | -127 кДж/моль | ||
| Давление пара | 1 ± 1 атм[1] | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,021 г/100 мл | ||
| Классификация | |||
| Рег. номер CAS | [7783-54-2] | ||
| PubChem | 24553 | ||
| Рег. номер EINECS | 232-007-1 | ||
| SMILES | |||
| InChI | |||
| RTECS | QX1925000 | ||
| ChEBI | 30231 | ||
| Номер ООН | 2451 | ||
| ChemSpider | 22959 | ||
| Безопасность | |||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Вызывает сильный парниковый эффект.
Применяется в качестве травителя в микроэлектронике.
История
Трёхфтористый азот был впервые получен Отто Раффом, Фишером, Люфтом в 1903 году путём электролиза раствора фторида аммония во фтороводороде[2].
Физические свойства
Трифторид азота — бесцветный ядовитый тяжёлый газ, имеет характерный запах плесени, плохо растворяется в воде, не вступая с ней в реакцию. Связи в молекуле практически ковалентные и поэтому молекулы вещества имеет малый дипольный момент равный 0,234 Д, для сравнения, дипольный момент полярной молекулы аммиака 1,47 Д. Эта разница вызвана тем, что атомы фтора действуют как электроноакцепторные группы, притягивая на себя практически все электроны неподеленной пары электронов атома азота.
Химические свойства
При комнатной температуре более инертен, чем другие тригалогениды азота: трихлорид азота, трибромид азота и трииодид азота, все эти вещества взрывоопасны. Это единственный из тригалогенидов азота с отрицательной энтальпией образования из элементов.
Является сильным, но медленно действующим окислителем, способен реагировать со многими химическими элементами, оксидами, солями и элементоорганическими соединениями, а его смеси с газами-восстановителями при нагревании взрываются[3]. Окисляет хлороводород до элементарного хлора:
- .
При контакте с металлами и при высоких температурах превращается в тетрафторгидразин:
- .
При нагревании является сильным фторирующим агентом. При действии дифторида криптона или фтора и пентафторида сурьмы может быть окислен до соли тетрафтораммония :
- .
Получение
Трифторид азота - редкий пример бинарного фторида, который можно получить непосредственно из элементов только в специальных условиях, например с помощью электрического разряда в смеси газов[4].
Промышленный метод получения - паровая конверсия фторо-аммиачных газовых смесей.
Также получают с помощью модифицированного метода Раффа.
Поставляется в баллонах под давлением.
Мировой объём производства оценивается в 100 т на 1992 год и в 4000 т на 2007 год.
Применение
Трифторид азота используется при плазменном травлении кремниевых пластин. В этом процессе молекулы трифторида азота разрушаются в плазме тлеющего разряда и образующиеся молекулы фтора являются травящим агентом для кремния, диоксида кремния, нитрида кремния. Поэтому используется для изготовления ЖК мониторов, тонкоплёночных солнечных батарей и микросхем.
Экологические аспекты
Трифторид азота по своим свойствам является парниковым газом и может провоцировать глобальное потепление (по оценкам он в 17 200 раз активнее, чем углекислый газ той же массы при действии в течение 100 лет)[5][6], однако, в силу невысоких объемов выброса в настоящее время его вклад в парниковый эффект не превышает 0,04 % от вклада антропогенных выбросов углекислого газа[7]. Согласно исследованиям, количество NF3 в атмосфере равно 5400 т в 2008 г. и повышается на 11 % каждый год[8], причём его среднее время жизни в атмосфере составляет от 550 до 740 лет.
Литература
- Сарнер С. Химия ракетных топлив. — М.: Мир, 1969.
- Schmidt E. W., Harper J. T. Handling and Use of Fluoride and Fluorine-Oxygen Mixtures in Rocket Systems, Lewis Research Center, NASA SP-3037, Cleveland, Ohio, 1967.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
Примечания
- http://www.cdc.gov/niosh/npg/npgd0455.html
- Otto Ruff, Joseph Fischer, Fritz Luft (1928). “Das Stickstoff-3-fluorid”. Zeitschrift für Anorganische und Allgemeine Chemie. 172 (1): 417—425. DOI:10.1002/zaac.19281720132.
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1 (Абл-Дар). — 623 с.
- Lidin, P. A. Ошибка: не задан параметр
|заглавие=в шаблоне {{публикация}}. — 1995. — P. 442–455. — ISBN 978-1-56700-041-2. - Climate Change 2007: The Physical Sciences Basis, IPCC, <http://www.ipcc.ch/pdf/assessment-report/ar4/wg1/ar4-wg1-chapter2.pdf>. Проверено 3 июля 2008.
- Robson, J. I.; Gohar, L. K., Hurley, M. D., Shine, K .P. and Wallington, T. Revised IR spectrum, radiative efficiency and global warming potential of nitrogen trifluoride (en
) // Geophys. Res. Lett. : journal. — 2006. — Т. 33. — doi:10.1029/2006GL026210. - Potent Greenhouse Gas More Common in Atmosphere Than Estimated. NASA release 08-268
- Weiss, Ray F.; Jens Mühle, Peter K. Salameh, Christina M. Harth. Nitrogen trifluoride in the global atmosphere (англ.) // Geophysical Research Letters : journal. — 2008. — 31 October (vol. 35). — P. 3 PP.. — doi:10.1029/2008GL035913.