Фторид брома(III)
Фтори́д бро́ма(III) (трифтори́д бро́ма, трёхфто́ристый бром) BrF3 — соединение брома с фтором, представляющее собой при комнатной температуре подвижную бесцветную жидкость, иногда окрашенную желтовато-серым или соломенным цветом (за счёт разложения вещества с образованием бурого брома), дымящую на воздухе. Обладает сильным раздражающим запахом. В больших концентрациях ядовит.
| Фторид брома(III) | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Фторид брома (III) | ||
| Хим. формула | BrF3 | ||
| Рац. формула | BrF3 | ||
| Физические свойства | |||
| Молярная масса | 136,90 г/моль | ||
| Плотность | (тв.) 3,2 г/см3, (жидк.) 2,8 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 8,8 °C | ||
| • кипения | 125,8 °C | ||
| Классификация | |||
| Рег. номер CAS | 7787-71-5 | ||
| PubChem | 24594 | ||
| Рег. номер EINECS | 232-132-1 | ||
| SMILES | |||
| InChI | |||
| ChemSpider | 22996 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Строение
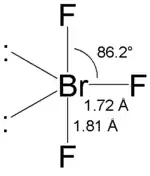
Гибридизация атома брома в молекуле sp³d, а строение молекулы полностью аналогичное строению молекулы трифторида хлора, то есть Т-образное, с одной длинной связью и двумя более короткими.
Для трифторида брома также изучена кристаллическая решётка. Кристаллическая ячейча — орторомбическая. Параметры ячейки:[1]
| Параметр | Значение |
|---|---|
| a | 534 пм |
| b | 735 пм |
| c | 661 пм |
Предположительно, в узлах кристаллической решётки находятся ионы [BrF2]+ и [BrF4]−.
Физико-химические свойства
Дипольный момент молекулы составляет 1.19 Дебая.
Термодинамические величины
| Свойство | Значение |
|---|---|
| Стандартная энтальпия образования (в жидкой фазе) | −300,8 кДж/моль |
| Стандартная энтальпия образования (в газовой фазе) | −255,6 кДж/моль |
| Энтропия образования (в жидкой фазе) | 178,2 Дж/(моль·К) |
| Энтропия образования (в газовой фазе) | 292,5 Дж/(моль·К) |
| Теплоёмкость (в жидкой фазе) | 124,6 Дж/(моль·К) |
| Теплоёмкость (в газовой фазе) | 66,6 Дж/(моль·К) |
| Энтальпия плавления | 12,03 кДж/моль |
| Энтальпия кипения | 42,68 кДж/моль[2] |
Растворимость
| Растворитель | Значение |
|---|---|
| Жидкий бром | Не смешивается |
| Вода | Реагирует |
| Серная кислота | Растворим |
| Фтороводород | Неограничено смешиваются (при температуре выше 292К). |
Хорошо растворяет фториды некоторых металлов, например NaF, KF, AgF, SnF2, BaF2, SbF2.
Химические свойства
- Воспламеняет многие органические соединения (в частности, бумагу и древесину).
- В жидком состоянии подвергается автоионизации по следующей схеме:
- Многие фториды металлов при растворении образуют двойные соединения, которые в большинстве своём устойчивы к нагреванию, и теряют BrF3 лишь при температурах выше 200 °C. Например при растворении в трифториде брома фторида калия выделяется следующее соединение:
Получение
- Трифторид брома можно получить из простых веществ при комнатной температуре (20 °C)
- Также, трифторид брома является продуктом диспропорционирования монофторида брома. При этом также образуется свободный бром:
Применение
BrF3 нашел достаточно большой спектр различных вариантов применения. Вот некоторые из них:
- Трифторид брома — очень хороший фторирующий агент. Он используется во всевозможных органических синтезах. Например, в реакции с сукциннитрилом (NCCH2CH2CN) образуется 1,1,1,4,4,4-гексафторбутан, который сложно получить, если использовать другие фторирующие агенты.[4]
- На основе системы литий/трифторид брома разрабатывается достаточно перспективный источник тока.[5]
- Также трифторид можно использовать для травления кристаллов кремния в газовой фазе, что может успешно применяться для производства различных полупроводниковых приборов.[6]
- Успешно применяется в ядерной промышленности для получения и разделения фторидов урана, а также является перспективным для переработки ядерного топлива:
- Применяется в нефтегазодобывающей промышленности — рабочее вещество в химических резаках для аварийной обрезки и извлечения буровой колонны из скважин.
- Для некоторых синтезов, трифторид брома выступает одновременно в роли растворителя, фторирующего агента и окислителя. Например, реакция с трихлоридами металлов, в которой образуются соли фторпроизводных кислот:
Опасности
Трифторид брома является достаточно опасным веществом. Среди опасностей связанных с применением этого вещества можно выделить следующие:[7]:
Примечания
- X-Ray investigation of the structure of liquid Bremine Trifluoride. V.N. Mitkin, G.S. Yurev, S.V. Zemskov, V.I. Kazakova. Journal of Structural Chemistry Volume 28, Number 1, 1987. (недоступная ссылка)
- Рабинович В. А., Хавин З. Я. «Краткий химический справочник» Л.: Химия, 1977
- Simons JH (1950). «Bromine (III) Fluoride — Bromine Trifluoride». Inorganic Synthesis 3: 184—186
- Max T. Baker, Jan A. Ruzicka, John H. Tinker. Journal of Fluorine Chemistry Volume 94, Issue 2, Pages 123—126 (недоступная ссылка)
- Патент США № 5188913
- Патент США № 6436229
- Данные о опасности соединения
См. также
Литература
- Джолли У. И. Синтезы неорганических соединений. М: Мир, 440 с. — 1967 г.
- Некрасов Б. В. Основы общей химии. В 2 томах. М: Химия, 1973 г.