Теплоёмкость
Теплоёмкость — количество теплоты, поглощаемой (выделяемой) телом в процессе нагревания (остывания) на 1 градус температуры (например, кельвин). Более точно, теплоёмкость — физическая величина, определяемая как отношение количества теплоты , поглощаемой/выделяемой термодинамической системой при бесконечно малом изменении её температуры , к величине этого изменения [1][2][3][4][5]:
| Теплоёмкость | |
|---|---|
| Размерность | L2MT −2Θ−1 |
| Единицы измерения | |
| СИ | Дж/К |
| СГС | эрг/К |
| Примечания | |
| Скалярная величина | |
Малое количество теплоты обозначается (а не ), чтобы подчеркнуть, что это не дифференциал параметра состояния (в отличие, например, от ), а функция процесса. Поэтому и теплоёмкость — это характеристика процесса перехода между двумя состояниями термодинамической системы[6], которая зависит и от пути процесса (например, от проведения его при постоянном объёме или постоянном давлении)[7][8], и от способа нагревания/охлаждения (квазистатического или нестатического)[7][9]. Неоднозначность в определении теплоёмкости[10] на практике устраняют тем, что выбирают и фиксируют путь квазистатического процесса (обычно оговаривается, что процесс происходит при постоянном давлении, равным атмосферному). При однозначном выборе процесса теплоёмкость становится параметром состояния[11][12] и теплофизическим свойством вещества, образующего термодинамическую систему[13].
Удельная, молярная и объёмная теплоёмкости
Очевидно, что чем больше масса тела, тем больше требуется теплоты для его нагревания, и теплоёмкость тела пропорциональна количеству вещества, содержащегося в нём. Количество вещества может характеризоваться массой или количеством молей. Поэтому удобно пользоваться понятиями удельной теплоёмкости (теплоёмкости единицы массы тела):
и молярной теплоёмкости (теплоёмкости одного моля вещества):
где — количество вещества в теле; — масса тела; — молярная масса. Молярная и удельная теплоёмкости связаны соотношением [14][15].
Объёмная теплоёмкость (теплоёмкость единицы объёма тела):
Теплоёмкость для различных процессов и состояний вещества
Понятие теплоёмкости определено как для веществ в различных агрегатных состояниях (твёрдых тел, жидкостей, газов), так и для ансамблей частиц и квазичастиц (в физике металлов, например, говорят о теплоёмкости электронного газа).
Теплоёмкость идеального газа
Теплоёмкость системы невзаимодействующих частиц (например, идеального газа) определяется числом степеней свободы частиц.
Молярная теплоёмкость при постоянном объёме:
где ≈ 8,31 Дж/(моль·К) — универсальная газовая постоянная, — число степеней свободы молекулы[14][15].
Молярная теплоёмкость при постоянном давлении связана с соотношением Майера:
Теплоёмкость кристаллов
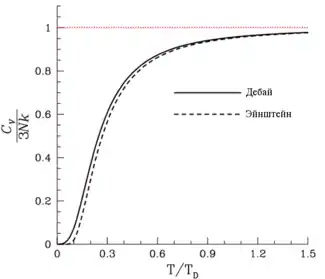
Существует несколько теорий теплоёмкости твёрдого тела:
- Закон Дюлонга — Пти и закон Джоуля — Коппа. Оба закона выведены из классических представлений и с определённой точностью справедливы лишь для нормальных температур (примерно от 15 °C до 100 °C).
- Квантовая теория теплоёмкостей Эйнштейна. Первое применение квантовых законов к описанию теплоёмкости.
- Квантовая теория теплоёмкостей Дебая. Содержит наиболее полное описание и хорошо согласуется с экспериментом.
Примечания
- Теплоёмкость. БРЭ, 2016.
- Булидорова Г. В. и др., Физическая химия, кн. 1, 2016, с. 41.
- Артемов А. В., Физическая химия, 2013, с. 14.
- Ипполитов Е. Г. и др., Физическая химия, 2005, с. 20.
- Сивухин Д. В., Термодинамика и молекулярная физика, 2006, с. 65.
- Сивухин Д. В., Термодинамика и молекулярная физика, 2006, с. 66.
- Лифшиц Е. М., Теплоёмкость, 1992.
- Белов Г. В., Термодинамика, ч. 1, 2017, с. 94.
- Лифшиц Е. М., Теплоёмкость, 1976.
- Базаров И. П., Термодинамика, 2010, с. 39.
- Борщевский А. Я., Физическая химия, т. 1, 2017, с. 115.
- Кубо Р., Термодинамика, 1970, с. 22.
- Беляев Н. М., Термодинамика, 1987, с. 5.
- Никеров. В. А. Физика: учебник и практикум для академического бакалавриата. — Юрайт, 2015. — С. 127—129. — 415 с. — ISBN 978-5-9916-4820-2.
- Ильин В. А. Физика: учебник и практикум для прикладного бакалавриата. — Юрайт, 2016. — С. 142—143. — 399 с. — ISBN 978-5-9916-6343-4.
Литература
- Артемов А. В. Физическая химия. — М.: Академия, 2013. — 288 с. — (Бакалавриат). — ISBN 978-5-7695-9550-9.
- Базаров И. П. Термодинамика. — 5-е изд. — СПб.—М.—Краснодар: Лань, 2010. — 384 с. — (Учебники для вузов. Специальная литература). — ISBN 978-5-8114-1003-3. (недоступная ссылка)
- Белов Г. В. Термодинамика. Часть 1. — 2-е изд., испр. и доп. — М.: Юрайт, 2017. — 265 с. — (Бакалавр. Академический курс). — ISBN 978-5-534-02731-0. (недоступная ссылка)
- Беляев Н. М. Термодинамика. — Киев: Вища школа, 1987. — 344 с.
- Борщевский А. Я. Физическая химия. Том 1 online. Общая и химическая термодинамика. — М.: Инфра-М, 2017. — 868 с. — (Высшее образование: Бакалавриат). — ISBN 978-5-16-104227-4. (недоступная ссылка)
- Булидорова Г. В., Галяметдинов Ю. Г., Ярошевская Х. М., Барабанов В. П. Физическая химия. Книга 1. Основы химической термодинамики. Фазовые равновесия. — М.: КДУ; Университетская книга, 2016. — 516 с. — ISBN 978-5-91304-600-0.
- Ипполитов Е. Г., Артемов А. В., Батраков В.В. Физическая химия / Под ред. Е. Г. Ипполитова. — М.: Академия, 2005. — 448 с. — (Высшее профессиональное образование). — ISBN 978-5-7695-1456-6.
- Кубо Р. Термодинамика. — М.: Мир, 1970. — 304 с. (недоступная ссылка)
- Лифшиц Е. М. Теплоёмкость // Физическая энциклопедия / Ред. А. М. Прохоров. — М.: Большая Советская Энциклопедия, 1992. — Т. 5. — С. 77–78.
- Лифшиц Е. М. Теплоёмкость // Большая советская энциклопедия / Ред. А. М. Прохоров. — 3-е издание. — М.: Большая Советская Энциклопедия, 1976. — Т. 25. — С. 451.
- Сивухин Д. В. Общий курс физики. — Издание 5-е, исправленное. — М.: Физматлит, 2006. — Т. II. Термодинамика и молекулярная физика. — 544 с. — ISBN 5-9221-0601-5.
- Теплоемкость // Большая российская энциклопедия. — М.: Большая российская энциклопедия, 2016. — Т. 32. — С. 54.