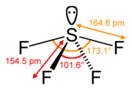
Тетрафторид серы
Тетрафторид серы (фторид серы(IV)) — неорганическое соединение с формулой SF4, бесцветный газ, реагирует с водой.
| Тетрафторид серы | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Тетрафторид серы | ||
| Традиционные названия | Фтористая сера | ||
| Хим. формула | SF4 | ||
| Физические свойства | |||
| Состояние | бесцветный газ | ||
| Молярная масса | 108,06 г/моль | ||
| Плотность | 1,9191-3 г/см³ | ||
| Энергия ионизации | 12,63 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -124; -122; -121,0 °C | ||
| • кипения | -40; -38; -37 °C | ||
| Критическая точка | 90,1 °C | ||
| Мол. теплоёмк. | 70,98 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -770 кДж/моль | ||
| Давление пара | 10,5 ± 0,1 атм[1] | ||
| Классификация | |||
| Рег. номер CAS | 7783-60-0 | ||
| PubChem | 24555 | ||
| Рег. номер EINECS | 232-013-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | WT4800000 | ||
| ChEBI | 30495 | ||
| Номер ООН | 2418 | ||
| ChemSpider | 22961 | ||
| Безопасность | |||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Получение
- Действие хлора под давлением на смесь серы и фторида натрия:
- Действие трифторида кобальта на серу:
- Разложение дифторида дисеры:
- Действие дихлорида серы на фторид натрия:
Физические свойства
Тетрафторид серы — бесцветный газ, термически устойчив до 700°С.
Растворяется в жидком фтористом водороде и бензоле.
Химические свойства
- Разлагается при сильном нагревании:
- Реагирует с влагой из воздуха:
- Реагирует с водой:
- Реагирует с горячей азотной кислотой:
- Реагирует с щелочами:
- При повышенном давлении и катализаторе реагирует с кислородом:
Применение
С помощью тетрафторида серы производят фторирование различных соединений: он способен замещать фтором группу OH в спиртах, кислород в группе CO альдегидов, кислот, кетонов и даже замещать атом кислорода и группу OH в карбоксильной группе тремя атомами фтора[2]:284 .
Безопасность
Тетрафторид серы очень ядовит. Реагируя со влагой воздуха, он образует пары фтористого водорода, глубоко поражающего живые ткани, а также сернистый газ. SF4 даже в малых количествах сильно раздражает глаза и слизистые мембраны, оказывает отравляющее действие при вдыхании. Поражает лёгкие, верхнюю часть пищеварительного тракта, кожу.
Примечания
- http://www.cdc.gov/niosh/npg/npgd0580.html
- Кнунянц И.Л., Фокин А.В. Химия фторуглеродов // Наука и человечество, 1964. — М.: Знание, 1964. — С. 280—300.
Литература
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1995. — Т. 4. — 639 с. — ISBN 5-82270-092-4.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.