Фотосистема II
Фотосисте́ма II (втора́я фотосисте́ма, фотосисте́ма два, ФСII), или H2O-пластохиноноксидоредуктаза — первый функциональный комплекс электрон-транспортной цепи (ЭТЦ) хлоропластов. Он расположен в мембранах тилакоидов всех растений, водорослей и цианобактерий. Поглощая энергию света в ходе первичных фотохимических реакций, он формирует сильный окислитель — димер хлорофилла a (П680+), который через цепь окислительно-восстановительных реакций способен вызвать окисление воды.
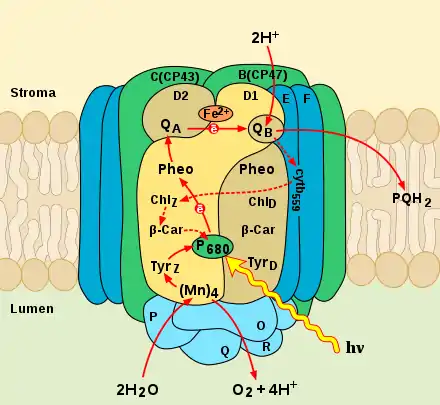
Окисляя воду, фотосистема II поставляет электроны в ЭТЦ хлоропласта, где они используются для восстановления НАДФ+ или циклического фосфорилирования. Помимо этого, окисление воды приводит к образованию протонов и формированию протонного градиента, используемого в дальнейшем для синтеза АТФ[1]. Фотохимическое окисление воды, которое осуществляет фотосистема II, сопровождается выделением молекулярного кислорода. Этот процесс (составная часть фотосинтеза растений) является основным источником кислорода на Земле.
История открытия
Реакционный центр ФСII был выделен в 1971 году Л. Верноном. В изучение его структурной организации особый вклад внесли исследования Х. Т. Витта (1962), в которых методом дифференциальной спектрофотометрии был выделен пигмент П680, и лаборатории А. А. Красновского (В. В. Климов, В. А. Шувалов, А. А. Красновский, 1977), в которых методом импульсной спектроскопии был найден первичный акцептор реакционного центра II — феофитин[2]. В течение нескольких десятков лет различные группы исследователей пытались определить пространственную структуру компонентов, составляющих комплекс фотосистемы II. В итоге методом рентгеноструктурного анализа в 2001 году А. Зоуни с коллегами удалось впервые получить пространственную структуру ФСII из цианобактерии Synechococcus elongatus с разрешением 3,8 Å. При этом фермент был в активной форме, то есть ФСII в кристаллической форме расщепляла воду под воздействием света[3].
Отличия от фотосистемы I
Основная функция фотосистемы II — генерация сильного окислителя, который индуцирует процесс окисления воды и перенос её электронов на мембранный переносчик. Основная функция фотосистемы I — насытить эти низкоуровневые электроны энергией, чтобы с их помощью осуществить восстановление НАДФ+. Поскольку энергия суммарного процесса слишком велика, чтобы осуществить его в рамках одного реакционного центра, в ходе эволюции появились две фотосистемы, которые раздельно осуществляют разные части этой реакции. Их специфические функции и определяют особенности их строения. Так, фотосистема I симметрична, то есть в ней работают две ветви электронного транспорта, что делает его значительно более быстрым, в то время как фотосистема II асимметрична и обладает только одной рабочей ветвью, что замедляет транспорт электронов, но делает его более управляемым. Обе фотосистемы значительно отличаются по строению антенн, дополнительных субъединиц, способов регуляции и положению в мембране[4]. Так, фотосистема I обладает интегральной антенной, хлорофиллы которой расположены непосредственно на главных белках комплекса — А и B, в то время как у фотосистемы II они вынесены на внешние белки CP47 и CP43. По количеству дополнительных малых регуляторных субъединиц ФСII значительно превосходит ФСI, что связано с необходимостью тонкой регуляции процесса окисления воды, который потенциально крайне опасен для клетки. Этим же объясняется неоднородное распределение фотосистем в мембране тилакоида: ФСI располагается преимущественно в области маргинальных, торцевых и стромальных мембран, а ФСII практически полностью находится в области спаренных мембран, что обеспечивает клетке дополнительную защиту от продуцируемых ею активных форм кислорода[5].
Главное отличие фотосистемы II от фотосистемы I — это наличие большого обращённого в люмен домена, который состоит из марганцевого кластера и окружающих его защитных белков. Именно здесь происходит процесс фотохимического окисления воды, сопровождаемый выделением кислорода и протонов[4].
Структурная организация фотосистемы II
| Фотосистема II | |
|---|---|
 Структура димера фотосистемы II из цианобактерии Thermosynechococcus elongatus [8][7] | |
| Идентификаторы | |
| Шифр КФ | 1.10.3.9 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| Интегральный светособирающий комплекс фотосистемы II CP43/CP47 | |
|---|---|
 | |
| Идентификаторы | |
| Символ | PSII |
| Pfam | PF00421 |
| InterPro | IPR000932 |
| TCDB | 3.E.2 |
| OPM superfamily | 2 |
| OPM protein | 3arc |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Фотосистема II состоит из следующих белковых субъединиц и кофакторов[9][10][11][12]:
| Субъединицы | Описание |
|---|---|
| D1 | 32 кДа, интегральный коровый белок, несёт три хлорофилла а и один β-каротин |
| D2 | 33 кДа, интегральный коровый белок, несёт три хлорофилла а и один β-каротин |
| B(CP47) | 47 кДа, около 510 аминокислот, связывает 16 молекул хлорофилла и 5 молекулы β-каротина, интегральная антенна ФСII, люминальный домен связывается с марганцевым кластером |
| C(CP43) | 43 кДа, около 470 аминокислот, связывает около 13 молекул хлорофилла и 5 молекулы β-каротина, интегральная антенна ФСII, гомологичен B(CP47), менее плотно связан с ядром ФСII, что может играть важную роль при репарации после фотодеструкции |
| E | 9 кДа, у высших растений около 81 аминокислоты, α-субъединица цитохрома b559 |
| F | 4 кДа, у высших растений около 38 аминокислот, β-субъединица цитохрома b559 |
| H | 7,7 кДа, по-видимому, играет роль в регуляции переноса электрона с QA на QB, стабилизирует CP47 и CP43 |
| I | 4,8 кДа, мало различается у разных видов, необходим для сборки и функционирования ФСII, способствует образованию димера фотосистем |
| J | 4,2 кДа, важна для сборки ФСII, регулирует поток электронов на пул пластохинонов |
| K | 4,1 кДа, у всех оксигенных организмов, очень консервативна, образование димера ФСII, стабилизирует ядро фотосистемы |
| L | 4,3 кДа, необходим для работы сайта Qa, предотвращает возврат электрона с сайта Qb на Qa |
| M | 4,7 кДа, у всех оксигенных организмов, стабилизирует димер ФСII |
| O | 27 кДа, защищает ВОК, связывает ион кальция |
| P | 20 кДа, нет у цианобактерий, защищает ВОК, регулирует ионное окружение |
| Q | 17 кДа, нет у цианобактерий, защищает ВОК, регулирует ионное окружение |
| R | 12,8 кДа, играет роль якоря, связывая субъединицу P и стабилизируя её |
| S | 22 кДа, отсутствует у цианобактерий, участвует в нефотохимическом тушении ССКII |
| T(Tc) | 3,8 кДа, стабилизирует сайт Qa, стабилизирует димер |
| T(Tn) | 3 кДа, только у растений и водорослей, имеет бисульфидный мостик, находится в люмене, функция неизвестна |
| U | 10 кДа, только у цианобактерий, бурых и красных водорослей, расположена в люмене, возможно поставляет ионы кальция и хлора работы ВОК, связывается с ФСII через субъединицу O или V |
| V | 12,1 кДа только у цианобактерий, бурых и красных водорослей, известна как цитохром c550, несёт гем, оптимизирует работу ВОК |
| W | 6,1 кДа, только у растений и водорослей, участвует в образовании димера, сборке и репарации ФСII |
| X | 4,2 кДа, функция неизвестна |
| Y | 4,7 кДа, функция неизвестна |
| Z | 6,5 кДа, обеспечивает взаимодействие с тримером ССКII |
| Пигменты | |
| Хлорофилл a | 35 молекул в антенной системе |
| Хлорофилл a | 2 молекулы сопровождающих хлорофиллов (ХлD,ХлZ) |
| Хлорофиллы а и a' | специальная пара П680 |
| β-каротин | 12 молекул |
| Коферменты/Кофакторы | |
| Гем b559 | Протопорфирин IX, содержащий атом железа |
| Феофитин | Первичный акцептор электронов |
| Пластохинон | Мобильный переносчик электронов |
| Марганцевый кластер | Также известен как водоокисляющий комплекс или ВОК |
| Fe2+ | Осуществляет перенос электрона от QA к QB |
| Ca2+ | ион кальция |
| Cl- | ион хлора |
| НCO3- | гидрокарбонат анион |
У эукариот большинство малых субъединиц, а также субъединиц, окружающих водоокисляющий комплекс (ВОК) — psbO, psbP, psbQ, psbR, psbS, psbTn, psbW, psbX, psbZ — кодируются в ядре. Там же находятся гены семейства cab, кодирующие белки светособирающего комплекса II (ССКII). Такой способ распределения генов, когда большие коровые субъединицы белка остаются в хлоропласте, а относительно малые субъединицы, выполняющие регуляторные функции, переносятся в ядро, позволяет эукариотической клетке лучше контролировать процесс фотосинтеза и помогает скоординировать работу двух геномов[13].
Субъединица G была исключена из списка субъединиц фотосистемы II, поскольку было показано, что она кодируется геном ndh, который ответственен за синтез ферредоксин-НАДФ+-редуктазы, а следовательно, не является частью фотосистемы II[13]. Субъединица N, расположенная в том же опероне, что и psbB, как оказалось, не является частью комплекса фотосистемы II, однако находится в мембране тилакоида и осуществляет сборку и организацию её реакционного центра и других субъединиц, входящих в коровый комплекс[14]. Сомнения вызывает и субъединица S, которая отсутствует в суперкомплексе ФСII-ССКII, однако этот вопрос остаётся спорным, поскольку поступают сообщения, что её можно обнаружить в димере ФСII[10].
За последнее десятилетие было открыто множество дополнительных белков, участвующих в работе фотосистемы II. Так, Psb27 играет важную роль в репарации и организации марганцевого кластера, Psb28 участвует в биогенезе CP47, Psb29 — в биогенезе ФСII у арабидопсиса и Synechocystis, Psb30 широко распространён в геномах фотосинтезирующих организмов и необходим для стабильной работы ФСII, а Psb31 был обнаружен в водоокисляющем комплексе диатомовой водоросли Chaetoceros gracilis[15]. Для некоторых из этих белков было показано, что они связываются со зрелой фотосистемой II или присоединяются к ней на определённых этапах её созревания и сборки, но на данный момент нет убедительных доказательств, позволяющих утверждать, что они являются конститутивной частью этого белкового комплекса. Процесс выделения и исследования малых субъединиц ФСII крайне затруднён по причине их малой молекулярной массы, большой гидрофобности и отсутствия явно выраженной кислотности-основности. По этой, а также по ряду других причин до сих пор не существует единой модели строения фотосистемы II[10].
Окислительно-восстановительные (редокс-) агенты, участвующие в транспорте электронов, располагаются в центральной части — ядре — комплекса ФСII и связаны с интегральными белками D1 и D2. Они имеют очень высокую степень гомологии друг с другом по первичному аминокислотному составу, а также с L- и M-полипептидами реакционного центра пурпурных бактерий. Любопытно отметить, что, в отличие от высших растений и водорослей, у которых D1 и D2 представлены только одной копией на геном, у некоторых цианобактерий может иметься несколько копий D1 и D2, по-разному экспрессируемых в зависимости от внешних условий[13]. Белки образуют по пять трансмембранных α-спиралей, аминокислотные остатки которых связывают компоненты реакционного центра ФСII, например, на этих белках организован димер П680. Кроме того, каждый из белков присоединяет ещё по три молекулы хлорофилла a (дополнительные и сопровождающие хлорофиллы), молекулу феофитина а, β-каротин и пластохинон (QA связан с белком D2, а QB — с белком D1). Между QA и QB находится ион двухвалентного железа, в координации которого участвуют оба интегральных белка. Люменальный домен пептида D1 присоединяет четыре иона марганца и формирует марганцевый кластер. Кроме белков D1 и D2, в состав ядра ФСII входят белки CP47 и CP43 (связывают ХлZ и ХлD, расположенные между П680 и феофитинами), которые составляют внутреннюю антенну, а также цитохром b559. Подобно реакционному центру пурпурных бактерий, в фотосистеме II, ввиду её асимметричности, работает только одна ветвь электронного транспорта, расположенная на белке D1. Сущность явления асимметрии заключается в том, что редокс-агенты образуют разное число водородных связей на белках D1 и D2. Это влияет на их окислительно-восстановительный потенциал и делает невозможным прямой транспорт электронов через белок D2[12].
Оптимизацию работы водоокисляющего комплекса обеспечивают три гидрофильных белка: P, Q и O (O, V и U у цианобактерий). Они составляют периферийный домен фотосистемы II. Эта группа белков, называемая белками водоокисляющего комплекса, располагается на люменальной стороне мембраны вблизи марганцевого кластера и играет структурную, защитную и регуляторную роль в процессе окисления воды. Белок O влияет на состояние марганцевого кластера, а два других белка важны для создания в его области необходимых для окисления воды концентрации ионов кальция и хлора. Хотя подавляющее число белков обоих фотосистем практически полностью состоит из α-спиралей, субъединицы P, Q и O, напротив обогащены β-структурами, что делает их более прочными и устойчивыми к окислению[12].
Белок ядра фотосистемы I А гомологичен белкам D1+СP43 (молекулярная масса белка А соответствует сумме молекулярных масс белков D1 и СP43) из фотосистемы II, а белок В гомологичен белкам D2+CP47 соответственно[16].
Tyrz
Tyrz — остаток тирозина белка D1 (Tyr-161). Это промежуточный переносчик электронов, который переносит электроны между марганцевым кластером и П680. Перенос электронов происходит с образованием нейтрального радикала (Tyrz •)[12].
Специальная пара П680
П680, в английской литературе P680 (от англ. pigment, пигмент) — это пара хлорофиллов a, с максимумом поглощения при длине волны в 680 нм. Поглощая энергию света, она отдаёт один электрон на феофитин, а сама окисляется и становится сильным окислителем П680+ с окислительно-восстановительным потенциалом +1,12 В[17], что позволяет ей индуцировать процесс окисления воды, потенциал которой +0,8 В. В то же время редокс-потенциал фотовозбуждённого П680 находится в отрицательной области (менее —0,6 В). В отличие от специальной пары фотосистемы I и пары бактериофиллов в фотосистеме пурпурных бактерий, в П680 хлорофиллы находятся на значительно большем расстоянии (5,2 Å против 3,6 Å в П700 и 3,5 Å в П870), а их плоскости несколько наклонены относительно друг друга, что значительно снижает энергию экситонного сопряжения и замедляет скорость захвата энергии света, что в свою очередь делает более медленным процесс разделения зарядов на паре хлорофиллов. Низкая скорость захвата энергии позволяет регулировать уровни возбуждения в антенне ФСII, что защищает реакционный центр от фотоингибирования[18]. Фотосистема II, так же как и реакционный центр пурпурных бактерий, асимметрична, и две молекулы в димере не эквивалентны. Одна молекула хлорофилла а (П1) образует водородные связи с аминокислотами белка D1 при помощи кетоэфирных групп в C9 и C10 положениях, а вторая молекула хлорофилла а (П2) образует только одну водородную связь. Поскольку П1 образует большее число водородных связей, его редокс-потенциал выше и электрондвижущая сила больше. В момент возбуждения димера электрон переходит от П2 к молекуле хлорофилла П1, и образуется диполь. Из-за возникновения локального электрического поля происходит изменение конформации специальной пары, что облегчает дальнейший перенос электрона на феофитин, а положительный заряд локализуется на одном из хлорофиллов[19].
- В соответствии со следующим уравнением П680 переходит в возбуждённое состояние, поглощая квант света или через перенос энергии возбуждения от других хлорофиллов фотосистемы II, в результате чего один из его электронов переходит с основного подуровня S0 на первый синглетный подуровень S1:
Феофитин
Феофитин — первый акцептор электронов в фотосистеме II. Именно здесь, между феофитином (Eо‘ = —0,53 В) и фотовозбуждённым пигментом П680, происходит первичное фотохимическое разделение зарядов. Перенос электрона осуществляется в течение нескольких пикосекунд[20].
- Фотовозбуждённый П680* отдаёт один электрон феофитину, в результате чего происходит разделение зарядов, и образуется первичная радикальная пара:
Пластохиноны QA и QB

В ФСII есть два сайта связывания пластохинонов: в одном из них (QA·Fe2+) постоянно находится связанный пластохинон в комплексе с железом, а второй сайт (QB) способен обратимо связывать свободные пластохиноны мембраны. Оба пластохинона играют роль вторичных акцепторов электрона, принимая его от феофитина. Перенос электрона между феофитином и пластохиноном происходит в первые 200 пикосекунд. Сначала происходит перенос электрона от феофетина и одноэлектронное восстановление QA, в результате чего он переходит в форму свободного радикала — семихинона. Аминокислотное окружение сайта QA делает его крайне нестабильным и повышает его восстановительную способность (Eо‘ = —0,13 В), так что он сразу же передаёт электрон на QB. При этом QA окисляется и готов принять следующий электрон от феофитина, а QB остаётся в форме семихинона до следующего акта передачи электронов, стабилизированный своим аминокислотным окружением. Получив от QA второй электрон, QB полностью восстанавливается, используя два протона из стромального пространства. В форме QBH2 он диссоциирует из комплекса ФСII в гидрофобную фазу мембраны и становится компонентом пула пластохинонов[12].
- Феофитин отдаёт электрон QA с образованием семихинон-радикала:
- QA восстанавливает QB, который тоже переходит в состояние семихинон-радикала:
- QB получает второй электрон от QA и завершает своё восстановление, присоединяя два протона из стромы и диффундируя в липидный бислой:
Цитохром b559
Цитохром b559 — гетеродимерный белок, состоящий из одной альфа (PsbE) и одной бета (PsbF) субъединицы, между которыми расположен гем. Этот белок является одним из основных компонентов ядра фотосистемы II. Хотя цитохром b559 и не принимает участия в основном транспорте электронов, он играет важнейшую роль во вспомогательном или циклическом транспорте электронов, который позволяет восстановить окисленный П680 при заблокированном потоке электронов от воды.
В ФСII обнаружены две формы цитохрома b559: высокопотенциальная (b559H Eо‘ = +0,37 В) и низкопотенциальная (b559L Eо‘ = +0,08 В). Высокопотенциальная форма протонирована, низкопотенциальная — депротонирована. При определённых условиях наблюдается взаимопревращение одной формы в другую, поэтому цитохром b559 может осуществлять не только циклический транспорт электронов, но и транспорт протонов в люмен в ходе окислительно-восстановительных реакций[21].
Водоокисляющий комплекс

Марганцевый кластер состоит из четырёх атомов марганца в степени окисления от +3 до +5, пяти связывающих их атомов кислорода и одного атома кальция. Точная структура марганцевого кластера до сих пор остаётся предметом споров и догадок. Крайне недостоверными оказались его структуры, полученные методом рентгено-кристаллгоргафии, поскольку было показано, что атомы марганца могут восстанавливаться под воздействием рентгеновского излучения. Однако кристаллография в комбинации с другими, более щадящими спектроскопическими методами, такими как EXAFS и ЭПР, помогли учёным получить довольно хорошее представление о базовой организации кластера. Также полагают, что в поддержании структуры марганцевого кластера может участвовать гидрокарбонат-анион, который связывается с люменальным доменом D1[22].
Механизм окисления воды в настоящее время ещё не вполне ясен, но можно считать экспериментально доказанным следующее. Движущей силой окисления воды является образование в ходе первичных фотохимических реакций очень сильного окислителя П680 с потенциалом +1,12 В. Между марганцевым кластером и П680 существует промежуточный переносчик электронов TyrZ — остаток тирозина белка D1 (Tyr-161), который последовательно переносит четыре электрона от воды на специальную пару хлорофиллов.

Последовательность реакций представляется следующим образом. TyrZ окисляется и восстанавливает П680+. Окисление тирозина идёт с образованием нейтрального радикала (TyrZ•), что указывает на сопряжённость процесса снятия электрона от гидроксила тирозина с процессом передачи его протона на акцептор. В качестве акцепторов протона могут выступать остатки гистидина H190 и глутаминовой кислоты E189 белка D1, расположенные вблизи тирозина-161. Далее протон может быть передан по цепочке аминокислот к люменальной поверхности мембраны, где происходит его выброс в люменальное пространство. Тирозин же восстанавливается за счёт работы марганцевого кластера и окисления воды: образовавшийся нейтральный радикал TyrZ• отрывает атом водорода от молекулы воды, связанной с атомами марганца в кластере. Только один из ионов марганца, а именно четвёртый Mn, связывает молекулу воды в качестве субстрата и забирает от неё электроны. Предполагается, что непосредственно перед формированием O=O связи четвёртый Mn переходит в состояние Мn+5. В этом случае O=O связь может быть образована за счёт нуклеофильной атаки на электрон-дефицитный комплекс Мn+5=O второй молекулой воды, которая связана с близлежащим ионом кальция. Полное окисление воды и образование кислорода требует четырёхкратного повторения описанных событий[12].
Кинетика водоокисления
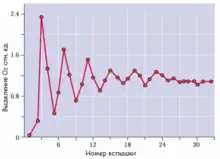
Состояние системы окисления воды меняется в зависимости от уровня окисленности атомов марганца в кластере. Представления о существовании отдельных функционально различимых состояний (S-состояний) водоокисляющей системы возникло на основе работ П. Жолио и сотр. (1969)[23]. Они показали, что при облучении адаптированных к темноте хлоропластов кратковременными вспышками света, выделение кислорода происходит колебательно, с максимумом на третью вспышку и периодом, соответствующим четырём вспышкам[24]. Опираясь на результаты этих экспериментов, Бессель Кок и сотр.[25] предложили модель S-цикла, согласно которой система окисления воды может находиться в различных состояниях, обозначаемых S0, S1, S2, S3 и S4. Переход из одного состояния в другое совершается в результате действия вспышки света и удаления электрона из системы. Выделение молекулярного кислорода из двух молекул воды происходит лишь при переходе из состояния S3 в S4, причём состояние S4 нестабильно и сразу же переходит в S0. Согласно современным представлениям, в ходе S-цикла изменяется валентность атомов Mn. В результате изменения окислительно-восстановительных свойств кластера достигается высокий потенциал (потенциал максимально окисленного кластера около +0,9 В), что делает возможным окисление воды. Этот процесс сопровождается выделением четырёх протонов в люмен, но оно не синхронизировано с выделением кислорода[12].
Светособирающий комплекс

Внутренняя антенна фотосистемы II состоит из двух кодируемых хлоропластным геномом белков — CP43 и CP47, которые вплотную примыкают к центральному гетеродимеру D1/D2 (CP43 располагается вблизи D1, а CP47 — около D2). Белок CP43 ассоциирован с 13 молекулами хлорофилла а и 3—5 молекулами β-каротина[10]. CP47 несёт 16 молекул хлорофилла а и 5 молекул β-каротина. С этими антеннами контактируют внешние «минорные» антенны: CP29, CP26 и CP23, также известные как Lhcb4-6, причём CP26, CP29 и ССКII находятся в контакте друг с другом. Каждый из этих белков содержит по 18 молекул хлорофилла а, 9 молекул хлорофилла b и 6 молекул каротиноида[26]. Благодаря своему положению минорные белки осуществляют функцию регулирования стока энергии от внешних антенн на реакционный центр ФСII. Именно в минорных белках протекает виолоксантиновый цикл, играющий фотопротекторную роль при избыточном освещении и помогающий подготовить растение к смене дня и ночи[27].
Внешняя мобильная антенна или ССКII состоит из Lhcb1-3 (масса около 26 кДа), организованных в тример. Все три белка кодируются в ядре. Каждый из белков мобильной антенны содержит 7 молекул хлорофилла а, 6 молекул хлорофилла b, 2 перекрещенные молекулы лютеина, и по одной молекуле неоксантина и виолоксантина (или зеаксантина). При фосфорилировании этой антенны специальными ферментами её заряд становится более отрицательным, и она мигрирует от фотосистемы II в область расположения фотосистемы I, где ассоциируется с её внешней антенной. Таким образом осуществляется перераспределение энергии между двумя фотосистемами и тонкая настройка фотосинтеза[26].
Защита от фотоингибирования
Циклический транспорт электронов
Помимо основного, нециклического потока электронов, в ходе которого происходит перенос низкоуровневых электронов от воды на пул пластохинонов, фотосистема II может осуществлять циклический транспорт электронов внутри самой себя, когда электрон курсирует по замкнутому пути внутри фотосистемы. Такой вид транспорта реализуется в условиях, когда интенсивность света превышает возможности ЭТЦ утилизировать его энергию или при повреждении водоокисляющего комплекса. В ходе этого процесса происходит обратный перенос электронов от восстановленного первичного хинона QB на цитохром c559, затем на вспомогательный хлорофилл ХлZ, а далее на β-каротин, который восстанавливает окисленный пигмент П680+. В экстремальных условиях возможно протекание псевдоциклического транспорта электронов (перенос электронов от воды на кислород)[18].
П680+ является сильнейшим окислителем и поэтому представляет серьёзную опасность для клетки. В нормальных физиологических условиях донором электронов для него является TyrZ, однако в экстренном восстановлении, например в условиях низкой температуры, в его восстановлении могут принимать участие TyrD, ХлZ и ХлD, а также β-каротин белка D1[18]. В результате восстановления П680+ β-каротин окисляется с образованием каротин-радикала (Car+), поглощающего при 950 нм. Восстановление Car+ возможно через цитохром b559[28].
Защитная функция каротиноидов
Помимо участия в циклическом транспорте, у каротиноидов реакционного центра есть и другая функция — осуществлять тушение триплетного хлорофилла. На D1 и D2 белках симметрично расположены две молекулы β-каротина. На D1 β-каротин находится в форме все-транс, то есть все его связи находится в транс-положении, в то время как на D2 β-каротин имеет одну цис-связь в 15-м положении. Если в результате фотовозбуждения образуется крайне реакционно-активная триплетная форма одного из хлорофиллов пигмента П680, β-каротин поглощает часть его избыточной энергии, переводя электрон в основное состояние. При этом происходит спонтанный переход связи в 15-м положении из цис- в транс-, а избыточная энергия триплетного электрона выделяется в виде тепла[29]:
Репарация фотосистемы II
Ещё один механизм защиты от фотоингибирования — замена «жертвенного» белка D1. Из-за высокого содержания фотоактивных редокс-агентов и ароматических аминокислот, а также вследствие близости к водоокисляющему комплексу этот белок весьма неустойчив к действию света, поэтому при интенсивной инсоляции он быстро окисляется или претерпевает процесс фотодеструкции. Интенсивность синтеза D1 белка составляет 50 % от всех синтезируемых в хлоропласте белков, тогда как его доля от белков хлоропласта — 0,1 %. Время полужизни этого белка всего 30 минут.
Процесс репарации происходит по следующей схеме. Сначала происходит разборка комплекса ФСII: уходят белки ВОК, снимаются атомы Mn, отсоединяются CP43 и CP47. Далее происходит удаление «испорченного» белка: «отгрызаются» выступающие из мембраны участки белка D1 (работает специальная протеаза degP2), а специальный белок AtFtsH «выталкивает» его останки из мембраны и протеолитически разлагает их[30]. Синтез нового белка D1 идёт в ламеллах, после чего он претерпевает процессинг (удаляется N-концевой метионин, оставшийся треонин ацетилируется, этот треонин может обратимо фосфорилироваться). Затем происходит миграция D1 в граны: белок пальмитируется и в таком виде встраивается в мембрану гран, после чего происходит обратная сборка ФСII[31][32].
Локализация в мембране тилакоида
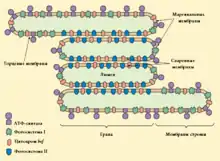
Фотосистема II, генерируя сильный окислитель и являясь потенциальным источником активных форм кислорода, представляет серьёзную опасность для клетки. Поэтому неудивительно, что большая часть этого комплекса расположена в области спаренных мембран — в максимально удалённом и защищённом месте[33].
В отличие от фотосистемы I, которая у высших растений присутствует только в виде мономера, фотосистема II способна образовывать димеры во всех трёх фотосинтезирующих группах организмов (растения, цианобактерии, водоросли). Полагают, что образование димера способствует устойчивости ФСII, а также служит одним из тонких механизмов настройки фотосинтеза. В общем случае, для высших растений получены приблизительно следующие результаты. Две молекулы ФСII, образующие димер и присоединяющие 2—4 тримера ССКII, называются суперкомплексами. Такие димеры преобладают в центральной части гран — спаренных и маргинальных мембранах, где они организованны в специфические упорядоченные структуры, однако они практически не встречаются в области торцевых и стромальных мембран. Помимо суперкомлекса, в мембране присутствует димер ФСII, содержащий только минорные антенны; он более равномерно распределён по мембране тилакоидов, его концентрация максимальна в области маргинальных мембран, но даже в торцевых и стромальных мембранах он составляет не ниже 10 % от общего числа ФСII. Торцевые мембраны преимущественно заняты мономерными комплексами ФСII с разным количеством антенн, из которых менее 2 % составляют так называемые базовые ФСII (D1 + D2 + цит. b559), проходящие здесь цикл репарации[5].
Ингибиторы
Существует множество ингибиторов фотосистемы II, многие из которых являются экономически значимыми гербицидами, используемыми для подавления роста сорняков. Их даже выделяют в отдельный подкласс гербицидов, который называется ингибиторы фотосинтеза. По состоянию на сегодняшний день около 30 % из всех используемых гербицидов относятся к этому классу[34]. Ингибиторы фотосистемы II связываются с белком D1 в сайте связывания внешнего пластохинона QB, не давая фотосистеме восстанавливать пластохинон и пополнять пул мембранного пластохинона. Несмотря на то, что все гербициды в этой группе связываются с QB-центром, аминокислотный сайт связывания каждого из них отличен от сайта связывания других. Хотя и происходит подавление фотосинтеза, растение умирает не от недостатка питательных веществ и АТФ как можно было бы подумать, а от другого побочного эффекта остановки фотосинтеза. В результате ингибирования фотосистемы II, энергия света расходуется на генерацию большого количества активных форм кислорода, а также триплетных и синглетных форм хлорофилла. Всё это приводит к перекисному окислению мембран, разрушению белков, пигментов и липидов, нарушению целостности клетки и вытеканию её содержимого[35].
Все ингибиторы фотосистемы II можно разделить на десять групп в соответствии с их химическим строением (не все гербициды, относящиеся к той или иной группе химических соединений являются ингибиторами ФСII, некоторые из них имеют другой механизм действия)[36][34][35]:
- Фенилкарбаматы (десмедифам, фенмедифам)
- Пиридазиноны (хлоридазон)
- Триазины (аметрин (гербицид), атразин, прометон, прометрин, пропазин, симазин)
- Триазиноны (гексазинон, метрибузин)
- Урацилы (бромацил, тербацил)
- Амиды (пропанил)
- Мочевины (диурон, фторметурон, линурон, тебутиурон)
- Бензотиадиазиноны (бентазон)
- Нитрилы (бромоксинил, иоксинил)
- Фенилперидазины (пиридат)
Галерея
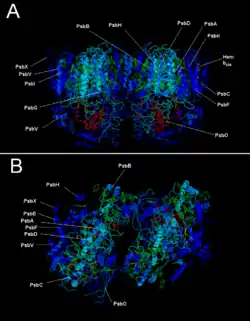
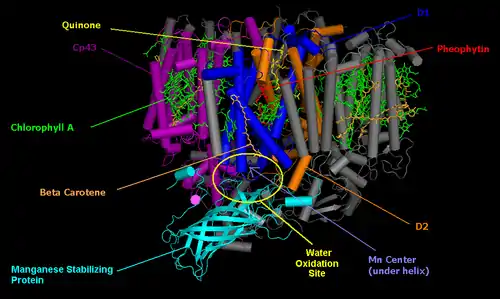 Фотосистемы II с указанием субъединиц
Фотосистемы II с указанием субъединиц Димер ФСII и белки внешней антенны.
Димер ФСII и белки внешней антенны. Положение в мембране
Положение в мембране Димер ФСII из T. elongatus
Димер ФСII из T. elongatus Схема фотосистемы II
Схема фотосистемы II
Примечания
- Loll B. et al. Towards complete cofactor arrangement in the 3.0 Å resolution structure of photosystem II (англ.) // Nature. — December 2005. — Vol. 438, no. 7070. — P. 1040—1044. — doi:10.1038/nature04224. — PMID 16355230.
- Ермаков, 2005, с. 155.
- А. Г. Габдухлаков, М. В. Донцова. Структурные исследования фотосистемы II цианобактерий (рус.) // Успехи биологической химии. — Институт белка РАН, Пущино, Московская область, 2013. — Т. 53. — С. 323—354. Архивировано 2 апреля 2015 года.
- Ермаков, 2005, с. 121.
- Ravi Danielsson, Marjaana Suorsa, Virpi Paakkarinen, Per-Åke Albertsson, Stenbjörn Styring, Eva-Mari Aro and Fikret Mamedov. Dimeric and Monomeric Organization of Photosystem II (англ.) // The Journal of Biological Chemistry : journal. — 2006. — May (no. 281). — P. 14241—14249. — doi:10.1074/jbc.M600634200.
- PDB 2AXT
- Bernhard Loll, Jan Kern,Wolfram Saenger, Athina Zouni & Jacek Biesiadka. Towards complete cofactor arrangement in the 3.0 Å resolution structure of photosystem II (англ.) // Nature : journal. — 2005. — December (no. 438). — P. 1040—1044. — doi:10.1038/nature0422410.1021/bi0348260. — PMID 16355230.
- PDB 2AXT
- Ohad I., Dal Bosco C., Herrmann R.G., Meurer J. Photosystem II proteins PsbL and PsbJ regulate electron flow to the plastoquinone pool (англ.) // Biochemistry : journal. — 2004. — March (vol. 43, no. 8). — P. 2297—2308. — doi:10.1021/bi0348260. — PMID 14979726.
- Lan-Xin Shia, b, Wolfgang P. Schröder. The low molecular mass subunits of the photosynthetic supracomplex, photosystem II (англ.) // Biochim Biophys Acta : journal. — 2004. — January (vol. 15, no. 1608). — P. 75—96. — doi:10.1016/j.bbabio.2003.12.004. — PMID 14871485.
- Govindjee, Jan F Kern, Johannes Messinger, John Whitmarsh. Photosystem II (неопр.).
- Ермаков, 2005, с. 168–170.
- The Photosynthetic Apparatus: Molecular Biology and Operation / Lawrence Bogorad, Indra K. Vasil. — USA/UK: Academic Press, Ink., 1991. — Vol. 7. — P. 524. — ISBN 9780323147231.
- Torabi S., Umate P., Manavski N., Plöchinger M., Kleinknecht L., Bogireddi H., Herrmann R.G., Wanner G., Schröder W.P., Meurer J. PsbN is required for assembly of the photosystem II reaction center in Nicotiana tabacum (англ.) // Plant Cell. : journal. — 2014. — March (vol. 26, no. 3). — P. 1183—1199. — PMID 24619613.
- Peter D. Mabbitt, Sigurd M. Wilbanks, Julian J. Eaton-Rye. Structure and function of the hydrophilic Photosystem II assembly proteins: Psb27, Psb28 and Ycf48 (англ.) // Plant Physiology : journal. — American Society of Plant Biologists, 2014. — August (vol. 81). — P. 96—107. — doi:10.1016/j.plaphy.2014.02.013.
- Хелдт, 2011, с. 99.
- Grzegorz Raszewski, Bruce A. Diner, Eberhard Schlodder and Thomas Renger. Spectroscopic properties of reaction center pigments in photosystem II core complexes: Revision of the multimer model (англ.) // Biophys. J. : journal. — 2008. — Vol. 95. — P. 105—119. — doi:10.1529/biophysj.107.123935.
- Ермаков, 2005, с. 161.
- Rutherford A.W., Faller P. Photosystem II: evolutionary perspectives (англ.) // Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences : journal. — 2003. — 29 January (vol. 358, no. 1429). — P. 245—253. — doi:10.1098/rstb.2002.1186. — PMID 12594932.
- Suleyman I. Allakhverdiev, Tatsuya Tomo, Yuichiro Shimada, Hayato Kindo, Ryo Nagao, Vyacheslav V. Klimov, and Mamoru Mimuro. Redox potential of pheophytin a in photosystem II of two cyanobacteria having the different special pair chlorophylls (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — February 23, 2010. — Vol. 107, no. 8. — P. 3924—3929.
- Daniel I. Arnon and George M.-S. Tang. Cytochrome b-559 and proton conductance in oxygenic photosynthesis (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 1988. — Vol. 85, no. 24. — P. 9524—9528. — PMID 16594007.
- Ferreira K.N., Iverson T.M., Maghlaoui K., Barber J., Iwata S. Architecture of the photosynthetic oxygen-evolving center (англ.) // Science : journal. — 2004. — March (vol. 303, no. 5665). — P. 1831—1838. — doi:10.1126/science.1093087. — PMID 14764885.
- Joliot P., Barbieri G., Chabaud R. Un nouveau modele des centres photochimiques du systeme II (фр.) // Photochemistry and Photobiology : magazine. — 1969. — Vol. 10, no 5. — P. 309—329. — doi:10.1111/j.1751-1097.1969.tb05696.x.
- Joliot P. Period-four oscillations of the flash-induced oxygen formation in photosynthesis (англ.) // Drugs : journal. — Adis International, 2003. — Vol. 76, no. 1—3. — P. 65—72. — doi:10.1023/A:1024946610564. — PMID 16228566.
- Kok B., Forbush B., McGloin M. Cooperation of charges in photosynthetic O2 evolution-I. A linear four step mechanism (англ.) // Photochem. Photobiol. : journal. — 1970. — June (vol. 11, no. 6). — P. 457—475. — doi:10.1111/j.1751-1097.1970.tb06017.x. — PMID 5456273.
- Страсбургер, 2008, с. 107.
- Ермаков, 2005, с. 145.
- Ермаков, 2005, с. 146.
- Carbonera D., Agostini G., Morosinotto T., Bassi R. Quenching of chlorophyll triplet states by carotenoids in reconstituted Lhca4 subunit of peripheral light-harvesting complex of photosystem I (англ.) // Biochemistry : journal. — 2005. — June (vol. 44, no. 23). — P. 8337—8346. — PMID 15938623.
- Luciński R., Jackowski G. AtFtsH heterocomplex-mediated degradation of apoproteins of the major light harvesting complex of photosystem II (LHCII) in response to stresses (англ.) // J Plant Physiol. : journal. — 2013. — August (vol. 170, no. 12). — P. 1082—1089. — doi:10.1016/j.jplph.2013.03.008. — PMID 23598180.
- Yin Lan. Molecular mechanisms optimizing photosynthesis during high light stress in plants (англ.) // University of Gothenburg. Faculty of Science : journal. — 2014-04-28. — P. 178—182.
- Peter J. Nixon, Myles Barker, Marko Boehm, Remco de Vries and Josef Komenda. FtsH-mediated repair of the photosystem II complex in response to light stress (англ.) : journal. — 2005. — January (vol. 56, no. 411). — P. 178—182.
- Ермаков, 2005, с. 123.
- Lecture: Inhibition of Photosynthesis, Inhibition at Photosystem II
- Herbicide symptoms: Photosystem II Inhibitors
- Dr. Hubert Menne. Classification of Herbicides According to Site of Action (англ.). Herbicide Resistance Action Committee.
Литература
- Зитте П. и др. Ботаника / Под ред. В. В. Чуба. — 35-е изд. — М.: Академия, 2008. — Т. 2. Физиология растений. — 495 с.
- Медведев С. С. Физиология растений. — СПб.: БХВ-Петербург, 2013. — 335 с.
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
- Хелдт Г. В. Биохимия растений. — М.: БИНОМ. Лаборатория знаний, 2011. — 471 с.
Ссылки
- Информационная система «Фотосинтетическая мембрана»
- «Циклический и нециклический поток электронов.» в онлайн энциклопедии Физиология растений