П680
П680 (P680, пигмент 680) или первичный донор фотосистемы II — димер из двух молекул хлорофилла а, П1 и П2, которые также называют специальной парой[1]. Вместе две эти молекулы образуют экситонный димер, то есть они функционально представляют собой единую систему и при возбуждении ведут себя как одна молекула. Максимум поглощения энергии света такой специальной пары приходится на длину волны λ = 680 нм. Первичный донор возбуждается, поглощая фотоны с подходящей длиной волны или через перенос энергии возбуждения от других хлорофиллов фотосистемы II. П680 поглощает квант света и переходит в фотовозбуждённое состояние, в результате чего один из его электронов переходит на более высокий энергетический уровень — с основного подуровня S0 на первый синглетный подуровень S1. Этот электрон отрывается от специальной пары и захватывается первичным акцептором электрона, феофитином, который расположен внутри фотосистемы II рядом с П680. Процесс отщепления электрона от специальной пары и переходе его на феофитин с образованием радикальной пары носит название разделения зарядов. Окисленный П680+ восстанавливается, захватывая электрон от водоокисляющего комплекса фотосистемы II.
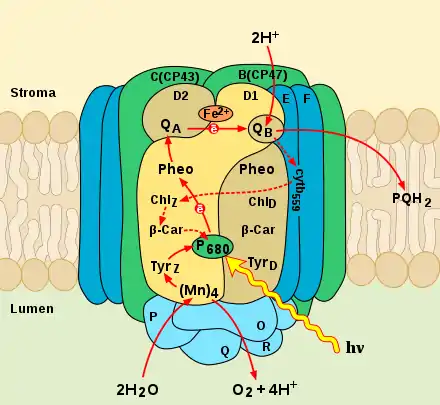
П680+ — сильнейшей биологический окислитель. Его окислительно-восстановительный потенциал составляет приблизительно +1,3 В[2] (по другим данным +1,12 В[1]). Это позволяет ему индуцировать процесс окисления воды, окислительно-восстановительный потенциал которой +0,8 В. В то же время редокс-потенциал фотовозбуждённого П680 находится в отрицательной области (менее −0,6 В).
Фотосистема II, так же как и реакционный центр пурпурных бактерий, асимметрична, и две молекулы в димере не эквивалентны. Одна молекула хлорофилла а (П1) образует водородные связи с аминокислотами белка D1 при помощи кетоэфирных групп в положениях C9 и C10, а вторая молекула хлорофилла а (П2) образует только одну водородную связь. Поскольку П1 образует большее число водородных связей, его редокс-потенциал выше и электрондвижущая сила больше. В момент возбуждения димера электрон переходит от П2 к молекуле хлорофилла П1, и образуется диполь. Из-за возникновения локального электрического поля происходит изменение конформации специальной пары, что облегчает дальнейший перенос электрона на феофитин, а положительный заряд локализуется на одном из хлорофиллов[3].
В отличие от специальной пары фотосистемы I (П700) и пары бактериофиллов (П870) в фотосистеме пурпурных бактерий, в П680 хлорофиллы находятся на значительно большем расстоянии (5,2 Å против 3,6 Å в П700 и 3,5 Å в П870), а их плоскости несколько наклонены относительно друг друга, что значительно снижает энергию экситонного сопряжения и замедляет скорость захвата энергии света, что в свою очередь делает более медленным процесс разделения зарядов на паре хлорофиллов. Низкая скорость захвата энергии позволяет регулировать уровни возбуждения в антенне ФСII, что защищает реакционный центр от фотоингибирования[4].
Реакционный центр фотосистемы II в термодинамическом отношении намного эффективней реакционного центра пурпурных бактерий. В ФСII квант при 680 нм (1‚84 эВ) используется для фотоиндуцированного разделения зарядов с образованием стабильной радикальной пары П680+ — Фео−, Редокс-потенциал П680+ равен +1,12 B, потенциал Фео составляет −0‚13 B. Таким образом, из энергии поглощенного фотона 1,84 эВ в стабильной радикальной паре сохраняется 1,25 эВ, то есть эффективность составляет 68 %. Для реакционного центра ФСI эта величина составляет 58 %. У пурпурных бактерий фотоны с энергией 1,44 эВ (870 нм) продуцируют стабильную радикальную пару П680+ — QA−, которой соответствует энергия 0,5 эВ, то есть эффективность процесса равна 35 %[5].
Таким образом, реакционный центр ФСII эволюционировал так, что его эффективность разделения зарядов оказалась вдвое выше по сравнению с реакционным центром пурпурных бактерий. Следовательно, эволюция стратегии слабого сопряжения создает значительное преимущество в эффективности фотохимического преобразования энергии в реакционных центрах оксигенных систем[5].
См. также
Примечания
- Grzegorz Raszewski, Bruce A. Diner, Eberhard Schlodder and Thomas Renger. Spectroscopic properties of reaction center pigments in photosystem II core complexes: Revision of the multimer model (англ.) // Biophysical Journal. — 2008. — Vol. 95. — P. 105—119. — doi:10.1529/biophysj.107.123935.
- Rappaport F., Guergova-Kuras M., Nixon P.J., Diner B.A. and Lavergne J. Kinetics and pathways of charge recombination in photosystem II (англ.) // Biochemistry. — 2002. — Vol. 41. — P. 8518—8527. — doi:10.1021/bi025725p. — PMID 12081503.
- Rutherford A.W., Faller P. Photosystem II: evolutionary perspectives (англ.) // Philosophical Transactions of the Royal Society of London. Series B: Biological Sciences. — 2003. — 29 January (vol. 358, no. 1429). — P. 245—253. — doi:10.1098/rstb.2002.1186. — PMID 12594932.
- Ермаков, 2005, с. 161.
- Ермаков, 2005, с. 163.
Литература
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.