Фотосистема I
Фотосисте́ма I (первая фотосистема, фотосистема один, ФСI), или пластоциани́н-ферредокси́н-оксидоредукта́за — второй функциональный комплекс электрон-транспортной цепи (ЭТЦ) хлоропластов. Он принимает электрон от пластоцианина и, поглощая световую энергию, формирует сильный восстановитель П700, способный через цепь переносчиков электронов осуществить восстановление НАДФ+. Таким образом, при участии ФСI синтезируется источник электронов (НАДФН) для последующих реакций восстановления углерода в хлоропластах в цикле Кальвина. Кроме того, ФСI может осуществлять циклический транспорт электронов, сопряжённый с синтезом АТФ, обеспечивая дополнительный синтез АТФ в хлоропластах[1].
История открытия
Нециклический транспорт электронов начинается с того, что марганцевый кластер фотосистемы II окисляет воду, восстанавливая пул пластохинонов. Далее цитохром b6f-комплекс окисляет пластохиноны, а электрон через пластоцианин передаётся на фотосистему I, где используется для синтеза НАДФН. Нарушение формальной логики в названиях фотосистем связано с тем, что фотосистема I была открыта раньше, чем фотосистема II.
Первые данные указывающие на существование ФСI появились в 1950-х годах, но в то время никто ещё не мог оценить значимость этих открытий[2]. Представление о существовании в хлоропластах двух фотосистем возникло в уже в 1940-е годы на основание опытов лаборатории Р. Эмерсона, обнаружившего эффект падения квантового выхода фотосинтеза при освещении хлоропластов монохроматическим красным светом (λ>680 нм), возбуждающим только ФСI, и эффект усиления квантового выхода при добавлении подсветки с длиной волны около 650 нм, которая возбуждала ФСII (так называемый эффект Эмерсона). Также следует упомянуть открытый Комоннером в 1956 году светоиндуцируемый ЭПР сигнал, который был назван сигналом I. По чистой случайности сигнал I и сигнал II, исходили от ФСI и ФСII соответственно[2]. Лишь в 1960 году Луис Дюйзенс предложил концепцию фотосистемы I и фотосистемы II, и в том же году Фэй Бендалл и Роберт Хилл организовали результаты предыдущих открытий в стройную теорию последовательных реакций фотосинтеза[2]. Гипотеза Хилла и Бендалля была позднее подтверждена в экспериментах Дюйзенса и Витта в 1961 году[2].
После этого начались систематические попытки физического выделения фотосистемы I, определения её трёхмерной структуры и тонкого строения. В 1966 году начался бум исследований в этой области: Андерсон и Бордман подвергали мембраны хлоропластов воздействию ультразвука с последующей обработкой дигитонином, Вернон использовал тритон X-100, а Огава — додецилсульфат. Однако, первые полученные экстракты содержали примеси светосособирающих комплексов, а также цитохромов f и b6. Потребовалось много времени, чтобы разобраться, что полученные экстракты были смесью[2].
В 1968 году Рид и Клайтон смогли выделить реакционный центр фотосистемы I из пурпурных бактерий, что значительно подстегнуло исследования оксигенного фотосинтеза. Однако, открытым оставался вопрос: что из выделенного являлось истинным реакционным центром, что антенными комплексами, а что дополнительными субъединицами. Долгое время эффективное выделение реакционного центра фотосистемы I оставалось неразрешённой проблемой. В конце-концов оказалось, что легче всего это сделать у цианобактерий, поскольку у них отсутствовали интегрированные в мембрану внешние антенны. После многочисленных попыток с разными видами, выяснилось, что самыми многообещающими в этом отношение видами являются представителями Synechocystis и Synechococcus, поскольку фотосистема I, выделенная из Thermosynechococcus elongatus давала очень стабильный реакционный центр, пригодный для кристаллизации и исследования методом рентгеноструктурного анализ[2].
Отличия от фотосистемы II
Основная функция фотосистемы II — генерация сильного окислителя, который инициирует окисление воды и передачу её электронов на мембранный переносчик. Основная функция фотосистемы I — насытить эти низкоуровневые электроны энергией, чтобы с их помощью осуществить восстановление НАДФ+. Поскольку энергия суммарного процесса слишком велика, чтобы осуществить его в рамках одного реакционного центра, в ходе эволюции появились две фотосистемы, которые раздельно осуществляют разные части этой реакции. Их специфические функции и определяют особенности их строения. Так, фотосистема I — симметрична, то есть в ней работают две ветви электронного транспорта, что делает его значительно более быстрым, в то время как фотосистема II — асимметрична и обладает только одной рабочей ветвью, что замедляет транспорт электронов, но делает его более управляемым. Обе фотосистемы значительно отличаются по строению антенн, дополнительных субъединиц, способов регуляции и своему положению в мембране[3]. Так, фотосистема I обладает интегральной антенной, хлорофиллы которой расположены непосредственно на главных белках комплекса — А и B, в то время как у фотосистемы II они вынесены на внешние белки CP47 и CP43. По количеству дополнительных малых регуляторных субъединиц ФС II значительно превосходит ФС I, что связано с необходимостью тонкой регуляции процесса окисления воды, который потенциально крайне опасен для клетки. Этим же объясняется неоднородное распределение фотосистем в мембране тилакоида: в то время как ФС I располагается преимущественно в области маргинальных, торцевых и стромальных мембран, ФС II практически полностью находится в области спаренных мембран, что обеспечивает клетке дополнительную защиту от продуцируемых ею активных форм кислорода[4].
Главное отличие фотосистемы II от фотосистемы I — это наличие большого обращённого в люмен домена, который содержит марганцевый кластер и окружающие его защитные белки. Именно здесь происходит процесс фотохимического окисления воды, сопровождаемый выделением кислорода и протонов[3].
Структурная организация фотосистемы I
| Фотосистема I | |
|---|---|
 Растительная Фотосистема I | |
| Идентификаторы | |
| Шифр КФ | 1.97.1.12 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| PsaA_PsaB | |
|---|---|
 Структура Фотосистемы I из цианобактерии. Показана интегральная часть(ядро) и белки внешней антенны. | |
| Идентификаторы | |
| Символ | PsaA_PsaB |
| Pfam | PF00223 |
| InterPro | IPR001280 |
| PROSITE | PDOC00347 |
| SCOP | 1jb0 |
| SUPERFAMILY | 1jb0 |
| TCDB | 5.B.4 |
| OPM superfamily | 2 |
| OPM protein | 1jb0 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
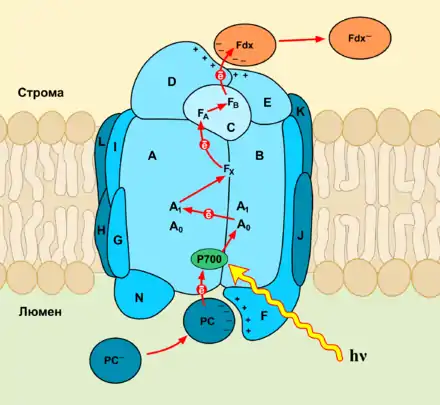
Фотосистема I состоит из следующих белковых субъединиц и кофакторов[5][6][1]:
| Субъединицы | Описание |
|---|---|
| A | 83 кДа, 751 аминокислотных остатков |
| B | 82,5 кДа, 735 аминокислотных остатков |
| C | 8,9 кДа, перенос электрона с П700 на ферредоксин |
| D | 19 кДа, обеспечивает связь с ферредоксином |
| E | 7,5 кДа, обеспечивает связь с ферредоксином |
| F | 19 кДа, взаимодействует с пластоцианином |
| G | 8 кДа, только у растений |
| H | 10 кДа, у растений предотвращает формирования тримеров ФСI, обеспечивает взаимодействие со светособирающим комплексом II |
| I | 5 кДа, у растений взаимодействует с PsaH, связывается со светособирающим комплексом II; у цианобактерий играет важную роль в формировании тримеров ФСI |
| J | 5 кДа, несёт три молекулы хлорофилла и выполняет структурную функцию |
| K | 8.5 кДа, несёт две молекулы хлорофилла и выполняет структурную функцию |
| L | 16 кДа, у цианобактерий участвуют в формировании тримера ФСI; у растений она связывает со светособирающим комплексом II |
| M | 3,5 кДа, только у цианобактерий; расположена в области контакта ФСI в тримере |
| N | 9 кДа, есть у растений и водорослей |
| O | только у растений; функция неизвестна |
| X | 4 кДа, только у цианобактерий |
| Пигменты | |
| Хлорофилл a | 95 молекул в антенной системе |
| Хлорофилл а | 2 молекулы дополнительного хлорофилла а |
| Хлорофилл a0 | Хлорофилл а695 — первичный акцептор электронов |
| Хлорофиллы а и a' | специальная пара П700 |
| β-Каротин | 22 молекулы |
| Коферменты/Кофакторы | |
| Fa | Fe4S4 железосерный кластер (ЭТЦ) |
| Fb | Fe4S4 железосерный кластер (ЭТЦ) |
| Fx | Fe4S4 железосерный кластер (ЭТЦ) |
| Ферредоксин | Переносчик электронов |
| Пластоцианин | Растворимый белок, содержащий атом меди |
| QK-A | Филлохинон — акцептор электронов в ЭТЦ (субъединица А) |
| QK-B | Филлохинон — акцептор электронов в ЭТЦ (субъединица В) |
| Ca2+ | ион кальция |
| Mg2+ | ион магния |
Основная функция ФСI — передача энергии света на электрон, перенос электрона от пластоцианина к ферредоксину[7]. ФСI содержит свыше 110 кофакторов, значительно больше чем фотосистема II[8]. Каждый из этих компонентов имеет широкий спектр функций. Основные компоненты электрон-транспортной цепи ФСI — главный донор возбуждённых электронов П700 (хлорофильный димер) и пять переносчиков: A0 (хлорофилл а), A1 (филлохинон) и три Fe4S4 железосерных кластера: Fx, Fa, и Fb[9].
Структурно ФСI представляет собой гетеродимер двух интегральных белковых комплексов — А и В (у всех растений кодируются хлоропластными генами PsaA и PsaB). Белки А и В присоединяют димер Р700, по одной молекуле мономера хлорофилла а (Хл695) — первичного акцептора электронов А0, по одному дополнительному хлорофиллу а и по одной молекуле филлохинона (А1). Два набора дополнительных хлорофиллов а, первичных акцепторов электрона и филлохинонов формируют две почти симметричные ветви транспорта электронов от Р700 к Fx. В отличие от реакционных центров зелёных и пурпурных бактерий и ФСII, где из двух ветвей функционирует лишь одна, в ФСI активны обе ветви электронного транспорта, хотя они и не идентичны[1].Белок А гомологичен белкам D1+СP43 (молекулярная масса белка А соответствует сумме молекулярных масс белков D1 и СP43) из фотосистемы II, а белок В гомологичен белкам D2+CP47 соответственно[10].
Обе субъединицы содержат 11 трансмембранных сегментов. Железосодержащий кластер Fx связан четырьмя цистеинами, два из которых находятся на субъединице А, и ещё два на субъединице В. В обоих белках цистеины находятся на проксимальном конце, в петле между девятым и десятым трансмембранными сегментами. По всей вероятности, ниже цистеинов находится так называемый мотив лейциновой молнии, который вносит существенный вклад в димеризацию белков А и В[11]. Конечные акцепторы электронов FA и FB находятся на субъединице С[12][13].
Следует особо подчеркнуть, что перенос электрона осуществляется в соответствии с термодинамическим потенциалом. Увеличение окислительно-восстановительных потенциалов в цепи акцепторов обеспечивает быстрое снижение энергии, что предотвращает возврат электрона к пигменту и бесполезную трату энергии электронного возбуждения. Благодаря этому энергия возбуждения эффективно используется для разделения зарядов[14].
Пластоцианин
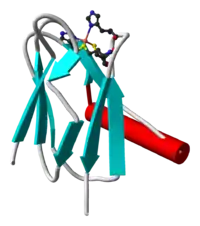
Пластоцианин — маленький, подвижный белок с молекулярной массой около 10,5 кДа. К его центральному атому Сu присоединяются остатки цистеина и метионина, а сбоку его стабилизируют два остатка гистидина. При обратимой смене валентности Cu2+ ↔ Cu+1 пластоцианин либо поглощает один электрон, либо отдаёт его. Пластоцианин является аналогом цитохрома c, который выполняет схожую функцию в дыхательной цепи митохондрий[6].
Он принимает электрон от цитохром b6f-комплекса, окисляя цитохром f и перенося его непосредственно на реакционный центр П700 фотосистемы I. На внешней стороне белка имеется группа аминокислот, несущих отрицательный заряд[16]. Предположительно, они связываются с положительно заряженным люминальным доменом субъединицы F, однако механизм связывания недостаточно изучен и остаётся неясным[17].
У некоторых водорослей и цианобактерий при недостатке меди в среде пластоцианин не образуется, вместо него синтезируется и выполняет его функции цитохром c-553[18].
- Пластоцианин (PC) отдаёт один электрон окисленному П700+ и восстанавливает его до исходного состояния:
Специальная пара П700
П700 (в английской литературе P700) представляет собой димер хлорофилла а и хлорофилла а‘ у которого кетоэфирная группа в V кольце находится в цис-положении относительно плоскости молекулы, с максимумом поглощения 700 нм[19]. Наличие цис-кетоэфирной группы делает возможным образование димера из двух хлорофиллов посредством формирования водородных связей. П700 получает энергию от антенных комплексов и использует её, чтобы поднять электроны на более высокий уровень. Далее электрон в ходе окислительно-восстановительной реакции переходит на цепь переносчиков. В окисленном состоянии окислительно-восстановительный редокс-потенциал П700 составляет +0,52 В, а в фотовозбуждённом состоянии он становится −1,2 В, то есть формируется мощный восстановитель, обеспечивающий восстановление НАДФ+[20][21].
- В соответствии со следующим уравнением П700 поглощает квант света и переходит в фотовозбуждённое состояние, в результате чего один из его электронов переходит с основного подуровня S0 на первый синглетный подуровень S1:
Хлорофилл А0
A0 — первый акцептор электронов в фотосистеме I. Именно здесь происходит первичное фотохимическое разделение зарядов между фотовозбуждённым П700* и A0. Его максимум поглощения составляет 695 нм (Хл а695), что объясняется его взаимодействием с окружающими аминокислотными остатками[19]. Его редокс-потенциал в восстановленном состоянии −1,1 В[1].
- Фотовозбуждённый П700* отдаёт один электрон хлорофиллу A0, в результате чего происходит разделение зарядов, и образуется первичная радикальная пара:
Филлохинон A1
Следующий акцептор — это Филлохинон A1, также известный как витамин K1. Он, как и хлорофилл, обладает фитольным хвостом[22], и приблизительно соответствует пластохинону QA фотосистемы II. Поглощая электрон, он образует семихинон-радикал, который восстанавливает Fx, передаёт его на Fb и далее на Fa[22][23].
Железосерные кластеры
Железосерные кластеры ФСI имеют форму куба с четырьмя атомами железа и четырьмя атомами серы, составляющими его восемь вершин. Все три кластера связаны с белками ФСI через остатки цистеина[24]. Fx (Eо‘ = −0,70 В) окисляет восстановленный А1. Дальнейший транспорт осуществляют железосерные кластеры Fa, и Fb, характеризующиеся низкими окислительно-восстановительными потенциалами (-0,59 и −0,55 В соответственно). Множество экспериментов выявило несоответствие между разными теориями, описывающими расположение и работу железосерных кластеров[24]. Однако большинство результатов позволяет сделать некоторые общие выводы. Во-первых, Fx, Fa, и Fb образуют треугольник, и Fa располагается ближе к Fx чем Fb[24]. Во-вторых, транспорт электронов начинается с Fx через Fa к Fb, или же через Fa к Fb. До сих пор ведутся споры о том, какой из двух кластеров осуществляет перенос электрона на ферредоксин[24].
Ферредоксин
Ферредоксин — это водорастворимый белок с молекулярной массой 11 кДа и содержащий Fe2S2 центр[25]. Примечательно, что он является одноэлектронной окислительно-восстановительной системой, то есть переносит только один электрон, полученный им от железосерных кластеров. Он восстанавливается ФСI на стромальной стороне мембраны и в восстановленном состоянии является сильным восстановителем (Eo‘ = —0,6 В), благодаря чему может быть переносчиком электронов для различных реакций, протекающих в хлоропласте. Так, ферредоксин поставляет электроны для восстановления нитритов, (нитритредуктаза) и ассимиляции серы (сульфитредуктаза) в хлоропласте. Также он поставляет электроны для фиксации атмосферного азота (нитрогеназа) у бактерий. Он восстанавливает тиоредоксин — низкомолекулярный серосодержащий белок, участвующий в редокс-регуляции хлоропластов, активируя ключевые ферменты цикла Кальвина. При нециклическом транспорте электронов ферредоксин взаимодействует с ферредоксин-НАДФ(+) редуктазой, которая восстанавливает НАДФ+ до НАДФН (Eo‘ = −0,32 В) в строме хлоропласта[25].
Светособирающий комплекс
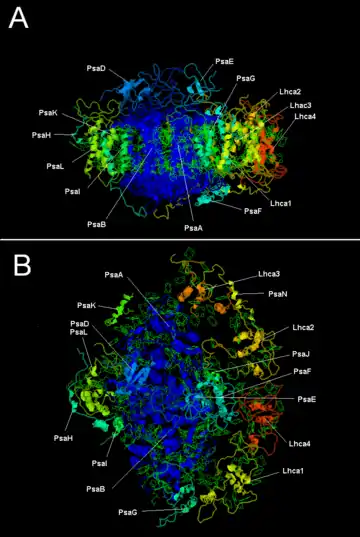
Светособирающие комплексы состоят из молекул хлорофилла а и b и каротиноидов, соединённых с белками[20]. Эти пигменты, возбуждаясь, переносят энергию фотонов в реакционный центр фотосистемы по Фёрстеровскому механизму. В отличие от реакционного центра ФСI, светособирающие комплексы могут поглощать практически во всей области видимого спектра[26]. Антенные комплексы подразделяют на внутренние, или интегральные, антенны, непосредственно присоединённые к комплексу фотосистемы, и периферические подвижные светособирающие комплексы (ССКI). Так, белки А и В присоединяют пигменты внутренней антенны ФСI: около 95 молекул хлорофилла а и 22 молекулы β-каротина, 5 из которых находятся в цис-конформации. В координации по крайней мере десяти хлорофиллов внутренней антенны принимают участие малые субъединицы J, K, L, M и X. Пигменты внутренней антенны располагаются в виде цилиндра, окружающего все компоненты электрон-транспортной цепи фотосистемы I. Это отличает ФСI от ФСII, где пигменты внутренней антенны расположены на отдельных белках CP43 и CP77[1]. Внешний светособирающий комплекс ССКI (LHCI) содержит 80—120 молекул хлорофиллов а и b, каротиноиды и состоит из четырёх субъединиц: Lhca1, Lhca2, Lhca3 и Lhca4 — с молекулярными массами 17—24 кДа. Относительно недавно были открыты две дополнительные субъединицы, Lhca5 и Lhca6, однако их концентрация в мембране тилакоида крайне мала, а кодирующие их гены практически не экспрессируются[27][28].
Циклический транспорт электронов
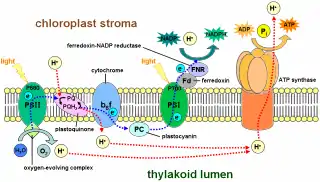
При слишком сильном освещении и/или закрытых устьицах (голодание по СО2) происходит перевосстановление пула пластохинонов и, как следствие, перевосстановление пула НАДФ+. При недостатке СО2 НАДФН не может расходоваться в цикле Кальвина, а значит, не хватает субстрата для ферредоксин-НАДФ+-редуктазы. В конечном итоге это приводит к тому, что ФСI становится некуда сбрасывать возбуждённые электроны, а это в свою очередь может привести к повреждению фотосинтетического аппарата, окислению мембран и образованию активных форм кислорода[6]. В этих условиях, чтобы предотвратить окислительный стресс и защититься от фотоповреждения, растения переходят к циклическому транспорту электронов. Полагают, что катализатором циклического транспорта является восстановленный ферредоксин[29][30].
Циклическое фотофосфорилирование
Вначале электрон неким образом перемещается от восстановленного ферредоксина на пул пластохинонов. Точный механизм этого процесса не известен. Полагают, что эту реакцию осуществляет особый фермент — ферредоксин-пластохинон-оксидоредуктаза. Затем от пластохинона через цитохром b6f-комплекс и пластоцианин электрон вновь попадает на ФСI. При этом происходит закачка протона в полость тилакоида и идёт синтез АТФ. В качестве наиболее вероятного кандидата на роль ферредоксин-пластохинон-оксидоредуктазы в последнее время рассматривают ферредоксин-НАДФ+-редуктазу, которая может образовывать комплекс с цитохром-b6f-комплексом. Предположительно она может переносить электроны с ферредоксины напрямую на убихинон, связанный цитохром-b6f-комплексом через специальный гем cn[31][32]. Большое количество данных также говорит в пользу образования суперкомплекса из цитохром-b6f-комплекса, ФСI, ферредоксин-НАДФ+-редуктазы и трансмембранного белка PGRL1. Образование и распад такого комплекса, как полагают, переключает режим потока электрона с нециклического на циклический и обратно[33][34].
Ещё один фермент, возможно принимающей участие а этом процесс — это НАДН-дегидрогеназный комплекс хлоропластов, аналогичный НАДH-дегидрогеназному комплексу митохондрий и гомологичный бактериальному комплексу I[35][36]. Он окисляет ферредоксин и сбрасывает электроны на пластохинон, предотвращая окислительный стресс. НАДН-дегидрогеназный комплекс хлоропластов образует суперкомплекс с двумя ФСI при помощи белков Lhca5 и Lhca6[28]. Протонный градиент, созданный в результате циклического фотофосфорилирования на мембране тилакоида, используется белками-переносчиками для встраивания в мембрану приходящих из стромы белков[37][38].
Псевдоциклический транспорт
При очень активном восстановлении пула ферредоксинов происходит сброс их электронов на О2 с образованием H2O (так называемая реакция Мелера). Он сходен с циклическим транспортом тем, что не синтезируется НАДФН, а только АТФ. Однако в условиях реакции Мелера соотношение АТФ/АДФ очень велико, так что имеющегося количества АДФ не достаточно для синтеза АТФ, и, как следствие, на мембране тилакоида создаётся очень высокий протонный градиент. В результате реакции происходит образование супероксид-анион-радикала O2-·, который превращается в O2 и H2O2 под воздействием фермента супероксиддисмутазы, а перекись превращается в воду ферментом аскорбатпероксидазой[6].
Ещё один фермент, участвующий в псевдоциклическом транспорте, это терминальная оксидаза хлоропластов, гомологичная альтернативной оксидазе растительных митохондрий. Она окисляет пул пластохинонов с участием кислорода, образуя воду и рассеивая энергию в форме тепла[39].
Локализация в мембране тилакоида
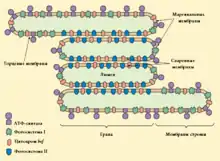
Фотосистема I находится в стромальных тилакоидах (32 %), а также в маргинальных (36 %) и торцевых (32 %) областях гран. Такое расположение обусловлено плотностью её поверхностного заряда и силами электростатического отталкивания с другими комплексами[40].
У цианобактерий и прохлорофитов фотосистема I способна образовывать тримеры. Это способствует увеличению спектра поглощения на больших глубинах, а также более эффективному перераспределению энергии возбуждения и защите от фотоповреждений[41]. У эукариот фотосистема I утратила эту способность благодаря наличию субъединицы H, а также мутации в субъединице L. Вместо тримерезации у эукариот она при помощи субъединиц L и G взаимодействует с большими мембранными светособирающими комплексами, которых нет у прокариот[42].
Белок Ycf4
Трансмембранный белок Ycf4, обнаруженный в мембране тилакоида, жизненно необходим для функционирования фотосистемы I. Он участвует в сборке компонентов комплекса, без него фотосинтез становится неэффективным[43].
Зелёные серобактерии и эволюция ФСI
Молекулярно-биологические данные говорят в пользу того, что ФСI, вероятно, эволюционировала из фотосистемы зелёных серобактерий. Реакционные центры зелёных серобактерий, цианобактерий, водорослей и высших растений различаются, однако домены, выполняющие аналогичные функции, имеют схожее строение[44]. Так, во всех трёх системах окислительно-восстановительный потенциал достаточен для восстановления ферредоксина[44]. Все три электронотранспортные цепи содержат железо-серные белки[44]. И наконец, все три фотосистемы представляют собой димер двух гидрофобных белков, на которых закреплены редокс-центры и пигменты интегральной антенны[44]. В свою очередь, фотосистема зелёных серобактерий содержит те же самые кофакторы, что и электронотранспортная цепь фотосистемы I[44].
Галерея
 Положение хлорофиллов и кофакторов в фотосистеме I.
Положение хлорофиллов и кофакторов в фотосистеме I. Тример фотосистемы I
Тример фотосистемы I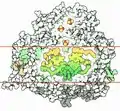 ЭТЦ фотосистемы I
ЭТЦ фотосистемы I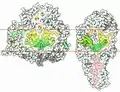 Фотосистемы I и реакционный центр бактерии.
Фотосистемы I и реакционный центр бактерии.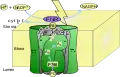 Модель фотосистемы I.
Модель фотосистемы I.
Примечания
- Ермаков, 2005, с. 173-175.
- Fromme P., Mathis P. Unraveling the photosystem I reaction center: a history, or the sum of many efforts (англ.) // Drugs : journal. — Adis International, 2004. — Vol. 80, no. 1—3. — P. 109—124. — doi:10.1023/B:PRES.0000030657.88242.e1. — PMID 16328814. Архивировано 22 декабря 2015 года.
- Ермаков, 2005, с. 121.
- Ravi Danielsson, Marjaana Suorsa, Virpi Paakkarinen, Per-Åke Albertsson, Stenbjörn Styring, Eva-Mari Aro and Fikret Mamedov. Dimeric and Monomeric Organization of Photosystem II (англ.) // The Journal of Biological Chemistry : journal. — 2006. — May (no. 281). — P. 14241—14249. — doi:10.1074/jbc.M600634200.
- Saenger W., Jordan P., Krauss N. The assembly of protein subunits and cofactors in photosystem I (англ.) // Curr. Opin. Struct. Biol. : journal. — 2002. — April (vol. 12, no. 2). — P. 244—254. — doi:10.1016/S0959-440X(02)00317-2. — PMID 11959504.
- Страсбургер, 2008, с. 117.
- Golbeck J.H. Structure, function and organization of the Photosystem I reaction center complex (англ.) // Biochim. Biophys. Acta : journal. — 1987. — Vol. 895, no. 3. — P. 167—204. — doi:10.1016/s0304-4173(87)80002-2. — PMID 3333014.
- HongQi Yu', Ingo Gortjohann, Yana Bukman, Craig Yolley', Devendra K. Chauhan, Alexander Melkozerov and Petra Fromme. Structure and funcnions of photosystems I and II (неопр.).
- Jagannathan, Bharat; Golbeck, John. Photosynthesis:Microbial (англ.) // Encyclopedia of Microbiology, 3rd Ed : book. — 2009. — P. 325—341. — doi:10.1016/B978-012373944-5.00352-7.
- Хелдт, 2011, с. 99.
- Webber A.N., Malkin R. Photosystem I reaction-centre proteins contain leucine zipper motifs. A proposed role in dimer formation (англ.) // FEBS Lett. : journal. — 1990. — May (vol. 264, no. 1). — P. 1—4. — doi:10.1016/0014-5793(90)80749-9. — PMID 2186925.
- Jagannathan, Bharat; Golbeck, John. Breaking biological symmetry in membrane proteins: The asymmetrical orientation of PsaC on the pseudo-C2 symmetric Photosystem I core (англ.) // Cell. Mol. Life Sci. : journal. — 2009. — Vol. 66, no. 7. — P. 1257—1270. — doi:10.1007/s00018-009-8673-x.
- Jagannathan, Bharat; Golbeck, John. Understanding of the Binding Interface between PsaC and the PsaA/PsaB Heterodimer in Photosystem I (англ.) // Biochemistry : journal. — 2009. — Vol. 48. — P. 5405—5416. — doi:10.1021/bi900243f.
- Ермаков, 2005, с. 157.
- PDB 3BQV.
- Frazão C., Sieker L., Sheldrick G., Lamzin V., LeGall J., Carrondo M.A. Ab initio structure solution of a dimeric cytochrome c3 from Desulfovibrio gigas containing disulfide bridges (англ.) // J. Biol. Inorg. Chem. : journal. — 1999. — April (vol. 4, no. 2). — P. 162—165. — doi:10.1007/s007750050299. — PMID 10499086. Архивировано 15 октября 2000 года.
- Hope A.B. Electron transfers amongst cytochrome f, plastocyanin and photosystem I: kinetics and mechanisms (англ.) // Biochim. Biophys. Acta : journal. — 2000. — January (vol. 1456, no. 1). — P. 5—26. — doi:10.1016/S0005-2728(99)00101-2. — PMID 10611452.
- Zhang L1, McSpadden B., Pakrasi H.B., Whitmarsh J. Copper-mediated regulation of cytochrome c553 and plastocyanin in the cyanobacterium Synechocystis 6803 (англ.) // The journal of biological chemistry : journal. — 1992. — September (vol. 267, no. 27). — P. 19054—19059. — PMID 1326543.
- Rutherford A.W., Heathcote P. Primary Photochemistry in Photosystem-I (англ.) // Drugs. — Adis International, 1985. — Vol. 6, no. 4. — P. 295—316. — doi:10.1007/BF00054105.
- Zeiger, Eduardo; Taiz, Lincoln. Ch. 7: Topic 7.8: Photosystem I // Plant physiology (неопр.). — 4th. — Sunderland, Mass: Sinauer Associates, 2006. — ISBN 0-87893-856-7.
- Shubin V.V., Karapetyan N.V., Krasnovsky A.A. Molecular Arrangement of Pigment-Protein Complex of Photosystem I (англ.) // Drugs : journal. — Adis International, 1986. — Vol. 9, no. 1—2. — P. 3—12. — doi:10.1007/BF00029726.
- Itoh, Shigeru, Msayo Iwaki. Vitamin K1 (Phylloquinone) Restores the Turnover of FeS centers of Ether-extracted Spinach PS I Particles (англ.) // FEBS Lett. : journal. — 1989. — Vol. 243, no. 1. — P. 47—52. — doi:10.1016/0014-5793(89)81215-3.
- Palace G.P., Franke J.E., Warden J.T. Is phylloquinone an obligate electron carrier in photosystem I? (англ.) // FEBS Lett. : journal. — 1987. — May (vol. 215, no. 1). — P. 58—62. — doi:10.1016/0014-5793(87)80113-8. — PMID 3552735.
- Vassiliev I.R., Antonkine M.L., Golbeck J.H. Iron-sulfur clusters in type I reaction centers (англ.) // Biochim. Biophys. Acta : journal. — 2001. — October (vol. 1507, no. 1—3). — P. 139—160. — doi:10.1016/S0005-2728(01)00197-9. — PMID 11687212.
- Forti, Georgio, Paola Maria Giovanna Grubas. Two Sites of Interaction of Ferredoxin with thylakoids (англ.) // FEBS Lett. : journal. — 1985. — Vol. 186, no. 2. — P. 149—152. — doi:10.1016/0014-5793(85)80698-0.
- «The Photosynthetic Process» Архивированная копия. Дата обращения: 5 мая 2009. Архивировано 19 февраля 2009 года.
- Robert Lucinski, Volkmar H.R. Schmid, Stefan Jansson, Frank Klimmek. Lhca5 interaction with plant photosystem I (англ.) // FEBS letters : journal. — 2006. — Vol. 580, no. 27. — P. 6485—6488. — doi:10.1016/j.febslet.2006.10.063.
- Lianwei Peng, Hiroshi Yamamoto, Toshiharu Shikanai. Structure and biogenesis of the chloroplast NAD(P)H dehydrogenase complex (англ.) // Biochimica et Biophysica Acta (BBA) : journal. — 2011. — Vol. 1807, no. 8. — P. 945—953. — doi:10.1016/j.bbabio.2010.10.015.
- Кренделева Т. Е., Кукарских Г. П., Тимофеев К. Н., Иванов Б. Н., Рубин А. Б. Ферредоксинзависимый циклический транспорт электронов в изолированных тилакоидах протекает с участием ферредоксин-НАДФ-редуктазы. Доклады академии наук, 2001. 379(5): с. 1-4.
- Коваленко И.Б., Устинин Д.М., Грачев Н.Е., Кренделева Т.Е., Кукарских Г.П., Тимофеев К.Н., Ризниченко Г.Ю., Грачев Е.А., Рубин А.Б. Экспериментальное и теоретическое исследование процессов циклического электронного транспорта вокруг фотосистемы 1 // Биофизика : журнал. — 2003. — Т. 48, № 4. — С. 656—665.
- Cramer WA.; Zhang H.; Yan j.; Kurisu G.; Smith JL. Transmembrane traffic in the cytochrome b6f complex (англ.) // Annu Rev Biochem : journal. — 2006. — Vol. 75. — P. 769—790. — doi:10.1146/annurev.biochem.75.103004.142756. — PMID 16756511.
- Cramer WA.; Yan J.; Zhang H.; Kurisu G.; Smith JL. Structure of the cytochrome b6f complex: new prosthetic groups, Q-space, and the 'hors d'oeuvres hypothesis' for assembly of the complex (англ.) // Photosynth Res : journal. — 2005. — Vol. 85, no. 1. — P. 133—143. — doi:10.1007/s11120-004-2149-5. — PMID 15977064.
- Masakazu Iwai, Kenji Takizawa, Ryutaro Tokutsu, Akira Okamuro, Yuichiro Takahashi & Jun Minagawa. Isolation of the elusive supercomplex that drives cyclic electron flow in photosynthesis (англ.) // Nature : journal. — 2010. — 22 April (vol. 464). — P. 1210—1213. — doi:10.1038/nature08885.
- Hiroko Takahashi, Sophie Clowez, Francis-André Wollman, Olivier Vallon & Fabrice Rappaport. Cyclic electron flow is redox-controlled but independent of state transition (англ.) // Nature Communications : journal. — Nature Publishing Group, 2013. — 13 June (vol. 4). — doi:10.1038/ncomms2954.
- Lianwei Peng, Hideyuki Shimizu, Toshiharu Shikanai,. The Chloroplast NAD(P)H Dehydrogenase Complex Interacts with Photosystem I in Arabidopsis (англ.) // J Biol Chem. : journal. — 2008. — Vol. 283, no. 50. — P. 34873—34879.. — doi:10.1074/jbc.M803207200.
- Yamori W., Sakata N., Suzuki Y., Shikanai T., Makino A. Cyclic electron flow around photosystem I via chloroplast NAD(P)H dehydrogenase (NDH) complex performs a significant physiological role during photosynthesis and plant growth at low temperature in rice (англ.) // Plant J. : journal. — 2011. — Vol. 68, no. 6. — P. 966—976. — doi:10.1111/j.1365-313X.2011.04747.x.
- Chaddock, A.M.; Mant, A.; Karnauchov, I.; Brink, S.; Herrmann, R.G.; Klösgen, R.B.; Robinson, C. A new type of signal peptide: central role of a twin-arginine motif in transfer signals for the delta pH-dependent thylakoidal protein translocase (англ.) // EMBO J. : journal. — 1995. — Vol. 14, no. 12. — P. 2715—2722. — PMID 7796800.
- Kenneth Cline and Hiroki Mori. Thylakoid ΔpH-dependent precursor proteins bind to a cpTatC–Hcf106 complex before Tha4-dependent transport (англ.) // J Cell Biol. : journal. — 2001. — 20 August (vol. 154, no. 4). — P. 719—730. — doi:10.1083/jcb.200105149.
- McDonald A.E., Ivanov A.G., Bode R., Maxwell D.P., Rodermel S.R., Hüner N.P. Flexibility in photosynthetic electron transport: the physiological role of plastoquinol terminal oxidase (PTOX) (англ.) // Biochim. Biophys. Acta : journal. — 2011. — August (vol. 1807, no. 8). — P. 954—967. — doi:10.1016/j.bbabio.2010.10.024. — PMID 21056542.
- Ермаков, 2005, с. 123.
- Navassard V. Karapetyan, Alfred R. Holzwarth, Matthias Rögner. The photosystem I trimer of cyanobacteria: molecular organization, excitation dynamics and physiological significance (англ.) // FEBS letters : journal. — 1999. — Vol. 460, no. 3. — P. 395—400. — doi:10.1016/S0014-5793(99)01352-6.
- Adam Ben-Shema, Felix Frolowb, Nathan Nelsona,. Evolution of photosystem I – from symmetry through pseudosymmetry to asymmetry (англ.) // FEBS letters : journal. — 30 April 2004. — Vol. 565, no. 3. — P. 274—280. — doi:10.1016/S0014-5793(04)00360-6.
- Boudreau E., Takahashi Y., Lemieux C., Turmel M., Rochaix J.D. The chloroplast ycf3 and ycf4 open reading frames of Chlamydomonas reinhardtii are required for the accumulation of the photosystem I complex (англ.) // EMBO J : journal. — 1997. — Vol. 16, no. 20. — P. 6095—6104. — doi:10.1093/emboj/16.20.6095. — PMID 9321389.
- Lockau, Wolfgang, Wolfgang Nitschke. Photosystem I and its Bacterial Counterparts (англ.) // Physiologia Plantarum : journal. — 1993. — Vol. 88, no. 2. — P. 372—381. — doi:10.1111/j.1399-3054.1993.tb05512.x.
Литература
- Зитте П. и др. Ботаника / Под ред. В. В. Чуба. — 35-е изд. — М.: Академия, 2008. — Т. 2. Физиология растений. — 495 с.
- Медведев С. С. Физиология растений. — СПб.: БХВ-Петербург, 2013. — 335 с.
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.
- Хелдт Г. В. Биохимия растений. — М.: БИНОМ. Лаборатория знаний, 2011. — 471 с.
Ссылки
- Информационная система «Фотосинтетическая мембрана»
- «Циклический и нециклический поток электронов.» в онлайн энциклопедии Физиология растений