Терминальная оксидаза
Терминальная оксидаза, или альтернативная оксидаза пластид, — фермент, который находится на стромальной стороне тилакоидной мембраны в хлоропластах растений и водорослей и внутриклеточных впячиваниях цитоплазматической мембраны цианобактерий. Впервые гипотеза о его существовании была высказан в 1982 году, и подтвердилась годами позже, после открытия в мембране тилакоида фермента, аминокислотная последовательность которого была сходной с таковой у альтернативной оксидазы митохондрий[1]. Обе оксидазы произошли от общего предшественника — белка прокариот, и настолько схожи в структурном и функциональном плане, что помещённая в тилакоид альтернативная оксидаза может заменить выключенную терминальную оксидазу[2].
| Терминальная оксидаза | |
|---|---|
| Идентификаторы | |
| Символ | PTOX |
| Pfam | PF01786 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Функция
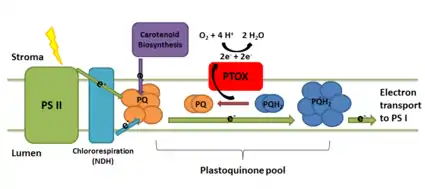
Терминальная оксидаза катализирует окисление пула пластохинонов, сбрасывая электроны на кислород с образованием воды. Это оказывает различное влияние на развитие и функционирование хлоропластов.
Биосинтез каротиноидов и развитие пластид
Терминальная оксидаза важна для биосинтеза каротиноидов во время биогенеза хлоропластов. В развивающихся пластидах, её активность предотвращает перевосстановление пула пластохинонов. Растения, нокаутные по этому этому гену имели пёстрые листья, покрытые белыми пятнами. Без этого фермента, замедляется синтез каротиноидов, поскольку не хватает окисленных пластохинонов, которые могут окислить фитоен — предшественник каротиноидов. Бесцветный фитоен накапливается в листьях, в результате появляются белые пятна из неокрашенных клеток[3]. Также полагают, что терминальная оксидаза определяет окислительно-восстановительное равновесие развивающегося фотосинтетического аппарата и что без неё, растение не может осуществить организацию внутренних мембранных структур хлоропластов при облучении ярким светом[1][4].
Защита от фотоповреждений
Пластиды с выключенным геном IMMUTANS, кодирующий терминальную оксидазу становится очень чувствительными к фотоокислительному стрессу. На их листьях появляются белые пятна, что говорит о недостатке пигмента и фотоповреждении тканей. Этот эффект усиливается с ростом температуры и интенсивности света. Основная причина этого в том, что синтез каротиноидов в отсутствии оксидазы сильно снижается, и они не могут участвовать в выполнении таких защитных функций, как виолоксантиновый цикл или тушение триплетного хлорофилла[5].
Изначально полагали, что терминальная оксидаза является своего рода «выхлопом», через который растение осуществляет выброс избыточных восстановительных эквивалентов, что бы защитить фотосистему II от фотоповреждений, однако согласно современным представлениям всё несколько сложнее. Этот фермент по-видимому осуществляет поддержание баланса между углеводным метаболизмом и скоростью электронного транспорта[6]. К тому же, некоторые исследования показали, что чрезмерная экспрессия этого белка приводит к увеличенному образованию активных форм кислорода. Это означает, что для функционирования терминальной оксидазы как «выхлопа» необходимо наличие эффективной антиоксидантной системы[7].
Дыхание хлоропластов и поток электронов
Одна из самых хорошо изученных функций терминальной оксидазы — её участие в дыхании хлоропластов, наряду с НАДН-дегидрогеназным комплексом хлоропластов аналогичном НАДH-дегидрогеназному комплексу митохондрий и гомологичный бактериальному комплексу I[8][9]. Дыхание хлоропластов — феномен, наблюдаемый при облучении хлоропластов светом высокой интенсивности. В таких условиях, вместо того, что бы выделять кислород, хлоропласты начинают активно его поглощать.
В этом процессе, НАДН-дегидрогеназный комплекс окисляет ферредоксин и восстанавливает пул пластохинонов, а терминальная оксидаза окисляет их, выполняя такую же функцию как и цитохром с-оксидаза в электронном транспорте митохондрий. У Chlamydomonas, было обнаружено две копии гена, кодирующего терминальную оксидазу. PTOX2 участвует в электронном транспорте в условиях темноты, окисляя пул пластохинонов и таким образом осуществляя суточную регуляцию фотосинтеза через изменение окислительно-восстановительного потенциала[10]. Полагают, что подобную функцию она может выполнять и у высших растений[11].
Помимо этого терминальная оксидаза способна модулировать баланс между нециклическим и циклическим транспортом электронов вокруг фотосистемы I, что имеет место при прекращении ассимиляции углерода в ночное время суток[12].
Структура
Терминальная оксидаза — это интегральный белок мембраны, закреплённый на стромальной стороне тилакоидной мембраны. На основании гомологии первичной последовательности, полагают, что фермент имеет четыре альфа-спиральных домена, окружающих двухатомный центр из атомов железа. Оба атома лигированы шестью консервативными гистидинами и глутаматами — Glu136, Glu175, His171, Glu227, Glu296, и His299[13]. Предсказанная структура похожа на структуру альтернативной оксидазы, с дополнительным доменом Exon 8, необходимым для стабильности и правильной работы этой оксидазы. Фермент заякорен на мембране при помощи пятой короткой альфа-спирали, содержащей остаток Tyr212, который, как полагают, участвует в сязывании субстрата[14].
Механизм
Терминальная оксидаза катализирует перенос четырёх электронов от восстановленного пластохинона к молекуле кислорода и образование воды:
- 2 QH2 + O2 → 2 Q + 2 H2O
Анализ субстратной специфичности выявил, что фермент взаимодействует практически исключительно с пластохиноном и не взаимодействует с такими хинонами как убихинон и дурохинон. К тому же, железо оказалось абсолютно необходимым для каталитической активности фермента и не может быть заменено катионами таких металлов как Cu2+, Zn2+, или Mn2+. В отличие от альтернативной оксидазы, терминальная оксидаза не регулируется пируватом сахарами или АМФ[15].
Представляется маловероятным, что бы все четыре электрона одновременно переносились на один железный кластер, поэтому все предложенные механизмы исходят из предположения о раздельном двухэлектронном переносе от восстановленного пластохинона. Первый этап является общим для всех предложенных механизмов: один пластохинон окисляется, и оба атома железа восстанавливаются из Fe(III) до Fe(II). Для следующего шага — захвата кислорода существуют четыре разных версии. Один механизм предполагает участие перекиси как промежуточного реагента, после чего один атом кислорода используется для создания воды, а другой остаётся связанным с железным центром. После окисления второго пластохинона, образуется вторая молекула воды, и атомы железа возвращаются в окисленное состояние. Другой механизм предполагает образование Fe(III)-OH или Fe(IV)-OH и тирозинового радикала.[16]. Такой механизм мог бы объяснить почему при повышенной экспресси гена PTOX происходит повышенное образование активных форм кислорода.
Эволюция
Данный фермент представлен у организмов способных к оксигенному фотосинтезу, то есть растений, водорослей, и цианобактерий. Предположительно терминальная оксидаза и альтернативная оксидаза произошли от общего предкового белка, с центром из двух атомов железа. Восстановление кислорода скорее всего было древним механизмом защиты от окисления во времена перехода от анаэробной к аэробной жизни. До того как случился эндосимбиоз, терминальная оксидаза эволюционировала в древних цианобактериях, а альтернативная оксидаза в α-протеобактериях, которые предположительно были предшественниками митохондрий. После эндосимбиоза, терминальная оксидаза попала к эукариотам, которые эволюционировали в растения и водоросли. Секвенирование геномов множества видов растений и водорослей показало, что аминокислотная последовательность более чем на 25 % консервативна, что является существенным результатом для такого фермента как оксидаза. Эти результаты подтверждают теорию о том, что как альтернативная, так и терминальная оксидазы независимо эволюционировали до эндосимбиоза и не претерпели существенных изменений в ходе эукариотической эволюции[17].
Также существуют PTOX цианофаги, содержащие копии гена терминальной оксидазы. Известно, что они могут играть роль вирусных векторов, обеспечивая перенос генов между разными видами цианобактерий. Некоторые доказательства говорят в пользу того, что фаги могут использовать эту оксидазу, что бы стимулировать циклический поток электронов и производить больше АТФ и меньше НАДФН, поскольку для синтеза вирусных капсидов требуется больше АТФ[1].
Примечания
- McDonald A.E., Ivanov A.G., Bode R., Maxwell D.P., Rodermel S.R., Hüner N.P. Flexibility in photosynthetic electron transport: the physiological role of plastoquinol terminal oxidase (PTOX) (англ.) // Biochim. Biophys. Acta : journal. — 2011. — August (vol. 1807, no. 8). — P. 954—967. — doi:10.1016/j.bbabio.2010.10.024. — PMID 21056542.
- Fu A., Liu H., Yu F., Kambakam S., Luan S., Rodermel S. Alternative oxidases (AOX1a and AOX2) can functionally substitute for plastid terminal oxidase in Arabidopsis chloroplasts (англ.) // Plant Cell : journal. — 2012. — April (vol. 24, no. 4). — P. 1579—1595. — doi:10.1105/tpc.112.096701. — PMID 22534126.
- Carol P., Kuntz M. A plastid terminal oxidase comes to light: implications for carotenoid biosynthesis and chlororespiration (англ.) // Trends Plant Sci. : journal. — 2001. — January (vol. 6, no. 1). — P. 31—6. — doi:10.1016/S1360-1385(00)01811-2. — PMID 11164375.
- Foudree A., Putarjunan A., Kambakam S., Nolan T., Fussell J., Pogorelko G., Rodermel S. The Mechanism of Variegation in immutans Provides Insight into Chloroplast Biogenesis (англ.) // Front. Plant Sci. : journal. — 2012. — November (vol. 3, no. 260). — P. 260. — doi:10.3389/fpls.2012.00260. — PMID 23205022.
- Aluru M.R., Rodermel S.R. Control of chloroplast redox by the IMMUTANS terminal oxidase (англ.) // Physiol. Plant. : journal. — 2004. — January (vol. 120, no. 1). — P. 4—11. — doi:10.1111/j.0031-9317.2004.0217.x. — PMID 15032871.
- Sun X., Wen T. Physiological roles of plastid terminal oxidase in plant stress responses (англ.) // J. Biosci. : journal. — 2011. — December (vol. 36, no. 5). — P. 951—956. — doi:10.1007/s12038-011-9161-7. — PMID 22116293.
- Heyno E., Gross C.M., Laureau C., Culcasi M., Pietri S., Krieger-Liszkay A. Plastid alternative oxidase (PTOX) promotes oxidative stress when overexpressed in tobacco (англ.) // J. Biol. Chem. : journal. — 2009. — November (vol. 284, no. 45). — P. 31174—31180. — doi:10.1074/jbc.M109.021667. — PMID 19740740.
- Lianwei Peng, Hideyuki Shimizu, Toshiharu Shikanai,. The Chloroplast NAD(P)H Dehydrogenase Complex Interacts with Photosystem I in Arabidopsis. (англ.) // J Biol Chem. : journal. — 2008. — Vol. 283, no. 50. — P. 34873—34879.. — doi:10.1074/jbc.M803207200.
- Yamori W., Sakata N., Suzuki Y., Shikanai T., Makino A. Cyclic electron flow around photosystem I via chloroplast NAD(P)H dehydrogenase (NDH) complex performs a significant physiological role during photosynthesis and plant growth at low temperature in rice. (англ.) // Plant J. : journal. — 2011. — Vol. 68, no. 6. — P. 966—976. — doi:10.1111/j.1365-313X.2011.04747.x.
- Houille-Vernes L., Rappaport F., Wollmann F.A., Alric J., Johnson X. Plastid terminal oxidase 2 (PTOX2) is the major oxidase involved in chlororespiration in Chlamydomonas (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2011. — December (vol. 106, no. 51). — P. 20820—20825. — doi:10.1073/pnas.1110518109.
- Joët T., Genty B., Josse E.M., Kuntz M., Cournac L., Peltier G. Involvement of a plastid terminal oxidase in plastoquinone oxidation as evidenced by expression of the Arabidopsis thaliana enzyme in tobacco (англ.) // J. Biol. Chem. : journal. — 2002. — August (vol. 277, no. 35). — P. 31623—31630. — doi:10.1074/jbc.M203538200. — PMID 12050159.
- Trouillard M., Shahbazi M., Moyet L., Rappaport F., Joliot P., Kuntz M., et al. Kinetic properties and physiological role of the plastoquinone terminal oxidase (PTOX) in a vascular plant (англ.) // Biochim. Biophys. Acta : journal. — 2012. — December (vol. 1817, no. 12). — P. 2140—2148. — doi:10.1016/j.bbabio.2012.08.006. — PMID 22982477.
- Fu A., Park S., Rodermel S. Sequences required for the activity of PTOX (IMMUTANS), a plastid terminal oxidase: in vitro and in planta mutagenesis of iron-binding sites and a conserved sequence that corresponds to Exon 8 (англ.) // J. Biol. Chem. : journal. — 2005. — December (vol. 280, no. 52). — P. 42489—42496. — doi:10.1074/jbc.M508940200. — PMID 16249174.
- Fu A., Aluru M., Rodermel S.R. Conserved active site sequences in Arabidopsis plastid terminal oxidase (PTOX): in vitro and in planta mutagenesis studies (англ.) // J. Biol. Chem. : journal. — 2009. — August (vol. 284, no. 34). — P. 22625—22632. — doi:10.1074/jbc.M109.017905. — PMID 19542226.
- Josse E.M., Alcaraz J.P., Labouré A.M., Kuntz M. In vitro characterization of a plastid terminal oxidase (PTOX) (англ.) // Eur. J. Biochem. : journal. — 2003. — September (vol. 270, no. 18). — P. 3787—3794. — doi:10.1046/j.1432-1033.2003.03766.x. — PMID 12950262.
- Affourtit C., Albury M.S., Crichton P.G., Moore A.L. Exploring the molecular nature of alternative oxidase regulation and catalysis (англ.) // FEBS Lett. : journal. — 2002. — January (vol. 510, no. 3). — P. 121—126. — doi:10.1016/S0014-5793(01)03261-6. — PMID 11801238.
- McDonald A.E., Vanlerberghe G.C. Origins, evolutionary history, and taxonomic distribution of alternative oxidase and plastoquinol terminal oxidase (англ.) // Comp. Biochem. Physiol., Part C: Genomics and Proteomics : journal. — 2006. — September (vol. 1, no. 3). — P. 357—364. — doi:10.1016/j.cbd.2006.08.001. — PMID 20483267.