Тиоредоксин
Тиоредоксины — семейство маленьких белков, представленный во всех организмах от архей до человека[1][2]. Они участвуют во многих важных биологических процессах, включая определение окислительно-восстановительного потенциала клетки и передачу сигнала. У человека тиоредоксин кодируется геном TXN[3]. Мутации, приводящие к потере функциональности даже одного аллеля этого гена, приводят к смерти на стадии четырёхклеточного эмбриона. Тиоредоксин играет значительную роль в организме человека, хотя и не до конца ясно какую именно. Всё чаще и чаще его возможные функции связывают с действием лекарств и противодействием активным формам кислорода. У растений тиоредоксины регулируют целый спектр жизненно важных функций, начиная от фотосинтеза и роста и заканчивая цветением, развитием и прорастанием семян. А совсем недавно выяснилось, что они также участвует в межклеточном взаимодействии и обмене информацией между растительными клетками[4].
| Тиоредоксин | ||||||
|---|---|---|---|---|---|---|
| Идентификаторы | ||||||
| Символы | TXN delta 3testicular tissue protein Li 199thioredoxin delta 3thioredoxinTXNATL-derived factorADFSASPsurface-associated sulphydryl protein | |||||
| Внешние IDs | GeneCards: | |||||
| Профиль экспрессии РНК | ||||||
 | ||||||
| Больше информации | ||||||
| Ортологи | ||||||
| Виды | Человек | Мышь | ||||
| Entrez |
|
| ||||
| Ensembl |
|
| ||||
| UniProt |
|
| ||||
| RefSeq (мРНК) |
|
| ||||
| RefSeq (белок) |
|
| ||||
| Локус (UCSC) | n/a | n/a | ||||
| Поиск PubMed | n/a | |||||
| Править (человек) | ||||||
Функции
Тиоредоксины представляют собой белки с массой около 12 кДа. Их отличительная особенность — наличие двух расположенных рядом остатков цистеина, заключённых в мотив типа CXXC, где С — цистеин, а Х — любая, как правило гидрофобная, аминокислота. Ещё одна отличительной черта всех тиоредоксинов — специфическая третичная структура, которая называется тиоредоксиновой укладкой.
Главной частью белка является дисульфидная связь. При помощи неё он может восстанавливать дисульфидные связи других белков, разрушая в них дисульфидные мостики. Таким образом он регулирует активность некоторых ферментов. Кроме того, восстанавливая дисульфидные связи, тиоредоксин поставляет электроны, которые затем используются во многих биохимических процессах клетки. Например, вместе с глутатионом он поставляет электроны для рибонуклеотидредуктазы, то есть участвует в синтезе дезоксинуктлеотидов, и ФАФС-редуктазы. В этом плане, его функция сходна с таковой у глутатиона и частично с ней перекрывается. Так, тиоредоксин является сильным антиоксидантом: вместе с глутатионовой системой тиоредоксиновая система участвует в обезвреживании активных форм кислорода, передавая электроны различным пероксидазам[5]. Исследования показали, что тиоредоксин взаимодействует с рибонуклеазой, хориогонадотропинами, факторами коагуляции, глюкокортикоидным рецептором и инсулином. Реакцию тиоредоксина с инсулином традиционно используют для определения активности тиоредоксина[6]. Было показано, что тиоредоксин способен стимулировать связывание факторов транскрипции с ДНК. Эти факторы были определены как ядерный фактор NF-κB, который является важным фактором в клеточной реакции на окислительный стресс, апоптоз и процессы опухолеобразования.
Восстановление тиоредоксина осуществляет специальный флавопротеин тиоредоксин редуктаза, который использует для этого одну молекулу НАДФН[7]. Глутаредоксины во многом сходны по функциям с тиоредоксинами, но вместо специфической редуктазы они восстанавливаются глутатионом.
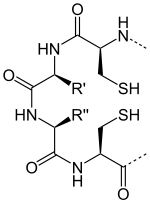
↔ 2 H+ + 2 e- + 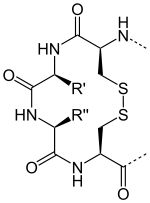
Восстановленный тиоредоксин Окисленный тиоредоксин
Способность тиоредоксинов противостоять окислительному стрессу была продемонстрирована в эксперименте с трансгенными мышами у которых была повышенная экспрессия тиоредоксина. Трансгенные мыши лучше сопротивлялись воспалительным реакциям и жили на 35 % дольше[8]. Такие данные служат существенным аргументом в пользу свободнорадикальной теории старения. Тем не менее, результаты исследования нельзя считать достоверными, поскольку контрольная группа мышей жила значительно меньше обычного, что могло создать иллюзию увеличения продолжительности жизни у трансгенных мышей[9].
У растений существует очень сложная система тиоредоксинов, состоящая из шести хорошо различимых типов (тиоредоксины f, m, x, y, h, и o). Они расположены в разных частях клетки и участвуют в массе различных процессов. Именно действие тиоредоксинов лежит в основе светозависимой активации ферментов. На свету, в результате совместного действия фотосистемы I и фотосистемы II образуется большое количество восстановительных эквивалентов — ферредоксинов. По достижении определённой концентрации ферредоксина, за счёт действия Фермент ферредоксин-тиоредоксинредуктазы происходит восстановление тиоредоксина, который в свою очередь активирует ферменты, восстанавливая дисульфидные связи. Таким путём активируется по крайней мере пять ключевых ферментов цикла Кальвина, а также белок-активаза Рубиско, альтернативная оксидаза митохондрий и терминальная оксидаза хлоропластов. Механизм активации через тиоредоксин позволяет регулировать активность ферментов не только в зависимости от соотношения НАДФН/НАДФ+, но и одновременно от интенсивности света[10]. В 2010 году была открыта необычная способность тиоредоксинов перемещаться из клетки в клетку. Такая способность лежит в основе нового, ранее не известного для растений, способа межклеточной коммуникации[4].
Взаимодействия
Было показано, что тиоредоксин взаимодействует со следующими белками:
См. также
- Рубиско — фермент, регулируемый тиоредоксином
- Пероксиредоксин — фермент, регулируемый тиоредоксином
- Тиоредоксиновая укладка
Ссылки
Примечания
- Holmgren A. Thioredoxin and glutaredoxin systems (англ.) // J Biol Chem : journal. — 1989. — Vol. 264, no. 24. — P. 13963—13966. — PMID 2668278.
- Nordberg J., Arnér E. S. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system (англ.) // Free Radic Biol Med : journal. — 2001. — Vol. 31, no. 11. — P. 1287—1312. — doi:10.1016/S0891-5849(01)00724-9. — PMID 11728801.
- .Wollman E. E., d'Auriol L., Rimsky L., Shaw A., Jacquot J. P., Wingfield P., Graber P., Dessarps F., Robin P., Galibert F. Cloning and expression of a cDNA for human thioredoxin (англ.) // J. Biol. Chem. : journal. — 1988. — October (vol. 263, no. 30). — P. 15506—15512. — PMID 3170595.
- Meng L., Wong J. H., Feldman L. J., Lemaux P. G., Buchanan B. B. A membrane-associated thioredoxin required for plant growth moves from cell to cell, suggestive of a role in intercellular communication (англ.) // Proceedings of the National Academy of Sciences of the United States of America : journal. — 2010. — Vol. 107, no. 8. — P. 3900—3905. — doi:10.1073/pnas.0913759107. — PMID 20133584.
- Arnér E. S., Holmgren A. Physiological functions of thioredoxin and thioredoxin reductase (англ.) // Eur J Biochem : journal. — 2000. — Vol. 267, no. 20. — P. 6102—6109. — doi:10.1046/j.1432-1327.2000.01701.x. — PMID 11012661.
- Entrez Gene: TXN thioredoxin.
- Mustacich D., Powis G. Thioredoxin reductase (англ.) // Biochem J : journal. — 2000. — February (vol. 346, no. Pt 1). — P. 1—8. — doi:10.1042/0264-6021:3460001. — PMID 10657232.
- Yoshida T., Nakamura H., Masutani H., Yodoi J. The involvement of thioredoxin and thioredoxin binding protein-2 on cellular proliferation and aging process (англ.) // Annals of the New York Academy of Sciences : journal. — 2005. — Vol. 1055. — P. 1—12. — doi:10.1196/annals.1323.002. — PMID 16387713.
- Muller, F.L., Lustgarten, M.S., Jang, Y., Richardson, A. & Van Remmen, H. Trends in oxidative aging theories. Free Radic Biol Med 43, 477—503 (2007).
- Ермаков, 2005, с. 195.
- Liu Y., Min W. Thioredoxin promotes ASK1 ubiquitination and degradation to inhibit ASK1-mediated apoptosis in a redox activity-independent manner (англ.) // Circulation Research : journal. — 2002. — June (vol. 90, no. 12). — P. 1259—1266. — doi:10.1161/01.res.0000022160.64355.62. — PMID 12089063.
- Morita K., Saitoh M., Tobiume K., Matsuura H., Enomoto S., Nishitoh H., Ichijo H. Negative feedback regulation of ASK1 by protein phosphatase 5 (PP5) in response to oxidative stress (англ.) // The EMBO Journal. — 2001. — November (vol. 20, no. 21). — P. 6028—6036. — doi:10.1093/emboj/20.21.6028. — PMID 11689443.
- Saitoh M., Nishitoh H., Fujii M., Takeda K., Tobiume K., Sawada Y., Kawabata M., Miyazono K., Ichijo H. Mammalian thioredoxin is a direct inhibitor of apoptosis signal-regulating kinase (ASK) 1 (англ.) // EMBO J. : journal. — 1998. — May (vol. 17, no. 9). — P. 2596—2606. — doi:10.1093/emboj/17.9.2596. — PMID 9564042.
- Matsumoto K., Masutani H., Nishiyama A., Hashimoto S., Gon Y., Horie T., Yodoi J. C-propeptide region of human pro alpha 1 type 1 collagen interacts with thioredoxin (англ.) // Biochemical and Biophysical Research Communications : journal. — 2002. — July (vol. 295, no. 3). — P. 663—667. — doi:10.1016/s0006-291x(02)00727-1. — PMID 12099690.
- Makino Y., Yoshikawa N., Okamoto K., Hirota K., Yodoi J., Makino I., Tanaka H. Direct association with thioredoxin allows redox regulation of glucocorticoid receptor function (англ.) // J. Biol. Chem. : journal. — 1999. — January (vol. 274, no. 5). — P. 3182—3188. — doi:10.1074/jbc.274.5.3182. — PMID 9915858.
- Li X., Luo Y., Yu L., Lin Y., Luo D., Zhang H., He Y., Kim Y. O., Kim Y., Tang S., Min W. SENP1 mediates TNF-induced desumoylation and cytoplasmic translocation of HIPK1 to enhance ASK1-dependent apoptosis (англ.) // Cell Death & Differentiation : journal. — 2008. — April (vol. 15, no. 4). — P. 739—750. — doi:10.1038/sj.cdd.4402303. — PMID 18219322.
- Nishiyama A., Matsui M., Iwata S., Hirota K., Masutani H., Nakamura H., Takagi Y., Sono H., Gon Y., Yodoi J. Identification of thioredoxin-binding protein-2/vitamin D(3) up-regulated protein 1 as a negative regulator of thioredoxin function and expression (англ.) // Journal of Biological Chemistry : journal. — 1999. — July (vol. 274, no. 31). — P. 21645—21650. — doi:10.1074/jbc.274.31.21645. — PMID 10419473.
Литература
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.