Тиоредоксиновая укладка
Тиоредоксиновая укладка — это белковая укладка, общая для ферментов, катализирующих образование дисульфидной связи и изомеризацию. Укладка названа в честь канонического примера тиоредоксина и обнаруживается как в прокариотических, так и в эукариотических белках. Это пример складки альфа / бета белка, который обладает оксидоредуктазной активностью. Пространственная топология складки состоит из четырёхцепочечного антипараллельного бета-листа, заключённого между тремя альфа-спиралями.
| Тиоредоксин | |
|---|---|
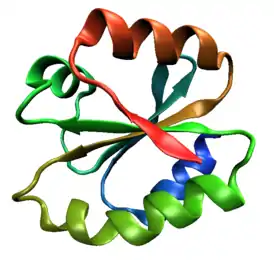 Одна молекула человеческого тиоредоксина (PDB ID 1ERT), канонический пример тиоредоксиновой укладки. | |
| Идентификаторы | |
| Символ | Thioredoxin, Trx |
| Pfam | PF00085 |
| Pfam clan | CL0172 |
| PROSITE | PDOC00172 |
| SCOP | 3trx |
| SUPERFAMILY | 3trx |
| CDD | cd01659 |
| Доступные структуры белков | |
| Pfam | структуры |
| PDB | RCSB PDB; PDBe; PDBj |
| PDBsum | 3D-модель |
Сохранение последовательности
Несмотря на вариабельность последовательности во многих областях укладки, белки тиоредоксина имеют общую последовательность активного сайта с двумя реактивными остатками цистеина: Cys-X-Y-Cys, где X и Y часто, но не обязательно, являются гидрофобными аминокислотами. Восстановленная форма белка содержит две свободные тиоловые группы у остатков цистеина, тогда как окисленная форма содержит дисульфидную связь между ними.
Образование дисульфидной связи
Различные белки, содержащие тиоредоксиновую укладку, сильно различаются по своей реакционной способности и по pKa их свободных тиолов, что обусловлено способностью общей структуры белка стабилизировать активированный тиолат. Хотя структура довольно универсальна среди белков, содержащих тиоредоксиновую складку, pKa чрезвычайно чувствительна к небольшим изменениям в структуре, особенно к расположению атомов основной цепи белка рядом с первым цистеином.
Примеры
Белки человека, содержащие этот домен, включают:
- DNAJC10
- ERP70
- GLRX3
- P4HB; P5; PDIA2; PDIA3; PDIA4; PDIA5; PDIA6; PDILT
- QSOX1; QSOX2
- STRF8
- TXN; TXN2; TXNDC1; TXNDC10; TXNDC11; TXNDC13; TXNDC14; TXNDC15; TXNDC16; TXNDC2; TXNDC3; TXNDC4; TXNDC5; TXNDC6; TXNDC8; TXNL1; TXNL3
Примечания
- Protein folding coupled to disulphide-bond formation. // Mechanisms of Protein Folding. — 2nd. — Oxford University Press, 2000.