Бета-спираль
Бета-спираль — это тандемная структура повтора белка, образованная объединением параллельных бета-цепей в спиральном узоре с двумя[1] или тремя[2] гранями. Бета-спираль — это тип соленоидного белкового домена. Структура стабилизируется межцепочечными водородными связями, белок-белковыми взаимодействиями, а иногда и связанными ионами металлов. Идентифицированы как левозакрученная, так и правозакрученная бета-спирали. Двухцепочечные бета-спирали также являются очень частой особенностью белков и обычно синонимичны укладке «Желейного рулета»
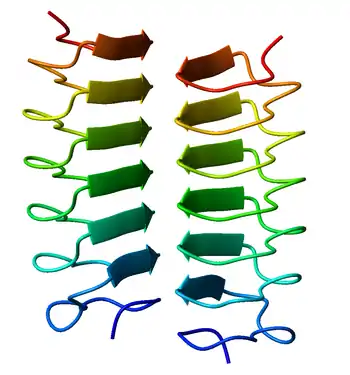
Первая бета-спираль наблюдалась в ферменте пектатлиазе, который содержит спираль из семи витков, длина которой достигает 34 Å (3,4 нм). Белок шипа хвоста фага P22, компонент бактериофага P22, имеет 13 витков, а его размер в собранном гомотримере составляет 200 Å (20 нм) в длину. Его внутренняя часть плотно упакована без центральной поры и содержит как гидрофобные остатки, так и заряженные остатки, нейтрализованные солевыми мостиками.
И пектатлиаза, и белок шипа хвоста фага P22 содержат правозакрученные спирали; левозакрученные версии наблюдались в таких ферментах, как UDP-N-ацетилглюкозаминацилтрансфераза и карбоангидра архей[3]. Другие белки, которые содержат бета-спирали включают белок-антифриз из жука Tenebrio molitor (правозакрученная)[4] и из почковидного червя ели, Choristoneura fumiferana (левозакрученная)[5], где регулярно расположенные треонины на β-спиралях связываются с поверхностью кристаллов льда и ингибируют их рост.
Бета-спирали могут эффективно связываться друг с другом, либо лицом к лицу (сопрягая грани своих треугольных призм), либо встык (образуя водородные связи). Следовательно, β-спирали можно использовать в качестве «меток» для побуждения других белков к ассоциации, подобно сегментам спиральной катушки.
Было показано, что члены семейства пентапептидных повторов обладают четырёхугольной бета-спиральной структурой.[6]
Примечания
- CATH database - folds and homologous superfamilies within the beta 2-solenoid architecture.. CATH database.
- CATH database - folds and homologous superfamilies within the beta 3-solenoid architecture.. CATH database. Архивировано 26 июля 2011 года.
- “A left-hand beta-helix revealed by the crystal structure of a carbonic anhydrase from the archaeon Methanosarcina thermophila”. EMBO J. 15 (10): 2323—30. May 1996. DOI:10.1002/j.1460-2075.1996.tb00588.x. PMID 8665839.
- “Mimicry of ice structure by surface hydroxyls and water of a beta-helix antifreeze protein”. Nature. 406 (6793): 322—4. July 2000. Bibcode:2000Natur.406..322L. DOI:10.1038/35018604. PMID 10917536.
- “Crystal structure of beta-helical antifreeze protein points to a general ice binding model”. Structure. 10 (5): 619—27. May 2002. DOI:10.1016/s0969-2126(02)00745-1. PMID 12015145.
- “Pentapeptide repeat proteins”. Biochemistry. 45 (1): 1—10. January 2006. DOI:10.1021/bi052130w. PMID 16388575.
Литература
- Branden C, Tooze J. (1999). Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY. pp 84-6.
- Dicker IB and Seetharam S. (1992) «What is known about the structure and function of the Escherichia coli protein FirA?» Mol. Microbiol., 6, 817—823.
- Raetz CRH and Roderick SL. (1995) «A Left-Handed Parallel β Helix in the Structure of UDP-N-Acetylglucosamine Acyltransferase», Science, 270, 997—1000. (Left-handed)
- Steinbacher S, Seckler R, Miller S, Steipe B, Huber R and Reinemer P. (1994) «Crystal structure of P22 tailspike protein: interdigitated subunits in a thermostable trimer», Science, 265, 383—386. (Right-handed)
- Vaara M. (1992) «Eight bacterial proteins, including UDP-N-acetylglucosamine acyltransferase (LpxA) and three other transferases of Escherichia coli, consist of a six-residue periodicity theme», FEMS Microbiol. Lett, 97, 249—254.
- Yoder MD, Keen NT and Jurnak F. (1993) «New domain motif: the structure of pectate lyase C, a secreted plant virulence factor», Science, 260, 1503—1507. (Right-handed)
Ссылки
- Семейство правозакрученных β-спиралей SCOP
- Семейство левозакрученных β-спиралей SCOP
- Семейство белков β-спирали CATH