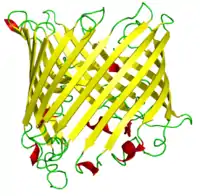
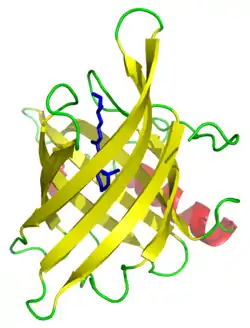
Бета-цилиндр
β-цилиндр — разновидность третичной структуры белков; β-складчатый слой, свернутый с образованием замкнутой структуры, в которой первая цепь водородными связями связана с последней. Как правило, β-цепи в β-цилиндрах расположены в антипараллельной ориентации. Чаще всего β-цилиндры формируют такие белки, как порины и другие пронизывающие мембраны белки, и белки, связывающие внутри цилиндра гидрофобные лиганды, такие как липокалины. Примерно 2-3 % генов в грамотрицательных бактериальных геномах кодируют бета-цилиндры[1].
Во многих случаях пряди содержат чередующиеся неполярные (гидрофильные и гидрофобные) аминокислоты, так что гидрофобные остатки ориентированы во внутреннюю часть цилиндра с образованием гидрофобного ядра, а полярные остатки ориентированы наружу цилиндра на открытой для растворителя поверхности. Порины и другие мембранные белки, содержащие бета-цилиндры, меняют эту картину, причем гидрофобные остатки ориентированы наружу, где они контактируют с окружающими липидами, а гидрофильные остатки ориентированы к водной внутренней поре.
Все бета-цилиндры можно классифицировать по двум целочисленным параметрам: число прядей в бета-листе, n, и «число сдвига», S, мера колебания цепей в бета-листе[2]. Эти два параметра (n и S) связаны с углом наклона бета-нитей относительно оси ствола[3][4][5].
Примечания
- William C Wimley. The versatile β-barrel membrane protein (англ.) // Current Opinion in Structural Biology. — 2003-08. — Vol. 13, iss. 4. — P. 404–411. — doi:10.1016/S0959-440X(03)00099-X.
- Alexey G. Murzin, Arthur M. Lesk, Cyrus Chothia. Principles determining the structure of β-sheet barrels in proteins I. A theoretical analysis (англ.) // Journal of Molecular Biology. — 1994-03. — Vol. 236, iss. 5. — P. 1369–1381. — doi:10.1016/0022-2836(94)90064-7.
- Alexey G. Murzin, Arthur M. Lesk, Cyrus Chothia. Principles determining the structure of β-sheet barrels in proteins II. The observed structures (англ.) // Journal of Molecular Biology. — 1994-03. — Vol. 236, iss. 5. — P. 1382–1400. — doi:10.1016/0022-2836(94)90065-5.
- Wei-min Liu. Shear numbers of protein β-barrels: definition refinements and statistics 1 1Edited by J. M. Thornton (англ.) // Journal of Molecular Biology. — 1998-01. — Vol. 275, iss. 4. — P. 541–545. — doi:10.1006/jmbi.1997.1501.
- Steven Hayward, E. James Milner-White. Geometrical principles of homomeric β-barrels and β-helices: Application to modeling amyloid protofilaments: HAYWARD and MILNER-WHITE (англ.) // Proteins: Structure, Function, and Bioinformatics. — 2017-10. — Vol. 85, iss. 10. — P. 1866–1881. — doi:10.1002/prot.25341.
Дальнейшее чтение
- Branden, Carl. Introduction to protein structure / Carl Branden, John Tooze. — 2nd. — New York : Garland Pub., 1999. — ISBN 978-0-8153-2304-4.
- Michalik M, Orwick-Rydmark M, Habeck M, Alva V, Arnold T, Linke D (2017). “An evolutionarily conserved glycine-tyrosine motif forms a folding core in outer membrane proteins”. PLOS ONE. 12 (8): e0182016. Bibcode:2017PLoSO..1282016M. DOI:10.1371/journal.pone.0182016. PMC 5542473. PMID 28771529.
- Hayward S, Milner-White EJ (October 2017). “Geometrical principles of homomeric β-barrels and β-helices: Application to modeling amyloid protofilaments” (PDF). Proteins. 85 (10): 1866—1881. DOI:10.1002/prot.25341. PMID 28646497.