Свободнорадикальная теория старения
Свободнорадикальная теория старения утверждает, что старение происходит из-за накопления повреждений в клетках, нанесённых свободными радикалами с течением времени[1].
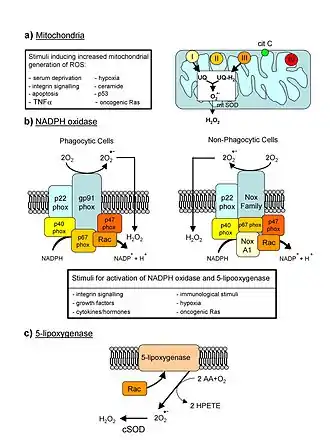
Теория впервые была предложена Денхамом Харманом в 1950-х годах[2], а в 1970-х годах Харман сделал предположение о ключевом участии митохондрий в образовании свободных радикалов, повреждающих клетки[3].
Свободные радикалы — это любые молекулы или атомы, содержащие один или несколько неспаренных электронов на внешнем электронном уровне. В силу своей природы свободные радикалы являются очень реакционноспособными и, образуясь в клетке в результате каких-либо биологических процессов, могут приводить к повреждению биологических молекул (белков, липидов, нуклеиновых кислот и других). Накопление большого количества таких повреждений в клетках приводит к нарушению их нормальной работы, а также увеличению вероятности смерти и возникновения различных заболеваний в случае многоклеточных организмов.
Изначально свободнорадикальная теория старения была связана только со свободными радикалами, как, например, супероксид, однако позднее теория была расширена на такие активные формы кислорода, как перекись водорода и пероксинитрит[4]. Современная теория связывает старение с окислительным стрессом в целом.
Маловероятно, что старение обусловлено исключительно повреждением от свободных радикалов: факторы внешней среды и генетический фон также играют довольно значительную роль. Однако в одной из статей Хармана[5] утверждается, что средняя продолжительность жизни при рождении может быть увеличена в среднем на 5 лет при соблюдении низкокалорийной диеты и приёме ингибиторов свободнорадикальных реакций.
Некоторые авторы высказывают сомнения по поводу того, что связь уровня продукции активных радикалов с продолжительностью жизни и старением так проста[6].
Тем не менее, есть весьма достоверные сведения о связи повреждений свободными радикалами с такими возрастными патологиями, как рак[7] или нейродегенеративные заболевания[8].
Введение
Свободнорадикальная теория старения была предложена Дэнхемом Харманом в 1950-х годах, когда среди учёных бытовало мнение, что свободные радикалы слишком нестабильны, чтобы существовать в биологических системах[2]. Вероятно, истоками теории послужили:
- теория «темпа жизни», которая утверждает, что продолжительность жизни обратнопропорциональна уровню метаболизма, который, в свою очередь, зависит от уровня потребления кислорода;
- наблюдения Ребекки Гершман о связи токсичности кислорода при высоком давлении и радиационной токсичности со свободными радикалами кислорода[9].
Зная, что радиация вызывает накопление мутаций, рак и старение, Харман предположил, что свободные радикалы, образующиеся в результате клеточного дыхания, могут приводить к накоплению мутаций в ДНК, что может приводить к потере организмом его функциональности и последующей смерти[9].
Позднее свободнорадикальная теория была расширена, чтобы включить также возрастные патологии. Было показано, что повреждения свободными радикалами связаны с такими заболеваниями, как: рак, артрит, атеросклероз, диабет и болезнь Альцгеймера. Также была показана роль свободных радикалов в осуществлении таких клеточных процессов, как апоптоз и некроз[9].
В 1972 году Харман модифицировал свою изначальную теорию в митохондриальную теорию старения. В своей сегодняшней форме теория утверждает, что активные формы кислорода, продуцируемые митохондриями, повреждают биологические макромолекулы, как то: липиды, белки и митохондриальную ДНК. Эти повреждения вызывают мутации, которые приводят к повышению уровня продукции активных форм кислорода и их накоплению в клетке[9].
Процессы
Свободными радикалами называют атомы или молекулы, содержащие неспаренные электроны. В стабильных частицах электроны обычно образуют пару на определённой орбитали атома или молекулы. Свободные радикалы, содержащие неспаренный электрон, склонны вступать в химические реакции, приводящие к потере неспаренного электрона или приобретению электрона для завершения пары, так, чтобы в конечном итоге все электроны оказались спаренными. Следует заметить, что присутствие неспаренного электрона никак не отражается на заряде молекулы: свободные радикалы могут быть заряжены положительно, отрицательно, или быть нейтральными. Повреждение происходит, когда свободный радикал реагирует с другими молекулами в клетке. Часто свободный радикал просто отбирает электрон у соседней молекулы, превращая её в свою очередь в свободный радикал. Новый свободный радикал проделывает ту же процедуру с новой молекулой и так далее, по цепной реакции.
Молекула, превращаемая в свободный радикал, меняет свой заряд, что зачастую приводит к её неспособности выполнять свою биологическую функцию[10].
Цепные реакции свободных радикалов могут приводить к образованию поперечных сшивок между молекулами. В случае, когда свободнорадикальная реакция включает пары азотистых оснований в молекулы ДНК, две цепи ДНК могут быть соединены поперечными сшивками[11].
Поперечные сшивки могут приводить к различным связанным со старением эффектам[12]. Так, сшивки в ДНК могут стать причиной онкологических заболеваний, а сшивки между белками и липидами — причиной возникновения морщин[13].
Свободнорадикальная теория объясняет некоторые хронические возрастные заболевания. Так, окисление липопротеидов низкой плотности приводит к формированию бляшек в сосудах, что может стать причиной различных патологий сердца[14].
Антиоксиданты способствуют уменьшению и предотвращению повреждений, наносимых свободными радикалами, благодаря своей способности донировать электроны без образования свободного радикала. Существует мнение, что высокое содержание антиоксидантов может уменьшить эффект хронических заболеваний, связанных со старением, и даже отменить само старение. Однако, употребление большого количества антиоксидантов с пищей не всегда приводит к каким-либо результатам из-за плохого всасывания некоторых антиоксидантов в кишечнике[15].
Модификации
Митохондриальная теория старения
Митохондриальная теория старения впервые была предложена в 1978 году (митохондриальная теория развития, старения и злокачественного роста)[16][17]. Эта теория не связана со свободными радикалами.
В 1980 году Микелем с соавторами была предложена свободнорадикальная митохондриальная теория старения[18], которая опирается на мнение Хармана о том, что главным источником свободных радикалов в клетке являются митохондрии. Свободнорадикальная митохондриальная теория старения, представляющая собой модификацию свободнорадикальной теории старения, утверждает, что старение у людей и животных обусловлено накоплением повреждений в митохондриях и митохондриальной ДНК[19].
О возможной связи митохондрий с процессами клеточного старения есть и более ранние работы[20], однако 1972 году Харман предположил, что продуцируемые именно митохондриями свободные радикалы могут быть причиной старения, таким образом дополнив свою оригинальную теорию[3].
Митохондрии являются основными продуцентами свободных радикалов в эукариотических клетках. Свободные радикалы, такие как: супероксид-радикал или гидроксид-радикал, в норме образуются в митохондриях в ходе работы дыхательной цепи, обеспечивающей синтез АТФ — основной энергетической «валюты» клетки[21].
Митохондрии также в большей степени подвержены повреждениям от свободных радикалов: митохондриальная ДНК, в отличие от ядерной, не защищена гистонами или другими ДНК-связывающими белками[22]. И, так как митохондрии являются важными клеточными органеллами, нарушение их работы может приводить к таким драматическим последствиям, как, например, апоптоз — программируемая клеточная смерть.
Примером исследования, подтверждающего митохондриальную теорию старения, может служить работа[23], где было показано увеличение продолжительности жизни у мышей при гиперпродукции митохондриальной каталазы — фермента, разлагающего перекись водорода на воду и кислород. Перекись водорода, не будучи нейтрализованной, способна разлагаться с образованием гидроксил-радикала, накопление которого, согласно свободнорадикальной теории, может приводить к старению.
Митохондриальная теория старения получила широкое признание в научном сообществе. Тем не менее, она подвергается критике из-за ряда противоречащих ей наблюдений[24][25]. Так, для млекопитающих не было подтверждено увеличение продолжительности жизни ни при введении антиоксидантов, ни при гиперэкспрессии генов синтеза антиоксидантов, а для дрозофилы получены противоречивые результаты. Также, у некоторых долгоживущих видов не наблюдается пониженного уровня продукции активных форм кислорода.
Другие модификации
Существуют и другие модификации свободно-радикальной теории старения. В частности, была предложена теория, в которой объединяются свободно-радикальная теория старения и влияние на старение инсулиновой передачи сигнала. Она получила название теории эпигенетического окислительно-восстановительного сдвига (англ. Epigenetic oxidative redox shift (EORS) theory of aging)[26]. Другая модификация — теория метаболической стабильности (англ. Metabolic stability theory of aging). Она постулирует, что клетки обладают способностью регулировать внутреннюю концентрацию активных форм кислорода, которая является основным определяющим фактором продолжительности жизни. Эта теория осуждает классическую свободно-радикальную теорию за то, что последняя не принимает во внимание важного значения активных форм кислорода как специфических сигнальных молекул, необходимых для нормального функционирования клетки[27].
См. также
Примечания
- Harman D. The aging process. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1981. — Vol. 78, no. 11. — P. 7124—7128. — PMID 6947277.
- HARMAN D. Aging: a theory based on free radical and radiation chemistry. (англ.) // Journal of gerontology. — 1956. — Vol. 11, no. 3. — P. 298—300. — PMID 13332224.
- Harman D. The biologic clock: the mitochondria? (англ.) // Journal of the American Geriatrics Society. — 1972. — Vol. 20, no. 4. — P. 145—147. — PMID 5016631.
- Halliwell B. Free radicals and antioxidants: updating a personal view. (англ.) // Nutrition reviews. — 2012. — Vol. 70, no. 5. — P. 257—265. — doi:10.1111/j.1753-4887.2012.00476.x. — PMID 22537212.
- Harman D. Free radical theory of aging. (англ.) // Mutation research. — 1992. — Vol. 275, no. 3-6. — P. 257—266. — PMID 1383768.
- Speakman J. R., Selman C. The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan. (англ.) // BioEssays : news and reviews in molecular, cellular and developmental biology. — 2011. — Vol. 33, no. 4. — P. 255—259. — doi:10.1002/bies.201000132. — PMID 21290398.
- Halliwell B. Oxidative stress and cancer: have we moved forward? (англ.) // The Biochemical journal. — 2007. — Vol. 401, no. 1. — P. 1—11. — doi:10.1042/BJ20061131. — PMID 17150040.
- Halliwell B. Oxidative stress and neurodegeneration: where are we now? (англ.) // Journal of neurochemistry. — 2006. — Vol. 97, no. 6. — P. 1634—1658. — doi:10.1111/j.1471-4159.2006.03907.x. — PMID 16805774.
- Harman D. Origin and evolution of the free radical theory of aging: a brief personal history, 1954–2009. (англ.) // Biogerontology. — 2009. — Vol. 10, no. 6. — P. 773—781. — doi:10.1007/s10522-009-9234-2. — PMID 19466577.
- Cui H., Kong Y., Zhang H. Oxidative stress, mitochondrial dysfunction, and aging. (англ.) // Journal of signal transduction. — 2012. — Vol. 2012. — P. 646354. — doi:10.1155/2012/646354. — PMID 21977319.
- Crean C., Geacintov N. E., Shafirovich V. Intrastrand G-U cross-links generated by the oxidation of guanine in 5'-d(GCU) and 5'-r(GCU). (англ.) // Free radical biology & medicine. — 2008. — Vol. 45, no. 8. — P. 1125—1134. — doi:10.1016/j.freeradbiomed.2008.07.008. — PMID 18692567.
- Dizdaroglu M., Jaruga P. Mechanisms of free radical-induced damage to DNA. (англ.) // Free radical research. — 2012. — Vol. 46, no. 4. — P. 382—419. — doi:10.3109/10715762.2011.653969. — PMID 22276778.
- Pageon H., Asselineau D. An in vitro approach to the chronological aging of skin by glycation of the collagen: the biological effect of glycation on the reconstructed skin model. (англ.) // Annals of the New York Academy of Sciences. — 2005. — Vol. 1043. — P. 529—532. — doi:10.1196/annals.1333.060. — PMID 16037275.
- Bamm V. V., Tsemakhovich V. A., Shaklai N. Oxidation of low-density lipoprotein by hemoglobin-hemichrome. (англ.) // The international journal of biochemistry & cell biology. — 2003. — Vol. 35, no. 3. — P. 349—358. — PMID 12531248.
- Carocho M., Ferreira I. C. A review on antioxidants, prooxidants and related controversy: natural and synthetic compounds, screening and analysis methodologies and future perspectives. (англ.) // Food and chemical toxicology : an international journal published for the British Industrial Biological Research Association. — 2013. — Vol. 51. — P. 15—25. — doi:10.1016/j.fct.2012.09.021. — PMID 23017782.
- Lobachev A.N.Role of mitochondrial processes in the development and aging of organism. Aging and cancer, Chemical abs. 1979 v. 91 N 25 91:278, 1978, с. 48, <http://aiexandr2010.narod.ru/rol.pdf>
- Лобачев А. Н.Биогенез митохондрий при дифференциации и старении клеток, ВИНИТИ 19.09.85, №6756-В85 Деп., 1985, с. 28, <http://aiexandr2010.narod.ru/Biogenesis.pdf>
- Miquel J, Economos AC, Fleming J, et al.Mitochondrial role in cell aging, Exp Gerontol, 15, 1980, с. 575–591
- Wei Y. H., Ma Y. S., Lee H. C., Lee C. F., Lu C. Y. Mitochondrial theory of aging matures--roles of mtDNA mutation and oxidative stress in human aging. (англ.) // Zhonghua yi xue za zhi = Chinese medical journal; Free China ed. — 2001. — Vol. 64, no. 5. — P. 259—270. — PMID 11499335.
- Huemer R. P., Lee K. D., Reeves A. E., Bickert C. Mitochondrial studies in senescent mice. II. Specific activity, buoyant density, and turnover of mitochondrial DNA. (англ.) // Experimental gerontology. — 1971. — Vol. 6, no. 5. — P. 327—334. — PMID 5126569.
- Murphy M. P. How mitochondria produce reactive oxygen species. (англ.) // The Biochemical journal. — 2009. — Vol. 417, no. 1. — P. 1—13. — doi:10.1042/BJ20081386. — PMID 19061483.
- Wei Y. H. Oxidative stress and mitochondrial DNA mutations in human aging. (англ.) // Proceedings of the Society for Experimental Biology and Medicine. Society for Experimental Biology and Medicine (New York, N.Y.). — 1998. — Vol. 217, no. 1. — P. 53—63. — PMID 9421207.
- Schriner S. E., Linford N. J., Martin G. M., Treuting P., Ogburn C. E., Emond M., Coskun P. E., Ladiges W., Wolf N., Van Remmen H., Wallace D. C., Rabinovitch P. S. Extension of murine life span by overexpression of catalase targeted to mitochondria. (англ.) // Science (New York, N.Y.). — 2005. — Vol. 308, no. 5730. — P. 1909—1911. — doi:10.1126/science.1106653. — PMID 15879174.
- Lapointe J., Hekimi S. When a theory of aging ages badly. (англ.) // Cellular and molecular life sciences : CMLS. — 2010. — Vol. 67, no. 1. — P. 1—8. — doi:10.1007/s00018-009-0138-8. — PMID 19730800.
- Hekimi S., Lapointe J., Wen Y. Taking a "good" look at free radicals in the aging process. (англ.) // Trends in cell biology. — 2011. — Vol. 21, no. 10. — P. 569—576. — doi:10.1016/j.tcb.2011.06.008. — PMID 21824781.
- Brewer G. J. Epigenetic oxidative redox shift (EORS) theory of aging unifies the free radical and insulin signaling theories. (англ.) // Experimental gerontology. — 2010. — Vol. 45, no. 3. — P. 173—179. — doi:10.1016/j.exger.2009.11.007. — PMID 19945522.
- Brink T. C., Demetrius L., Lehrach H., Adjaye J. Age-related transcriptional changes in gene expression in different organs of mice support the metabolic stability theory of aging. (англ.) // Biogerontology. — 2009. — Vol. 10, no. 5. — P. 549—564. — doi:10.1007/s10522-008-9197-8. — PMID 19031007.
Литература
- Harman D. Free radical theory of aging. (англ.) // Mutation research. — 1992. — Vol. 275, no. 3-6. — P. 257—266. — PMID 1383768.
- Sanz A., Stefanatos R. K. The mitochondrial free radical theory of aging: a critical view. (англ.) // Current aging science. — 2008. — Vol. 1, no. 1. — P. 10—21. — PMID 20021368.
- В. К. Кольтовер. Свободнорадикальная теория старения: исторический очерк // Успехи геронтологии. — 2002. — Т. 3, № 4. — С. 273.