Фотохимия
Фотохи́мия — часть химии высоких энергий, раздел физической химии — изучает химические превращения (химия возбужденных состояний молекул, фотохимические реакции), протекающие под действием света в диапазоне от дальнего ультрафиолета до инфракрасного излучения[1].

Законы фотохимии
- Фотохимические изменения происходят только под действием света, поглощаемого системой (закон Гротгуса — Дрепера, 1818—1843 гг.).
- Каждый поглощенный фотон в первичном акте способен активировать только одну молекулу (закон фотохимической эквивалентности Эйнштейна, 1912 г.).
- Следующие два закона относятся в основном к фотохимии органических соединений и были сформулированы американским физиком украинского происхождения М. Кашей.
- При поглощении каждого фотона молекулой имеется определенная вероятность заселения или самого нижнего синглетного (с мультиплетностью 1) состояния, либо самого нижнего триплетного (с мультиплетностью 3) состояния.
- В большинстве органических фотохимических процессов, протекающих в растворах, участвует либо первое возбужденное синглетное, либо первое возбужденное триплетное состояния.
Электронные переходы в молекуле
Диапазон волн, представляющий практическую ценность для фотохимии, включает в себя ближний ультрафиолет, видимую область и ограничен с длинноволновой стороны началом ИК-области, то есть это интервал длин волн от 190 до примерно 700—800 нм.
В этом диапазоне наблюдается изменение электронной энергии молекулы при поглощении кванта света, что является определяющим процессом для инициирования химической реакции.
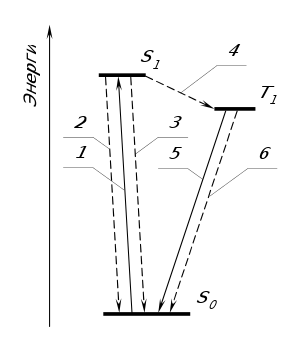
Молекула, переходя в возбужденное состояние, способна терять избыток энергии либо путём излучения, либо безызлучательно, либо вступив в химическое превращение — на преодоление активационного барьера. На рисунке показаны возможные электронные переходы, пунктиром обозначены те, которые происходят без излучения:
- Возбуждение.
- Флуоресценция (переход из состояния S1 в S0 c излучением).
- Интеркомбинационная конверсия из состояния S1 в S0 без излучения.
- Интеркомбинационная конверсия из состояния S1 в T1.
- Фосфоресценция (переход из состояния Т1 в S0 c излучением).
- Интеркомбинационная конверсия из состояния T1 в S0.
Процесс фотохимического превращения можно разделить на три стадии:
- акт поглощения, при котором образуется электронно-возбуждённое состояние;
- первичные фотохимические процессы, в которых участвуют электронно-возбуждённые состояния;
- вторичные, или темновые реакции различных химических веществ, образующихся в результате первичных процессов.
Значение фотохимии
Многие важнейшие процессы, происходящие в окружающей среде и в нас самих, имеют фотохимическую природу. Достаточно назвать такие явления, как фотосинтез, зрение и образование озона в атмосфере под действием УФ-облучения.
См. также
Примечания
Литература
- Турро Н. Молекулярная фотохимия. — М.: Мир, 1967.