Симазин
Симазин — селективный системный гербицид, разработанный компанией Geigy. Подобно атразину и тербутилазину относится к группе хлортриазинов и действует ингибируя фотосинтез. Симазин продаётся под торговыми названиями «Симазин», «Гесатоп Квик», «Линоцин», «Медурон», «Топурон» и «Тревокс».
| Симазин | |
|---|---|
  | |
| Общие | |
| Систематическое наименование |
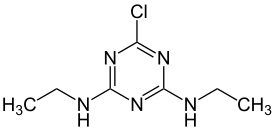
6-хлор-N,N′-диэтил-1,3,5-триазин-2,4-диамин |
| Хим. формула | C7H12ClN5 |
| Физические свойства | |
| Состояние | порошок от белого до бежевого цвета |
| Молярная масса | 201,66 г/моль |
| Плотность | 1,30 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 228 °C[1] |
| • разложения | 225–227 °C |
| Давление пара | 0,81 µПа (20 °C)[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | 6,2 мг·л−1[2] |
| Классификация | |
| Рег. номер CAS | 122-34-9 |
| PubChem | 5216 |
| Рег. номер EINECS | 204-535-2 |
| SMILES | |
| InChI | |
| ChEBI | 27496 |
| ChemSpider | 5027 |
| Безопасность | |
| Фразы риска (R) | R40, R50/53 |
| Фразы безопасности (S) | (S2), S36/37, S46, S60, S61 |
| Краткие характер. опасности (H) |
H351, H410 |
| Меры предостор. (P) |
P273, P281, P501 |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
История
Симазин был разработан компанией Geigy AG в 1950-х годах и в 1957 году впервые поступил в свободную продажу. Новый гербицид имел большой успех. Аграрное подразделение компании Geigy после серии слияний стало частью компании Syngenta. Так как остатки симазина в питьевой воде все чаще становятся проблемой, в Евросоюзе в 2003 году было принято решение об исключении его из списка разрешённых пестицидов[3].
Получение
Симазин можно получить в лабораторных условиях из кристаллического цианурхлорида концентрированного раствора этиламина (выход составляет 50 % в воде). Реакция высоко экзотермична и поэтому её следует проводить в ледяной бане при температуре ниже 10 °C. Также важно проводить синтез в вытяжном шкафу, поскольку при высоких температурах цианурхлорид разлагается на соляную и синильную кислоты, которые высокотоксичны при вдыхании.
Использование
Симазин используется в сельском хозяйстве в качестве избирательно действующего гербицида против злаковых трав и широколиственных сорняков. Чаще всего его применяют при выращивании кукурузы. Кроме того, он пригоден в качестве гербицида при посеве глубокой рассады.
Препарат не одобрен к использованию в странах Евросоюза. В Швейцарии симазин запрещён с 2012 года[4][5].
Токсикология
Токсичность симазина невелика. ЛД50 при пероральном приёме для крысы, мыши, кролика, курицы и голубя составляет около 5 г/кг массы тела. У крыс симазин вызывал развитие опухолей молочных желез и почек. На основании этих данных была установлена допустимая дневная доза в 0,005 мг/кг массы тела. Поглощённый симазин быстро всасывается. В течение первого дня он практически полностью выводится из организма, от 65 до 97 % в метаболизированном виде[2].
Воздействия на окружающую среду
Симазин адсорбируется почвенными минералами из-за своей низкой растворимости в воде. Степень его вымывания из почвы невелика. Деградация происходит в основном за счёт бактерий. В почве симазин остаётся активным в течение 2-7 месяцев после распрыскивания. Для рыб симазин токсичен, летальная концентрация в воде (LC50) для радужной форели и карпа составляет 100 мг/л. Для пчёл симазин не опасен.
Примечания
- Bradley J., Williams A., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- Werner Perkow «Wirksubstanzen der Pflanzenschutz- und Schädlingsbekämpfungsmittel», 2. Auflage, 3. Erg. Lfg. März 1992, Verlag Paul Parey.
- Record of CAS RN 122-34-9 in the GESTIS Substance Database of the IFA.
- Generaldirektion Gesundheit und Lebensmittelsicherheit der Europäischen Kommission: Eintrag zu Simazine in der EU-Pestiziddatenbank; Eintrag in den nationalen Pflanzenschutzmittelverzeichnissen der Schweiz, Österreichs Архивная копия от 22 апреля 2016 на Wayback Machine und Deutschlands; abgerufen am 14.
- Bundesamt für Umwelt BAFU: Simazin (C7H12ClN5), abgerufen am 14.