Трихлорэтилен
Трихлорэтилен (Trichoraetylenum), трихлорэтен — хлорорганическое соединение, бесцветная, прозрачная, подвижная, летучая жидкость со сладким запахом, напоминающим запах хлороформа, и сладким, жгучим вкусом. Приблизительно в полтора раза плотнее воды.
Хорошо смешивается с органическими растворителями. Практически нерастворим в воде.
Трудногорюч (в нормальных условиях не воспламеняется и не взрывается).
Под действием света и воздуха разлагается с образованием фосгена и галогенсодержащих кислот, при этом приобретает розовое окрашивание. Для стабилизации трихлорэтилена к нему добавляют 0,01 % тимола или 0.001% фенола.
Наркотик, токсичен.
| Трихлорэтилен | |||
|---|---|---|---|
 | |||
| Общие | |||
| Традиционные названия | трихлорэтен, трилен, хлорилен, наркоген, третилен, трихлоран, трихлорен, тримар | ||
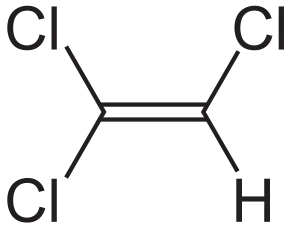
| Хим. формула | C2HCl3 | ||
| Рац. формула | CCl2=CHCl | ||
| Физические свойства | |||
| Состояние | бесцветная подвижная жидкость | ||
| Примеси | стабилизаторы тимол (0.01%) или фенол (0.001%) | ||
| Молярная масса | 131,39 г/моль | ||
| Плотность | 1,4642 г/см³ | ||
| Поверхностное натяжение | 0,02928 Н/м | ||
| Динамическая вязкость | 0,00058 Па·с | ||
| Энергия ионизации | 9,45 ± 0,01 эВ[1] | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -73 °C | ||
| • кипения | 86,7 °C | ||
| • вспышки | 32°C °C | ||
| • самовоспламенения | 416°C °C | ||
| Пределы взрываемости | 8 ± 1 об.%[1] | ||
| Критическая точка | |||
| • температура | 271°C °C | ||
| • давление | 5,02МПа | ||
| Теплопроводность | 0,138 Вт/(м·K) | ||
| Энтальпия | |||
| • образования | -7,53 кДж/моль | ||
| • растворения | 262,8 кДж/кг | ||
| Давление пара | 0,13 кПа при -43,8°C, 2,68 при 0°C, 8,0 при 20°C, 40,75 при 60°C | ||
| Химические свойства | |||
| Растворимость | |||
| • в воде | 0,027 г/100 мл | ||
| • в в воде при 10°C | 0,017 г/100 мл | ||
| Диэлектрическая проницаемость | 3,42 при 16° C | ||
| Классификация | |||
| Рег. номер CAS | 79-01-6 | ||
| PubChem | 6575 | ||
| Рег. номер EINECS | 201-167-4 | ||
| SMILES | |||
| InChI | |||
| RTECS | KX4550000 | ||
| ChEBI | 16602 | ||
| ChemSpider | 13837280 | ||
| Безопасность | |||
| Токсичность | токсичен | ||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
| Трихлорэтилен | |
|---|---|
 | |
| Химическое соединение | |
| Брутто-формула | C2HCl3 |
| CAS | 79-01-6 |
| PubChem | 6575 |
| DrugBank | 13323 |
| Состав | |
| Классификация | |
| АТХ | N01AB05 |
| Другие названия | |
| Трихлорэтилен для наркоза | |
Трихлорэтилен используется в промышленности в качестве растворителя и сырья для органического синтеза.
Физические свойства
В нормальных условиях трихлорэтилен находится в жидкой фазе. Замерзает при -73 °C, кипит при 86,7 °C[2].
Относительная плотность 1,462—1,466, 1,4642[2].
Теплопроводность жидкости: 0,142 Вт/м·К при -40 °C, 0,138 Вт/м·К при 20 °C, 0,099 Вт/м·К при 80 °C[2]. Теплопроводность пара: 0,00833 Вт/м·К при 86,7 °C[2].
Трихлорэтилен с водой образует азеотропную смесь с температурой кипения 73 °C (73 % трихлорэтилена, 7 % воды). В воде плохо растворяется, массовая доля в растворе от 0,017 % до 0,125 % в диапазоне температур 10–60 °C[2].
Химические свойства
Трихлорэтилен нельзя хранить на свету, так как в присутствии кислорода воздуха он разлагается с образованием токсичного (и воспламеняющегося) продукта - дихлорацетилена, который, в свою очередь, разлагается на фосген, угарный газ и хлороводород. Реакцию катализируют пары йода, минеральные кислоты и натронная известь.
При окислении трихлорэтилена озоном образуются фосген, хлористый водород и оксиды углерода[3].
При окислении трихлорэтилена кислородом образуется окись трихлорэтилена и дихлорацетилхлорид[4].
В присутствии катализаторов и при высоких температурах может образовывать другие хлорорганические соединения, чаще предельного строения.
В присутствии хлорида алюминия трихлорэтилен взаимодействует с хлороводородом, при этом происходит конденсация, полимеризация и осмоление[2].
Взаимодействует с фтором, хлором, бромом с образованием 1,2-дигалоген-1,2,2-трихлорэтанов. При хлорировании превращается в пентахлорэтан. С йодом не реагирует[5].
Получение
Трихлорэтилен получают путём каталитического высокотемпературного хлорирования отходов производства винилхлорида или дихлорэтана (смесь хлорэтанов и хлорэтиленов). Также получают из дихлорэтана и других отдельных соединений. Температуры каталитического хлорирования — от 350° до 450 °С в зависимости от состава сырья и катализатора[2].
Применение
Являясь хорошим растворителем, трихлорэтилен широко применяется в промышленности и быту. Используется для улучшения свойств инсектицидов[6]. Применяется для обезжиривания металлов, для химической чистки тканей[2].
Используется в органическом синтезе для очистки полученных веществ и в качестве полупродукта. Добавляется в инсектициды для улучшения их свойств. Используется при синтезе лекарств, например, является промежуточным продуктом при синтезе левомицетина[6].
На основе трихлорэтилена разработаны удобные процессы получения разнообразных веществ. С его помощью изготавливают пестициды и инсектициды, среди его производных — огнезащитные агенты, пламегасители, регуляторы молекулярного веса в производстве синтетических материалов, полилактоны[6].
Биологическое действие
Трихлорэтилен является токсичным наркотическим веществом. Накапливается в организме, представляет опасность для сердечно-сосудистой и нервной систем, органов дыхания, зрения. При продолжительном воздействии на кожу вызывает её повреждение и дерматиты[7].
В организм человека трихлорэтилен, помимо проглатывания, может попадать при дыхании, проникает через кожу[7].
Предельно допустимая концентрация (ПДК) паров трихлорэтилена в атмосферном воздухе 1 мг/м³ (максимальная разовая — 4 мг/м³), в воздухе рабочей зоны производственных помещений — 10 мг/м³. Имеет третий класс опасности по ГОСТ 12.1.005. ПДК в воде — 0,06 мг/дм³[7].
Ранее трихлорэтилен применялся для наркоза и обезболивания в качестве ингаляционного анестетика[5][8]. В большинстве стран, в том числе в России, в этом качестве ныне не используется[8].
Хранение
Трихлорэтилен хранится в сухом, прохладном, защищённом от света месте.
Примечания
- http://www.cdc.gov/niosh/npg/npgd0629.html
- Трегер, 1998.
- Кабердин и Поткин, 1994, с. 687.
- Кабердин и Поткин, 1994, с. 686.
- Кабердин и Поткин, 1994, с. 673–674.
- Кабердин и Поткин, 1994, с. 688.
- ГОСТ 9976-94, 1997, 3.4.2.
- Анестезиология : нац. рук. / Под ред. ак. РАМН А. А. Бунятяна, проф. В. М. Мизикова. — М. : ГЭОТАР-Медиа, 2013. — С. 306, 1022. — 1104 с. — 500 экз. — ББК 54.5я31. — УДК 616-089.5(086.76)(035.3). — ISBN 978-5-9704-2339-4.
Литература
- Трегер Ю. А. Трихлорэтилен // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан—Ятрохимия. — С. 10—11. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ГОСТ 9976-94 : Трихлорэтилен технический : Технические условия : Межгосударственный стандарт / Дата введения 1997-01-01. — 1997. — МКС 71.080.20. — ОКП 24 1226 0000.
- Кабердин, Р. В. Трихлорэтилен в органическом синтезе : [арх. 23 июня 2020] / Р. В. Кабердин, В. И. Поткин // Успехи химии : журн. — 1994. — № 63. — С. 673–692. — УДК 547.413. — doi:10.1070/RC1994v063n08ABEH000109.


