Дихлорацетилхлорид
Дихлорацетилхлорид (2,2-дихлорацетилхлорид) — органическое соединение, хлорангидрид дихлоруксусной кислоты. Прозрачная жидкость, нерастворимая в воде.
| Дихлорацетилхлорид[1] | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
2,2-Дихлорацетилхлорид |
| Традиционные названия | Дихлорацетилхлорид |
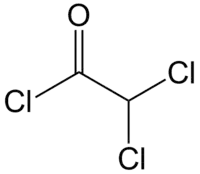
| Хим. формула | CHCl2COCl |
| Рац. формула | C2HCl3O |
| Физические свойства | |
| Состояние | прозрачная жидкость |
| Молярная масса | 147,38 г/моль |
| Плотность | 1,532 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | 107,3 °C |
| Оптические свойства | |
| Показатель преломления | 1,4591 |
| Классификация | |
| Рег. номер CAS | 79-36-7 |
| PubChem | 6593 |
| Рег. номер EINECS | 201-199-9 |
| SMILES | |
| InChI | |
| ChEBI | 34688 |
| ChemSpider | 21106100 |
| Безопасность | |
| Краткие характер. опасности (H) |
H314, H400 |
| Меры предостор. (P) |
P273, P280, P305+P351+P338, P310 |
| Сигнальное слово | Опасно |
| Пиктограммы СГС |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Получение
- Основным лабораторным способом получения является взаимодействие дихлоруксусной кислоты с бензотрихлоридом в присутствии серной кислоты. В колбу вносят 400 г дихлоруксусной кислоты и 8 мл концентрированной серной кислоты. Чистый дихлорацетилхлорид, образовавшийся в ходе реакции, отгоняется в парах при температуре 106—112 °C. Выход продукта при этом составляет 300—320 г. Протекает следующая реакция[2]:
- Основным промышленным способом получения является окисление кипящего трихлорэтилена кислородом в присутствии катализатора, в качестве которых используются азотная кислота, серная кислота, хлор или бром[2]. При этом образуется неустойчивый трихлороксиран, который в результате перегруппировки даёт необходимый продукт[3]:
- Реакция безводной дихлоруксусной кислоты с хлорирующим агентом, в роли которого выступают хлориды фосфора, серы, тионилхлорид или хлорсульфоновая кислота:
Однако эти реакции обратимы, что в совокупностью с малой доступностью дихлоруксусной кислоты ограничивает возможности использования данного метода[4].
Физические свойства
Дихлорацетилхлорид представляет собой прозрачную подвижную жидкость с резким запахом. Нерастворим в воде, однако бурно ею разлагается[2]. Смешивается с органическими растворителями[5].
Химические свойства
- Бурно гидролизуется водой с образованием дихлоруксусной кислоты:
- Вступает в реакцию этерификации со спиртами, образуя сложные эфиры:
- Образует смешанные ангидриды с карбоновыми кислотами при слабом нагревании[6]:
- Конденсируется с ароматическими углеводородами и их производными в присутствии катализаторов, к примеру, хлорида алюминия, с образованием производных хлорацетофенона[7]:
- Восстанавливается алюмогидридом лития до дихлорэтилового спирта[2]:
Применение
Дихлорацетилхлорид применяется для синтеза дихлоруксусной кислоты и различных её производных — солей, эфиров, амидов, ангидридов. Также используется для дихлорацетилирования окси- и аминосоединений[4].
Безопасность
Дихлорацетилхлорид раздражает слизистые оболочки, вызывает глубокие, труднозаживающие ожоги при попадании на кожу, поэтому работа с ним проводится в вытяжном шкафу и в резиновых перчатках[8].
Примечания
- Dichloroacetyl chloride (англ.). Sigma-Aldrich.
- Ошин, 1978, с. 97—98.
- Гауптман и др., 1979, с. 439.
- Ясницкий и др., 1970, с. 96.
- Кнунянц и др., 1998, с. 188.
- Ошин, 1978, с. 93, 97.
- Ошин, 1978, с. 94, 97.
- Ясницкий и др., 1970, с. 114.
Литература
- Промышленные хлорорганические продукты / под ред. Л. А. Ошина. — М.: Химия, 1978. — 656 с.
- Б.Г. Ясницкий, Е.Б. Дольберг, Г.И. Коваленко и др. Методы получения химических реактивов и препаратов. Выпуск 21 / Редкол.: Р.П. Ластовский и др. — М.: НИИТЭХИМ, 1970. — 136 с.
- Большой энциклопедический словарь. Химия / Редкол.: Кнунянц И.Л. и др. — 2-е изд. — М.: Советская энциклопедия, 1998. — 791 с. — ISBN 5-85270-253-6.
- З. Гауптман, Ю. Грефе, Х. Ремане. Органическая химия / под ред. В.М. Потапова. — М.: Химия, 1979.
