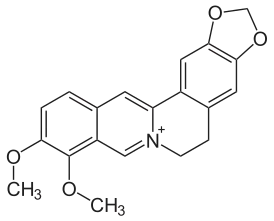
Берберин
Берберин (ранее также ямаицин и ксантопикрит) — алкалоид состава C20H17NO4, содержится в различных частях многих растений, принадлежащих к разнообразнейшим семействам, так что с этой стороны может считаться одним из распространенных в растительном царстве. Кроме барбариса (Berberis vulgaris), он найден в корнях коломба (Radix Colombo), принадлежащем растению Cocculus palmatus Dec., в коре Geoffroya inermis и Xanthoxylum clava Herculis (откуда его прежние названия ямаицин и ксантопикрит) и т. д. В настоящее время его получают из корней культивируемого лекарственного растения Coptis chinensis.[1]
| Берберин | |
|---|---|
 | |
| Общие | |
| Хим. формула | C20H18NO4⁺ |
| Физические свойства | |
| Молярная масса | 336 г/моль |
| Классификация | |
| Рег. номер CAS | 2086-83-1 |
| PubChem | 2353 |
| Рег. номер EINECS | 218-229-1 |
| SMILES | |
| InChI | |
| ChEBI | 16118 |
| ChemSpider | 2263 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Поскольку берберин обладает множеством ценных фармакологических свойств, ученые ищут пути его применения для лечения и предупреждения различных заболеваний, включая рак, болезни сердца и сахарный диабет.[2][3][4]
Химические свойства
Берберин представляет собой желтые иглы, имеющие горький вкус и содержащие кристаллизационную воду (5½Н2О), из которых три выделяются при температуре 100°; оптически он недеятелен, безводный плавится при 120°; легко растворим в горячей воде и спирте, мало — в эфире и хлороформе. Соли берберина кристалличны; большая часть их имеет золотисто-желтый цвет; в воде они легче растворимы, нежели в слабых кислотах; для берберина наиболее характерна формула соли С20H17NO4·HI·I2, осаждающаяся при смешении хлористоводородного берберина с раствором йода в йодистом калии и представляющая длинные, тонкие, бурые иглы с алмазным блеском.
Способы получения
Удобнее всего берберин получается следующим образом: корень растения Hydrastis canadensis кипятят с водой, экстракт выпаривают и обрабатывают крепким алкоголем; полученный раствор смешивают с ¼ объёма воды, отгоняют большую часть алкоголя, и горячий остаток подкисляют слабой серной кислотой; выкристаллизовавшийся сернокислый берберин затем разлагают свежеосажденною окисью свинца.
Применение
Берберин использовался в Китае в качестве медицинского средства с глубокой древности[5][6]. Он упоминался в Шэнь-нун еще в 3000 г. до н.э.[7]. Гидрохлорид берберина, включен в Фармакопею Китайской Народной Республики в качестве перорального антибактериального средства и является распространенным лекарством, отпускаемым без рецепта, при желудочно-кишечной инфекции[8].
Экспериментальные данные
Берберин обладает геропротекторными свойствами[1], он защищает организм от сердечно-сосудистых болезней[9], диабета и возрастной потери способности к обучению[10]. В частности, берберин может ингибировать накопление холестерина в создающих атеросклеротические бляшки пенистых клетках путем подавления активности комплекса AP-1 и активации пути Nrf2 / HO-1 и таким образом противодействовать развитию атеросклероза[11] Он продлил продолжительность жизни самок мух Drosophila melanogaster среднюю (на 27%), и максимальную (на 78%)[12]. Кроме того он увеличил продолжительность жизни естественно состарившихся мышей на ~ 16,49%[13].
В ряде исследований показано, что берберин также проявляет некоторое противораковое действие при лейкемии [14], меланоме [15], глиобластоме [16], гепатоцеллюлярной карциноме [17], раке толстой кишки [18] и множественной миеломе[19]. Поэтому может служить в качестве одного из средств профилактики онкогенеза.
Сочетание берберина с пентоксифиллином обладает способностью защищать почки от повреждения[20], а сочетание берберина с iSN04 (ДНК-аптамером из 18 оснований, полученным из теломерной части генома Lactobacillus rhamnosus) восстанавливает дифференцировку миобластов скелетных мышц и поэтому может стать лекарством от митохондриальных миопатий[21]
Аналоги и метаболиты берберина
Берберин может быть окислен кишечной микробиотой до 8-оксиберберина, а именно оксиберберина, который, как оказалось, менее токичен по сравнению с берберином и проявляет лучшую противовоспалительную, противогрибковую и антиаритмическую активность по сравнению с берберином[22][23][24], а также обладает превосходящим противодиабетическим действием по сравнению с берберином.[24].
Аналог берберина называемый коптизином известен своим горьким вкусом. Они оба являются изохинолиновыми алкалоидами и проявляют во многом сходные свойства[25]. В частности коптизин также как и берберин способен ингибировать экспрессию протеинкиназы (ROCK) [26][27]
Примечания
- Xu, Z., Feng, W., Shen, Q., Yu, N., Yu, K., Wang, S., ... & Guo, Y. (2017). Rhizoma coptidis and berberine as a natural drug to combat aging and aging-related diseases via anti-oxidation and AMPK activation. Aging and disease, 8(6), 760. doi:10.14336/AD.2016.0620 PMC 5758350 PMID 29344415
- Gao, Y., Wang, F., Song, Y., & Liu, H. (2020). The status of and trends in the pharmacology of berberine: a bibliometric review [1985–2018]. Chinese medicine, 15(1), 1-13. PMID 31988653 PMC 6971869 doi:10.1186/s13020-020-0288-z
- Patel, P. (2021). A bird's eye view on a therapeutically ‘wonder molecule’: Berberine. Phytomedicine Plus, 100070. doi:10.1016/j.phyplu.2021.100070
- Malhotra, B., Kulkarni, G. T., Dhiman, N., Sharma, A. K., & Kharkwal, H. (2021). Recent advances on Berberis aristata emphasizing berberine alkaloid including phytochemistry, pharmacology and drug delivery system. Journal of Herbal Medicine, 100433. doi:10.1016/j.hermed.2021.100433
- Birdsall, T. C. (1997). Berberine: Therapeutic Potential of Alkaloid Found in Several Medicinal Plants. Altern. Med. Rev., 2, 94-103.
- Kumar, A., Chopra, K., Mukherjee, M., Pottabathini, R., & Dhull, D. K. (2015). Current knowledge and pharmacological profile of berberine: an update. European journal of pharmacology, 761, 288-297. doi:10.1016/j.ejphar.2015.05.068
- The divine farmer's materia medica : a translation of the Shen Nong Ben Cao Jing. Yang, Shouzhong (1st ed.). Boulder, CO: Blue Poppy Press. 1998. ISBN 9780936185965
- "盐酸小檗碱 (Berberine Hydrochloride)". Pharmacopoeia of the People's Republic of China (in Chinese). 2 (5 ed.). p. 875. ISBN 978-7-5067-7337-9
- Feng, X., Sureda, A., Jafari, S., Memariani, Z., Tewari, D., Annunziata, G., ... & Sychrova, A. (2019). Berberine in Cardiovascular and Metabolic Diseases: From Mechanisms to Therapeutics. Theranostics, 9(7), 1923. PMC 6485276
- Wang, K. F., Chen, Q., Wu, N., Li, Y., Zhang, R., Wang, J., ... & Chen, J. (2019). Berberine ameliorates spatial learning memory impairment and modulates cholinergic anti-inflammatory pathway in diabetic rats. Frontiers in pharmacology, 10, 1003. doi:10.3389/fphar.2019.01003 PMC 6743342
- Yang, X. J., Liu, F., Feng, N., Ding, X. S., Chen, Y., Zhu, S. X., ... & Feng, X. F. (2020). Berberine Attenuates Cholesterol Accumulation in Macrophage Foam Cells by Suppressing AP-1 Activity and Activation of the Nrf2/HO-1 Pathway. Journal of Cardiovascular Pharmacology, 75(1), 45-53. PMID 31895879 doi:10.1097/FJC.0000000000000769
- Navrotskaya VV, Oxenkrug G, Vorobyova LI, Summergrad P. (2012). Berberine prolongs life span and stimulates locomotor activity of Drosophila melanogaster. American journal of plant sciences. 3(7A): 1037. doi:10.4236/ajps.2012.327123 PMC 4498586
- Dang Y, An Y, He J, Huang B, Zhu J, Gao M, Zhang S, Wang X, Yang B, Xie Z. (2019). Berberine ameliorates cellular senescence and extends the lifespan of mice via regulating p16 and cyclin protein expression. Aging Cell. e13060. doi:10.1111/acel.13060.
- Lin CC, Lin SY, Chung JG, Lin JP, Chen GW, Kao ST. (2006). Down-regulation of cyclin B1 and up-regulation of Wee1 by berberine promotes entry of leukemia cells into the G2/M-phase of the cell cycle. Anticancer Res.;26(2a), 1097–104. PMID 16619512
- Letašiová, S., Jantová, S., Čipák, L. U., & Múčková, M. (2006). Berberine—antiproliferative activity in vitro and induction of apoptosis/necrosis of the U937 and B16 cells. Cancer letters, 239(2), 254-262. PMID 16229943 doi:10.1016/j.canlet.2005.08.024
- Wang, J., Qi, Q., Feng, Z., Zhang, X., Huang, B., Chen, A., ... & Wang, J. (2016). Berberine induces autophagy in glioblastoma by targeting the AMPK/mTOR/ULK1-pathway. Oncotarget, 7(41), 66944–66958. doi:10.18632/oncotarget.11396 PMC 5341849 PMID 27557493
- Yang, X., & Huang, N. (2013). Berberine induces selective apoptosis through the AMPK‑mediated mitochondrial/caspase pathway in hepatocellular carcinoma. Molecular medicine reports, 8(2), 505-510. PMID 23732865 doi:10.3892/mmr.2013.1506
- Palmieri, A., Scapoli, L., Iapichino, A., Mercolini, L., Mandrone, M., Poli, F., ... & Martinelli, M. (2019). Berberine and Tinospora cordifolia exert a potential anticancer effect on colon cancer cells by acting on specific pathways. International journal of immunopathology and pharmacology, 33, 2058738419855567. doi:10.1177/2058738419855567 PMC 6822188 PMID 31663444
- Hu, H. Y., Li, K. P., Wang, X. J., Liu, Y., Lu, Z. G., Dong, R. H., ... & Zhang, M. X. (2013). Set9, NF-κB, and microRNA-21 mediate berberine-induced apoptosis of human multiple myeloma cells. Acta Pharmacologica Sinica, 34(1), 157-166. doi:10.1038/aps.2012.161 PMC 4086496 PMID 23247593
- Al-Kuraishy, H. M., Al-Gareeb, A. I., & Hussien, N. R. (2019). Synergistic effect of berberine and pentoxifylline in attenuation of acute kidney injury. International journal of critical illness and injury science, 9(2), 69–74. doi:10.4103/IJCIIS.IJCIIS_85_18 PMC 6625331 PMID 31334048
- Shinji, S., Umezawa, K., Nihashi, Y., Nakamura, S., Shimosato, T., & Takaya, T. (2021). Identification of the myogenetic oligodeoxynucleotides (myoDNs) that promote differentiation of skeletal muscle myoblasts by targeting nucleolin. Frontiers in cell and developmental biology, 8, 1683. PMID 33585451 PMC 7874222 doi:10.3389/fcell.2020.616706
- Li, C., Ai, G., Wang, Y., Lu, Q., Luo, C., Tan, L., ... & Su, Z. (2020). Oxyberberine, a novel gut microbiota-mediated metabolite of berberine, possesses superior anti-colitis effect: impact on intestinal epithelial barrier, gut microbiota profile and TLR4-MyD88-NF-κB pathway. Pharmacological research, 152, 104603. PMID 31863867 doi:10.1016/j.phrs.2019.104603
- Li, C. L., Tan, L. H., Wang, Y. F., Luo, C. D., Chen, H. B., Lu, Q., ... & Su, Z. R. (2019). Comparison of anti-inflammatory effects of berberine, and its natural oxidative and reduced derivatives from Rhizoma Coptidis in vitro and in vivo. Phytomedicine, 52, 272-283. PMID 30599908 doi:10.1016/j.phymed.2018.09.228
- Dou, Y., Huang, R., Li, Q., Liu, Y., Li, Y., Chen, H., ... & Su, Z. (2021). Oxyberberine, an absorbed metabolite of berberine, possess superior hypoglycemic effect via regulating the PI3K/Akt and Nrf2 signaling pathways. Biomedicine & Pharmacotherapy, 137, 111312. PMID 33524788 doi:10.1016/j.biopha.2021.111312
- Dostál, J., Man, S., Sečkářová, P., Hulová, D., Nečas, M., Potáček, M., ... & Marek, R. (2004). Berberine and coptisine free bases. Journal of Molecular Structure, 687(1-3), 135-142. https://doi.org/10.1016/j.molstruc.2003.09.018
- Gong, L. L., Fang, L. H., Wang, S. B., Sun, J. L., Qin, H. L., Li, X. X., ... & Du, G. H. (2012). Coptisine exert cardioprotective effect through anti-oxidative and inhibition of RhoA/Rho kinase pathway on isoproterenol-induced myocardial infarction in rats. Atherosclerosis, 222(1), 50-58. PMID 22387061 doi:10.1016/j.atherosclerosis.2012.01.046
- Wu, J., Luo, Y., Deng, D., Su, S., Li, S., Xiang, L., ... & Meng, X. (2019). Coptisine from Coptis chinensis exerts diverse beneficial properties: A concise review. Journal of cellular and molecular medicine, 23(12), 7946-7960. PMID 31622015 PMC 6850926 doi:10.1111/jcmm.14725
Литература
- Берберин // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.