Нитрат никеля(II)
Нитра́т ни́келя(II) — неорганическое соединение, соль металла никеля и азотной кислоты с формулой Ni(NO3)2, светло-зелёные кристаллы, хорошо растворяется в воде. Образует кристаллогидраты.
| Нитрат никеля(II) | |
|---|---|
2_hexahydrate_edit.jpg.webp) | |
| Общие | |
| Систематическое наименование |
Нитрат никеля(II) |
| Традиционные названия | азотнокислый никель |
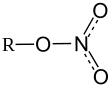
| Хим. формула | Ni(NO3)2 |
| Рац. формула | Ni(NO3)2 |
| Физические свойства | |
| Состояние | светло-зелёные кристаллы |
| Молярная масса | 182,70 г/моль |
| Плотность | гидр. 2,05 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | гидр. 56,7 °C |
| Мол. теплоёмк. | 86 Дж/(моль·К) |
| Энтальпия | |
| • образования | -401,5 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 79,20; 10025; 139,250; 180,175 г/100 мл |
| Классификация | |
| Рег. номер CAS | 13138-45-9 |
| PubChem | 25736 |
| Рег. номер EINECS | 236-068-5 |
| SMILES | |
| InChI | |
| ChemSpider | 23976 |
| Безопасность | |
| ЛД50 | 1620 мг/кг |
| Токсичность | умеренно-токсичен, ирритант, опасен для окружающей среды |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Применяется для получения гальванических покрытий из никеля, осаждения никеля на носители никелевых катализаторов, окрашивания стекла и керамики в коричневый цвет.
Канцерогенен и ядовит в больших концентрациях, как и многие другие соединения никеля.
Получение
Растворение никеля или оксида никеля(II) в разбавленной азотной кислоте:
Растворение хлорида никеля(II) в горячей азотной кислоте:
Физические свойства
Нитрат никеля(II) образует светло-зелёные кристаллы, хорошо растворимые в воде, ацетонитриле, диметилсульфоксиде.
Образует кристаллогидраты состава Ni(NO3)2•nH2O, где n = 2, 4, 6 и 9.
Наиболее стабильный кристаллогидрат Ni(NO3)2•6 H2O имеет строение [Ni(H2O)6](NO3)2 — ион никеля в этом кристаллогидрате окружён шестью молекулами воды и не имеет непосредственной химической связи с нитрат-ионами.
Химические свойства
Безводная соль при нагревании разлагается:
Гексагидрат при нагревании разлагается иначе:
Из-за разложения гидратов безводный нитрат никеля не может быть получен нагреванием, способы получения безводной соли — нагреванием гидратов с пентаоксидом азота или взаимодействием тетракарбонила никеля с тетраоксидом азота[1]:
Реагирует с гидроксидами щелочных металлов с выпадением в осадок изумрудно-зелёного гидроксида никеля(II):
Иначе реакция идёт с водными растворами аммиака, с разбавленным раствором образуется основной нитрат никеля:
и с концентрированным раствором аммиака:
При взаимодействии с сильными окислителями является слабым восстановителем:
Применение
Применяется для в гальванотехнике для никелирования, осаждения никеля на твердую фазу при создании никелевых катализаторов, в стекольной и керамической промышленности при окрашивания стекла, неорганических глазурей и керамики в коричневый цвет.
Безопасность
Как и все нитраты является окислителем, образует огнеопасные смеси с органическими веществами.
Пыль вещества раздражает глаза и слизистые оболочки, может вызывать аллергические реакции.
Умеренно ядовит для теплокровных животных, ЛД50 для крыс перорально 1620 г/кг. Является канцерогеном.
Ядовит для водных организмов.
Примечания
- Keith Lascelles, Lindsay G. Morgan, David Nicholls, Detmar Beyersmann Nickel Compounds in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2005. doi:10.1002/14356007.a17_235.pub2
Литература
- Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б. П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р. А. и др. Химические свойства неорганических веществ: Учебное пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.