Нитраты
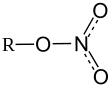
Нитра́ты (от лат. nitras; устар. селитры) — соли азотной кислоты, содержащие однозарядный анион NO3−.
Устаревшее название — «селитры» — в настоящее время используется преимущественно в минералогии, как название для минералов, а также для удобрений в сельском хозяйстве.
Общие химические свойства
Нитраты получают действием азотной кислоты HNO3 на металлы, оксиды, гидроксиды, соли. Практически все нитраты хорошо растворимы в воде.
Нитраты являются достаточно сильными окислителями в твёрдом состоянии (обычно в виде расплава), но практически не обладают окислительными свойствами в растворе, в отличие от азотной кислоты.
Нитраты устойчивы при обычной температуре. Они обычно плавятся при относительно низких температурах (200—600 °C), зачастую с разложением.
Разложение нитратов
При нагревании твёрдых нитратов все они разлагаются с выделением кислорода.
Соли азотной кислоты при нагревании разлагаются, причём продукты разложения зависят от положения солеобразующего металла в ряду стандартных электродных потенциалов:
Li→Rb→K→Ba→Sr→Ca→Na→Mg→Al→Mn→Zn→Cr→Fe→Cd→Co→Ni→Sn→Pb→(H)→Sb→Bi→Cu→Hg→Ag→Pd→Pt→Au
Нитраты металлов, расположенных левее магния Mg, (за исключением лития) при разложении образуют нитриты и кислород, например, нитрат натрия разлагается при температуре 300 °С:
Нитраты металлов, расположенные в ряду стандартных электродных потенциалов от Mg до Cu, а также Li дают при разложении оксид металла, NO2 и кислород. Например, нитрат меди(II) при нагревании разлагается с образованием оксида меди(II), диоксида азота и кислорода:
Нитраты металлов, расположенных в данном ряду после Cu образуют свободный металл, NO2 и кислород. Например, нитрат серебра разлагается при температуре 170 °С, образуя свободный металл, диоксид азота и кислород.
Термическое разложение нитрата аммония может происходить по-разному, в зависимости от температуры:
- Температура ниже 270 °C:
- Температура выше 270 °C или детонация:
Применение
Основное применение нитратов — удобрения (селитры), взрывчатые вещества (аммониты), получение стекла, производство лекарств, пищевые добавки при производстве колбас[1], в пиротехнике, компоненты ракетного топлива.
Биологическая роль
Соли азотной кислоты являются компонентами минеральных удобрений. Растения используют азот из соли для построения клеток организма, создания хлорофилла. В организме людей нитраты превращаются в нитриты и нитрозамины.
Примечания
- Opinions of the Scientific Committee for Food on: Nitrates and Nitrite / Reports of the Scientific Committee for Food; European Commission, 1997