Нитрат натрия
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
| Нитрат натрия | |
|---|---|
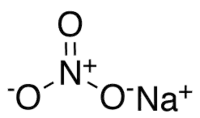 | |
.jpg.webp) | |
| Общие | |
| Систематическое наименование |
Нитрат натрия |
| Традиционные названия |
Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
| Хим. формула | NaNO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 84,993 г/моль |
| Плотность | 2,257 г/см³ |
| Твёрдость | 2 |
| Поверхностное натяжение |
119 (320°C) 117 (350°C) 114 (400°C) Н/м |
| Динамическая вязкость |
2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
| Термические свойства | |
| Температура | |
| • плавления | 308 °C |
| • кипения | с разложением °C |
| • разложения | 380 °C |
| Мол. теплоёмк. | 67 Дж/(моль·К) |
| Энтальпия | |
| • образования | -257 кДж/моль |
| • плавления | 16 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в жидком аммиаке | 127 г/100 мл |
| • в воде |
91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
| • в гидразине | 100 (20°C) |
| Классификация | |
| Рег. номер CAS | 7631-99-4 |
| PubChem | 24268 |
| Рег. номер EINECS | 231-554-3 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E251 |
| RTECS | WC5600000 |
| ChEBI | 63005 |
| Номер ООН | 1498 |
| ChemSpider | 22688 |
| Безопасность | |
| ЛД50 | 3500 мг/кг (мыши, перорально) |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Свойства
Физические свойства
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах..
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
Получение
В лаборатории нитрат натрия можно получить следующими способами:
- Взаимодействием металлического натрия или его оксида с азотной кислотой:
- Гидроксида натрия или кислых солей натрия с азотной кислотой:
Также вместо азотной кислоты можно использовать нитрат аммония:
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl-):
Применение
Применяется как удобрение; в пищевой[1], стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
Примечания
- OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite Архивная копия от 6 марта 2015 на Wayback Machine / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
Ссылки
- Производство нитрата натрия в Корее Архивная копия от 2 декабря 2021 на Wayback Machine