Метаногенез
Метаногенез, биосинтез метана — процесс образования метана анаэробными археями, сопряжённый с получением ими энергии. Существует три типа метаногенеза:
- Автотрофный метаногенез. Восстановление одноуглеродных соединений с помощью молекулярного водорода или двух- и более углеродных спиртов гидрогенотрофными или метилотрофными метаногенами.
- Метилотрофный метаногенез. Диспропорционирование одноуглеродных соединений анаэробными метилотрофными метаногенами.
- Ацетокластический метаногенез. Кажущееся диспропорционирование (декарбоксилирование) ацетата.
Энергия при этом запасается в форме натриевого или протонного трансмембранного потенциала и трансформируется АТФ-синтазами в химическую (связей в молекуле АТФ). По отношению к процессу метаногенеза иногда применяют термины карбонатное дыхание или метановое брожение. Так как в реакциях метаногенеза отсутствуют реакции субстратного фосфорилирования, характерные для процессов брожения, а протонный или натриевый градиент на мембране образуется за счет мембранных ферментов, не входящих в дыхательную электрон-транспортную цепь, то эти термины не совсем точны для их применения.
Метаногенез играет важную роль в природе, являясь основным источником метана в земной атмосфере. Используется человеком для получения биогаза.
Субстраты метаногенеза
| Реакции метаногенеза | ΔG0’ [кДж/моль CH4][1] | Организмы |
| Автотрофное образование метана | ||
| CO2 + 4 H2 → CH4 + 2 H2O | −135 | Большинство метаногенов |
| 4 HCOOH → CH4 + 3 CO2 + 2 H2O | −130 | многие гидрогенотрофные метаногены |
| CO2 + 4 CH3(CH3)CH-OH → CH4 + 4 CH3(CH3)C=0 + 2 H2O | −37 | некоторые гидрогенотрофные метаногены |
| 4 CO + 2 H2O → CH4 + 3 CO2 | −196 | Methanothermobacter und Methanosarcina |
| Метилотрофный вариант (из соединений, содержащих С1-группу) | ||
| 4 CH3OH → 3 CH4 + CO2 + 2 H2O | −105 | Methanosarcina и другие метилотрофные метаногены |
| CH3OH + H2 → CH4 + H2O | −113 | Methanomicrococcus blatticola и Methanosphaera stadtmanae |
| 4(СH3)SH + 2H2O → 3CH4 + CO2 + 4H2S | ||
| 2 (CH3)2S + 2 H2O → 3 CH4 + CO2 + 2 H2S | −49 | некоторые метилотрофные метаногены |
| 4 CH3NH2 + 2 H2O → 3 CH4 + CO2 + 4 NH3 | −75 | некоторые метилотрофные метаногены |
| 2 (CH3)2NH + 2 H2O → 3 CH4 + CO2 + 2 NH3 | −73 | некоторые метилотрофные метаногены |
| 4 (CH3)3N + 6 H2O → 9 CH4 + 3 CO2 + 4 NH3 | −74 | некоторые метилотрофные метаногены |
| (CH3)4NOH + H2O → 3CH4 + CO2 + NH3 | ||
| 4 CH3NH3Cl + 2 H2O → 3 CH4 + CO2 + 4 NH4Cl | −74 | некоторые метилотрофные метаногены |
| с N-метилированными аминами, имеющими С2-боковую цепь | ||
| 4 (CH3)3N+CH2CH2OH + 6 H2O → 4 H2NCH2CH2OH + 9 CH4 + 3 CO2 + 4 H+ | −63[2] | некоторые Methanosarcina |
| 2 (CH3)2NCH2CH2OH + 2 H2O → 2 H2NCH2CH2OH + 3 CH4 + 3 CO2 | −47[2] | некоторые Methanosarcina |
| 4 (CH3)3N+CH2COO− + 2 H2O → 4 (CH3)2NH+CH2COO− + 3 CH4 + CO2 | −240[3] | некоторые Methanosarcina |
| Ацетокластический метаногенез | ||
| CH3COOH → CH4 + CO2 | −33 | Methanosarcina и Methanosaeta |
Биохимия процесса
В процессе метаногенеза принимают участие специфические коферменты: переносчики метильной С1-группы (метанофуран (MF), 5,6,7,8-тетрагидрометаноптерин (H4МП), и кофермент M (2-меркаптоэтансульфонат, СоM)) и переносчики электронов (F420 (5-деазафлафин) F430, кофермент B (7-меркапто-гептаноил-треонинфосфат, CoB)) и метанофеназин (MP). H4МП и метанофуран найдены у метилотрофных бактерий, H4МП, F420 и кофермент M имеют сходство с коферментами, найденными у бактерий и эукариот, F430 и кофермент B не имеют аналогов у других организмов. Аналогами H4МП, метанофурана и CoM в эубактериях и эукариотах служат тетрагидрофолат и S-аденозилметионин. Присутствие уникальных кофакторов в метаногенных археях лежит в основе одной из гипотез об их отдельной эволюции. Присутствие архебактериальных коферментов у эубактерий является доказательством недавнего горизонтального переноса генов.
.svg.png.webp)
.svg.png.webp)
Автотрофное образование метана
Наиболее хорошо изучен процесс восстановления углекислого газа до метана.
- CO2 + 4 H2 → CH4 + 2H2O
Гидрогенотрофные метаногены без цитохромов
Большинство метаногенов используют в качестве восстановителя водород[1]. Такие метаногены называются водородокисляющими или гидрогенотрофными. Облигатные гидрогенотрофы включают семейства Methanopyrales, Methanobacteriales, Methanococcales и Methanomicrobiales. Исключением среди Methanomicrobiales является Мethanosphaera stadtmanae, обитающий в пищеварительном тракте человека. В качестве субстратов метаногенеза он использует метанол и водород, поскольку не может использовать CO2[4].
Автотрофные метаногены, в отличие от семейства Methanosarcinales, не содержат цитохромов и не имеют функционального аналога хинонов - метанофеназина[5]. Афтотрофные метаногены получают энергию с помощью хемиосмоса, но без помощи хинонов или цитохромов и их аналогов. Растут только на смеси H2 + CO2 или муравьиной кислоте и не могут использовать метилированные соединения или ацетат. При этом им для роста достаточно, чтобы парциальное давление H2 составляло менее 10 Па, для проведения метаногенеза. Период удвоения клеток у них составляет менее часа. Среди метаногенов без цитохромов много гипертермофильных видов.
Процесс метаногенеза начинается с активации из СО2 уникальным кофактором метанофураном, что приводит к образованию N-карбоксиметанофурана, нестабильного промежуточного соединения, которое восстанавливается до стабильного соединения N-формилметанофурана. Эта реакция требует восстановителя в виде восстановленного ферредоксина. Электроны, необходимые для этой реакции восстановления, поставляет при окислении водород. Альтернативно их может поставлять формиат при окислении формиатдегидрогеназой до СО2. Так как образование N-формилметанофурана является эндэргонической реакцией, то при этом задействуется необходимая энергия электрохимического ионного градиента мембраны[6]. Формильная группа затем переносится на другой кофактор, тетрагидрометаноптерин, структурно подобному тетрагидрофолату других организмов. Затем формильная группа, присоединенная к тетрагидрометаноптерину, дегидратируется и поэтапно восстаноавливается до N5,N10-метенил-H4MPT, N5,N10-метилен-H4MPT и N5,N10-метил-H4MPT либо молекулярным водородом, либо при участии F420[7]. Этот процесс полностью обратим и может проводится в обратном направлении. Окисленный F420 регенерируется железо-никелевой F420 -зависимой гидрогеназой (EC 1.12.98.1).
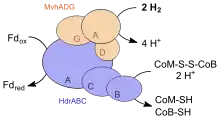
После этого, полученная метильная группа переносится на кофермент M, при помощи мембранного белка метилтетрагидрометаноптерин:кофермент М-метилтрансферазы (EC 2.1.1.86). Метилтрансфераза представляет мембранно-связанный белок. Перенос метильной группы от метил-H4МП на кофермент М представляет собой экзергоническую реакцию (ΔG0'= -29 кДж/моль)[6]). Метаногены используют выделенную энергию для экспорта из клетки примерно двух ионов натрия. В результате образуется мембранный градиент ионов натрия, используемый для синтеза АТФ. Метил-S-CoM восстанавливается коферментом B до метана при участии метил-CoM-редуктазы с образованием метана, а также гетеродисульфида коферментов B и M. Это ключевая реакция синтеза метана. Метил-CoM-редуктаза содержит кофактор F430. Последние две реакции необратимы.
Автотрофные метаногены, в отличие от других метаногенов не имеют ни метанофеназина не мембранно-связаной гетеродисульфидредуктазы[8]. Для восстановления гетеродисульфида они используют цитоплазматическую гетеродисульфид-редуктазу, которая, за счет энергии реакции окисления водорода, также восстанавливает еще ферредоксин по механизму бифуркации электронов. Функционирование цитоплазматического фермента не связана с созданием протон-движущей силы. Поэтому метаногены, не содержащие цитохромов, могут использовать только натриевый градиент, созданный метилтрансферазой. Автотрофные метаногены требуют обязательного присутствия ионов натрия для роста, так как этот катион используется в механизме запасания энергии.
N5,N10-метил-H4MPT служит точкой ветвления между процессом метаногенеза и синтезом ацетил-КоА у метаногенов. В течение синтеза ацетил-КоА, метильная группа переносится гомологом метилтетрагидрометаноптерин:кофермент М-метилтрансферазы (EC 2.1.1.86), ферментом 5-метилтетрагидрофолат:корриноид/железо-серный белок -метилтрансферазой (ЕС 2.1.1.258). Эта метильная группа затем реагирует с СО-группой, формируемой анаэробной СО-дегидрогеназой (ЕС 1.2.7.4), производя ацетил-КоА. Ацетил-КоА используется для синтеза углеводов.
| Номер
реакции |
Фермент | Шифр КФ | Катализируемая реакция |
|---|---|---|---|
| 1 | формилметанофуран:ферредоксин оксидоредуктаза | 1.2.7.12 | СО2 + 2Фдвосст. + метанофуран = формилметанофуран + Н2О + 2 Фдокисл. |
| 2 | формилметанофуран:тетрагидрометаноптерин формилтрансфераза | 2.3.1.101 | формилметанофуран + H4МП = формил-H4МП + метанофуран |
| 3 | метенил-тетрагидрометаноптерин циклогидролаза | 3.5.4.27 | формил-H4МП = метенил-H4МП + H2O |
| 4 | H2 зависимая метилен-тетрагидрометаноптерин дегидрогеназа | 1.12.98.2 | метенил-H4МП + H2 = H+ + метилен-H4МП |
| 5 | F420-зависимая метилен-тетрагидрометаноптерин редуктаза | 1.5.98.2 | метилен-H4МП + F420H2 = метил-H4МП + F420 |
| 6 | метил-тетрагидрометаноптерин: кофермент М метилтрансфераза | 2.1.1.86 | метил-H4МП + HSCoM + Na+внутр = H4МП + метил-SСоМ + Na+внешн. |
| 7 | метил-кофермент М редуктаза | 2.8.4.1 | метил-SСоМ + HSСоВ = CoM-S-S-CoB + CH4 |
| 8 | цитоплазматическая H2: СоВ-СоМ гетеродисульфид, ферредоксин редуктаза (H2-зависимая) | 1.8.98.5 | 2H2 + CoM-S-S-CoB + 2Фдвосст. = 2H+ + HSCoM + HSCoB + 2 Фдокисл. |
| 9 | F420 -зависимая гидрогеназа | 1.12.98.1 | H2 + F420 = F420H2 |
Преобразование формиата в метан
Муравьиную кислоту или ее анион, формиат (НСОО-) могут использовать примерно половина всех метаногенов в качестве субстрата[9]. В отличие от углекислого газа, он напрямую не переносится на метанофуран, а сначала окисляется формиатдегидрогеназой до углекислого газа. Фермент сожержит молибден и железо-серные кластеры, и уже выделен, например, из Methanobacterium formicicium и Methanococcus vannielii В реакции одновременно восстанавливается F420. Затем диоксид углерода восстанавливается до метана, как это было описано выше.
Что касается ступенчатого восстановления СО2 до метана, то для этого требуются восстановители. Поэтому для использования формиата в метаногенезе требуется в общей сложности восемь электронов. Это обеспечивается окислением четырех молекул муравьиной кислоты до углекислого газа. Три молекулы выделяются, а одна восстанавливается до метана. Итоговое уравнение процесса:
Метилотрофные метаногены
Метаногены порядка Methanosarcinales содержат цитохромы и метанофеназин, в отличие, от других порядков метанногенных бактерий. Метанофеназин является универсальным переносчиком электронов в мембране этих метаногенов и заменяет там хинон, который необходим в других организмах для переноса электронов в дыхательной цепи. Methanosarcinales являются наиболее универсальными метаногенами, они могут использовать для роста очень разные соединения.
Автотрофный метаногенез
Они также могут использовать смесь H2 + CO2, но в отличие от автотрофных метаногенов парциальное давление водорода должно быть выше 10 Па. Метаногены с цитохромами растут медленно, скорость их деления составляет более 10 часов на одно клеточное деление. До сих пор не было обнаружено никаких представителей метаногенов с цитохромами, которые растут в гипертермофильных условиях. Это связано с нестабильностью цитохромов при высоких температурах. Также метаносарцины не могут использовать муравьиную кислоту.
Метилотрофный метаногенез
Многие метаносарцины растут на ацетате и метилированных соединениях, таких как метанол, метиламины (моно-, ди-, триметиламин), метилтиолы (диметилсульфид, метантиол)[9].
N-метелированные амины с боковой С2 углеродной группой могут также использоваться некоторыми метаногенами рода Methanococcoides (принадлежат Methanosarcinales) для метаногенеза[3][2]. Однако в этих соединениях используются только метильные группы. Например, холин или диметиламиноэтанол (DMAE) разлагается до этаноламина, а метильная группа используется в реакциях метаногенеза. Диметилэтаноламин используют среди прочих Methanococcoides methylutens и Methanococcoides burtonii. Бетаин также служит в качестве субстрата для некоторых видов Methanococcoides: по аналогии с холином метильная группа восстанавливается до метана, а диметилглицин высвобождается. Все еще выясняется могут ли метаногены также использовать метилированные амины с более длинными боковыми цепями.
Поскольку углерод в метильной группе, является более восстановленным, чем в СО2, С1-соединения не должны проходить весь маршрут, как с диоксидом углерода. Поэтому они вовлекаются в реакции в нижней трети пути метаногенеза, в виде метил-СоМ. В дополнение к прямому пути до метана, метилированные соединения также должны окисляться до углекислого газа в последовательности реакций, обратных тем, которые наблюдаются в гидрогенотрофном метаногенезе. Таким образом, в метилотрофных метаногенах существует окислительная и восстановительная ветвь. Это связано с тем, что электроны для восстановительной ветви должны быть взяты из реакций окисления метильной группы до углекислого газа, поскольку использование водорода окружающей среды (как источника электронов) часто невозможно.
Например при окислении метанола до углекислого газа, три молекулы восстанавливаются до метана, с помощью 6 электронов получаемых при окислении четвертой молекулы. Это диспропорционирование происходит согласно уравнению:
Окислительная и восстановительные ветви функционируют и при поглощении метиламинов Methanosarcina. Метиламины метаболизируются до метана, СО2 и аммиака (NH3), в результате чего три и метильных групп восстанавливаются до метана, а одна окисляется до диоксида углерода.
Например, четыре молекулы метиламина превращаются в соответствии с уравнением:
Как правило, метилированные С1-соединения деградируют по реакции:
(где R = –SH, –OH, –NH2, –NHCH3, –N(CH3)2, –N(CH3)3+)
Передачу метильной группы с С1-соединений на СоМ катализируют цитозольные метилтрансферазы., у которых в активном центре содержится аминокислота пирролизин и корриноид в качестве простетической группы.
В окислительной ветви метильная группа переносится с помощью мембранно-связанной метилтетрагидрометаноптерин:СоМ метилтрансферазы. Поскольку эта реакция потребляет энергию, для этой цели используется электрохимический градиент ионов натрия. Метилтетрагидрометаноптерин окисляется с образованием восстановленного F420. Затем формильную группу переносят на метанофуран и, наконец, окисляют формилдегидрогеназой до углекислого газа.
Одно из различий между метилотрофными метаногенами и остальными метаногенами заключается в том, что они часто имеют модифицированные варианты тетрагидрометаноптерина и его производных. Некоторые метаногены (включая род Methanosarcina и Methanocaldococcus jannaschii обладают кофактором тетрагидросарциноптерином, который образуется из тетрагидрометаноптерина путем добавления остатка глутамата. Члены рода Methanogenium содержат татиоптерин, который отличается от тетрагидросарциноптерина наличием дополнительного аспартата в боковой цепи и отсутствием 7-метильной группы в птериновом фрагменте.
Помимо натриевого градиента, создаваемого метилтетрагидрометаноптерин:СоМ метилтрансферазой, энергия в метилотрофных метаногенах также запасается при восстановлении гетеродисульфида мембранным ферментативным комплексом гидрогеназы и гидродисульфид-редуктазы. У видов Methanosarcina гетеродисульфидредуктаза состоит из двух субъединиц (HdrDE)[10]. Фермент является мембранным белком. Донором электронов служит восстановленный метанофеназин, хинон-подобное соединение найденное внутри мембраны. Электроны, необходимые для восстановления гетеродисульфида берутся напрямую от водорода при его окислении H2:метанофеназин дегидрогеназа (ЕС 1.12.98.3, Vho), которая содержит, среди прочего, гем b, в качестве простетической группы. Альтернативно, электроны могут поставляться восстановленным F420. Во время реакции протоны транспортируются из клетки наружу. То есть этот комплекс служит протонной помпой. Непрямую реакцию восстановления метанофеназина осуществляет F420:метанофеназин дегидрогеназа (ЕС 1.5.98.3, Fpo). Окисленный F420 восстанавливается водородом при помощи F420-восстанавливающей гидрогеназой (ЕС 1.12.98.1). Гидрогеназный комплекс был обнаружен в Methanosarcina barkeri, обитающей в пресной воде. Methanosarcina acetivorans, архея обитающая в соленой воде, окисляет вместо водорода восстановленный ферредоксин в аналогичном мембранном комплексе (Rnf), содержащим цитохром c в качестве простетической группы.
Таким образом, метаногенами создаётся как протонный градиент, так и градиент ионов натрия (ΔµH+, ΔµNa+)[6]. Метаногены являются единственными организмами, которые параллельно создают эти два градиента.
Ацетокластический метаногенез
Окислять водород углекислым газом способны практически все метаногены, однако лишь два рода (Methanosarcina, Methanothrix (Methanosaeta)) могут декарбоксилировать ацетат. При этом именно они дают наибольший вклад в глобальную эмиссию метана[9]. Полученный за счет них метан составляет 66% от готовой продукции метана на Земле[11]. Их называют ацетокластическими метаногенами. Ацетат (CH3COOH) является единственным С2-соединением, которое может быть использовано для метаногенеза.
Для использования в качестве субстрата для метаногенеза, ацетат "активируется" путем реакции его с коферментом А с получением ацетил-КоА. Возможны два варианта:
- Либо активация происходит непосредственно через ацетил-КоА синтетазу (EC 6.2.1.1) с распадом молекулы АТф до АМФ и пирофосфата. Ацетил-КоА синтетаза встречается в облигатных ацетотрофных метаногенах рода Methanosaeta.
- Альтернативно, процесс происходит в две стадии. Ацетат сначала фосфорилируется ацетаткиназой (EC 2.7.2.1) с использованием АТФ, в результате образуется ацетилфосфат. Ацетилфосфат взаимодействует с коферментом А, образуя ацетил-КоА. Фосфотранацетилаза (EC 2.3.1.8) катализирует вторую реацию.
Ацетил-КоА распадается на три части в комплексе с СО-дегидрогеназой/ацетил-КоА синтазой (СОDH/ACS). Комплекс переносит метильную группу (СН3-) на Н4МП, которая превращается в метан, как описано выше. Карбоксильная группа (-СО) окисляется до СО2 в связанном с ферментным комплексом состоянии. Свободный кофермент А высвобождается в цитоплазму. Таким образм, одна молекула ацетата образует одну молекулу двуокиси углерода и одну молекулу метана, согласно реакции:
Гетеродисульфид СоМ-S-S-CoM, который получается при синтезе метана, восстанавливается до кофермента М и В при действии мембранной дигидрометанофеназин:СоВ-СоМ гетеродисульфид-редуктазы (HdrDE, EC 1.8.98.1)[12]. При восстановлении гетеродисульфида из цитоплазмы поглощается два протона и генерируется протон-движущая сила[13]. Донором электронов служит дигидрометанофеназин, получаемый при использовании электронов водорода, либо напрямую, либо посредством восстановления F420. Прямое восстановление происходит под действием феназиновой гидрогеназа I (ЕС 1.12.98.3). Непрямое восстановление происходит вовлечением F420H2:метанофеназин дегидрогеназы (EC 1.5.98.3). Сам восстановленный фактор F420 получается восстановлением водородом под действием F420гидрогеназы (ЕС 1.12.98.1). Обе мембранно-связанных дегидрогеназы переносят протон через мембрану. Это приводит к возникновению протонного градиента для синтеза АТФ.
Рост на окиси углерода
Окись углерода (СО) может использоваться только несколькими видами для метаногенеза[1]. Methanothermobacter thermoautotrophicus и Methanosarcina barkeri образуют из четырех молекул СО три молекулы СО2 и одну молекулу метана. Methanosarcina acetivorans также может использовать СО в качестве субстрата, в результате чего параллельно образуются ацетат и фомиат[14]. Этот тип ацетогенеза в метаногенах называется карбокситрофным ацетогенезом[15].
Синтез АТФ
В процессе метаногенеза создается как протонный градиент, так и градиент ионов натрия (ΔµH+, ΔµNa+)[6]. Метаногены являются единственными организмами, которые параллельно создают эти два градиента. Как и при анаэробном или аэробном дыхании, энергия разности концентраций ионов используется для синтеза АТФ при участии АТФ-синтазы.
Археи имеют собственные АТФ-синтазы типа А1А0, бактерии, митохондрии и хлоропласты F1F0-АТФ-синтазы, а эукариоты V1V0. Метаногены используют А1А0-АТФ-синтазу. В геноме Ms. barkeri и Ms. acetivorans были также обнаружены гены бактериальной F1F0-АТФ-синтазы. Тем не мение нельзя точно сказать экспрессируются и функционируют ли они[6]. Предположительно, эти гены появились в геноме этих археев путем горизонтального переноса генов.
Непонятно, использует ли АТФ-синтазы типа А1А0 в метаногенных археях ионы натрия или протоны. Однако благодаря наличию антипортера Na+/H+, разность концентраций ионов натрия всегда может быть преобразована в протондвижущую силу.
Точная структура АТФ-синтазы все еще остается предметом исследований. Хотя А1А0-АТФ-синтазы напоминают эукариотические V1V0-типа, они являются функционально продуцирующими АТФ, а эукариотические наоборот гидролизуют и потребляют АТФ для создания ионного градиента[9]. Большинство архей имеют ротор из 12 субъединиц. Каталитический домен, который генерирует АТФ, имеет три сайта связывания. Таким образом, для синтеза молекулы АТФ достаточно четырех протонов. Исключением является АТФ-синтаза Mc. janaschii и Mc. maripaludis, где роторный элемент имеет только 8 групп. В среднем 2,6 протона достаточно для синтеза одной молекулы АТФ.
Энергоэффективность
Восстановление углекислого газа до метана водородом — экзергонический процесс (протекает с выделением энергии). В стандартных условиях при рН=7 изменение энергии Гиббса ΔG0' составляет −130[16], −131[6],[17],[15] или 135[1]кДж/моль СН4 в зависимости от источника литературы. В таких условиях при метаногенезе могут быть образованы 3 молекулы АТФ из АДФ и неорганического фосфата на одну молекулу образующегося метана. Значения ΔG0' для других реакций образования метана приведены в таблице выше.
Для расчета ΔG0' используются температура 25°С, pH=7 и концентрации растворенных газов в равновесии при их давлении 105 Па[17]. Однако это не соответствует условиям природных мест обитания, так как такие высокие концентрации газа не встречаются в окружающей среде и не могут поддерживаться в клетке. Таким образов в естетственных условиях выход энергии ниже.
В большинстве мест обитания наблюдается давление водорода около 1-10 Па[17]. При таком давлении Н2 и рН=7 изменение свободной энергии составляет от 17 до 40 кДж/моль метана, что может означать синтез менее одной молекулы АТФ на молекулу полученного метана. Кроме того, для расчета ΔG играют роль значение рН, давление и температура. Например, изменение свободной энергии при восстановлении углекислого газа до метана водородом в стандартных условиях (25°С) падает с −131 кДж/моль до −100 кДж/моль если взять расчетную температуру 100°С[17].
Даже при использовании других соединений С1-соединений ΔG' является низким, так что многие метаногены растут около «термодинамического предела»[6].
Осуществляющие процесс организмы
Способностью образовывать метан обладают около 50 видов из 17 родов, все из которых относятся к археям отдела Euryarchaeota. Традиционно их рассматривают как группу метанобразующих бактерий, однако, филогенетически она весьма неоднородна. Выделено четыре класса включающие 6 порядков: Methanobacteria (Methanobacteriales), Methanococci (Methanococcales), Methanopyri (Methanopyrales) и Methanomicrobiales c 3 порядками (Methanomicrobiales, Methanosarcinales и Methanocellales). Methanopyrales является филогенетически самым древним, в то время как Methanosarcinales самым молодым[17][18][19]. Порядок Methanocellales, обнаруженный в 2008 году, связан с археями Methanocella paludicola и Methanocella arvoryzae, найденными в почве рисовых полей. Они занимаются автотрофным метаногенезом. Methanoplasmatales, которые относятся к Thermoplasmatales были предложены в литературе как седьмой порядок[20], но затем переименованы в Methanomassiliicoccales.[21][22]
Все метаногены — строгие анаэробы, рост некоторых из них полностью подавляется при появлении в газовой фазе 0,004 % кислорода, первые выделенные в чистые культуры виды росли при окислительно-восстановительном потенциале среды менее −300 мВ. Большинство из них мезофилы и имеют оптимум роста в области 30-40°С, все имеют оптимум pH при 6,5-7,5, есть галофилы.
Около половины видов автотрофны и фиксируют углекислый газ по ацетил-КоА-пути, ряд из них способен к азотфиксации (Methanosarcina barkeri, Methanobacterium formicium). Сера усваивается чаще всего в восстановленной форме, возможно вовлечение в метаболизм молекулярной серы, сульфит-аниона. Лишь несколько видов (Methanobrevibacter ruminantium, Methanococcus thermolithrophicum) могут использовать сульфат-анион.
Эволюция
Анализ геномов показывают, что метаногенез возник при образовании Euryarchaeota и только после расхождения с Thermococcales[23]. Это подтверждается тем фактом, что все метаногены имеют одни и те же гомологичные ферменты и кофакторы для центрального метаногенного пути. Кроме того, возникновение метаногенеза, вероятно, произошло лишь однажды, поскольку горизонтальный перенос генов между метаногенами и порядками Thermoplasmatales, Archaeoglobales и Halobacteriales, которые не могут осуществлять метаногенез, не обнаружен. Вероятно, археи в этих трех порядках утратили способность к метаногенезу в процессе эволюции.
Почему метаногенез возник в Euryarchaeota довольно рано и «внезапно», остается предметом исследований. Существует несколько теорий о происхождении метаногенеза. Одна из теорий заключается в том, что последний общий предок архей сам был метаногенным организмом[23]. Некоторые археи используют метаногенез в средах с повышенной соленостью, кислотностью и высокими температурами. Поскольку эти условия окружающей среды, предположительно, преобладали даже после образования Земли, метаногенная архея могла быть одной из первых форм жизни[6]. Следовательно, способность к метаногенезу была бы потеряна независимо у всех Crenarchaeota, а также во всех других неметаногенных линиях, что весьма маловероятно[11].
Согласно другой теории, происхождение метаногенеза связано с потребностью в окислении метана, то есть в обратном пути. Эти бактерии, также называемые метанотрофами, окисляют метан до углекислого газа и воды в аэробных условиях, тогда как у архей это анаэробный процесс[24]. Существует и противоположная точка зрения, что такие метанотрофные археи появились из метаногенных архей. Постулируется, что метаногенез, анаэробная метанотрофия архей и аэробная метанотрофия бактерий возникли на основе общего метаболического пути, который изначально использовался последним общим предком для детоксикации формальдегида.
В новой теории рассматривается роль пирролизина, в метилотрофном метаногенезе у Methanosarcinales, с помощью которого метиламины включаются в метаногенез[11]. Метильная группа метиламинов переносится на корриноидный белок с помощью специфической метилтрансферазы (см. раздел выше). Метилтрансферазы содержат 22 аминокислоту — пирролизин в каталитически активном центре. Поскольку все пирролизиновые ферменты очень филогенетически древние, считается, что они перенеслись горизонтально от нескольких линий доноров, которые теперь либо вымерли, либо еще не были обнаружены. Однако, это также означает, что предковая линия, в которой возник фермент, уже достигла некоторой степени разнообразия к тому времени, когда существовал общий предок трех основных доменов жизни.
Цитохромы были обнаружены только у Methanosarcinales, которые усваивают более широкий спектр субстратов, чем метаногены без цитохромов, а также используют ацетат. Считается, что ацетокластический метаногенез появился поздно. Предположительно гены ацетат-киназы, необходимые для утилизации ацетата, сначала переносятся в метаногенные археи путем горизонтального переноса генов из ассоциированной с ними бактериальной целлюлозо-деградирующей ацетогенной клостридии[25][26].
При выращивании на смеси двуокиси углерода и водорода, Methanosarcinales требуют высоких концентраций Н2. Поэтому при низкий концентрациях газов предпочтительно растут метаногены без цитохромов. В результате эволюции некоторые Methanosarcinales, такие как Ms. acetivorans, Methanolobus tindarius и Methanothrix soehngenii, полностью утратили способность использовать углекислый газ в качестве субстрата в смеси с водородом[17]. Поскольку метаногенез на смеси двуокиси углерода и водорода очень широко распространен, считается, что эта форма является самой древней[21].
Экологическое значение
Метаногенез является ключевым компонентом цикла углерода Земли. Метаногены завершают анаэробную деградацию биомассы, используя молекулярный водород, углекислый и угарный газы, а также низшие органические кислоты, выделяющиеся при процессах брожения. Таким образом возвращая их обратно в цикл углерода. Поскольку эти газы и, особенно метан, являются главными парниковыми газами, метаногенез имеет важное значение для процесса глобального потепления[6]. Предположительно, бразование биогенного метана играет роль в образовании гидрата метана, экономическое использование которого представляет интерес. Более 20 % мировых запасов метана имеют биогенное происхождение.
Метаногенез играет важную роль и в конце анаэробной пищевой цепи, поскольку они позволяют, в первую очередь, расти многим синтрофным видам бактерий. Эти вторичные ферментеры получают свою энергию при сбраживании лактата, пропионата, бутирата и простых органических соединений, с выделением водорода, СО2 и ацетата. Однако по термодинамическим причинам эти реакции ферментации возможны только в том случае, если полученный водород будет быстро потребляться и парциальное давление Н2 не поднимется выше 100 Па. Поглощение водорода обеспечивается тесно связанными метаногенами, которые требуют этого водорода для метаногенеза. Передача водорода между синтрофными бактериями и археями, то есть между различными видами, также называется межвидовым переносом водорода[27][1].
Поскольку метаногены, связанные с синтрофными бактериями, также встречаются в пищеварительном тракте человека, метаногенез оказывает влияние на пищеварение[28]. Около 10 % анаэробных бактерий, обитающих в пищеварительном тракте человека, являются метаногенами видов Methanobrevibacter smithii и Methanosphaera stadtmanae. Они используют два продукта бактериального брожения для метаногенеза: водород и формиат. Высокая концентрация водорода ингибирует продукцию АТФ других бактерий. M. smithii также усваивает метанол, который токсичен для человека. Поэтому метаногены оказывают положительное влияние на кишечную флору человека.
Распространение в различных средах обитания
Образование метана происходит в природе в исключительно анаэробных средах, в которых происходит разложение биомассы. Это могут быть, например, донные отложения озер и морей, рубец крупного рогатого скота, кишечник термитов и людей, рисовые поля или болота. Метаногены также используют метаболиты бактерий Clostridium butyricum, вызывающих гниение влажной древесины[21].
Метаногены замыкают, так называемую, «анаэробную пищевую цепь»[9]. В начале этой цепи биополимеры, такие как белки и полисахариды, в частности, целлюлоза, сначала расщепляюся на мономеры (аминокислоты и углеводы). Липиды разлагаются на составляющие компоненты (например, жирные кислоты). После этого бактерии ферментируют эти продукты расщепления в простые карбоновые кислоты (такие как формиат, ацетат, припионат, лактат и сукцинат), спирты (такие как этанол, изопропанол и бутанол) и другие низкомолекулярные соединения (H2, СО2 и кетоны с короткой цепью). Синтрофные ацетогенные бактерии используют некоторые из этих соединений и превращают их в С1-соединения и ацетат. В последней части анаеробной пищевой цепи эти соединения используются при метаногенезе в качестве источника углерода, энергии и восстановителей, образуя СН4 и СО2.
С1-соединения, имеющие метильную группу, такие как метиламин (СН3NH2) или метанол (СН3ОН), особенно часто встречаются в морской или солоноватой воде и являются продуктами анаэробной деградации клеточных компонентов некоторых растений и фитопланктона[9].
В качестве искусственной добавки, метаногены могут использоваться для обработки сточных вод. Эти среды обитания подходят для мезофильных организмов, растущих при умеренных температурах. Метаногенез протекает в средах с чрезвычайно высокими и низкими температурами[29] и высоким содержанием солей или высокой кислотностью, например, в геотермальных источниках. Во всех случаях в этих местах обитания концентрации ионов сульфата, нитрата, марганца (IV) и железа (III) должны быть низкими, в противном случае, бактерии используют эти ионы в качестве акцепторов электронов в анаэробном дыхании с использованием одинаковых с метаногенами субстратов в качестве доноров электронов. Окислительно-восстановительные процессы анаэробного дыхания более выгодны с энергитической точки зрения, и протекают до процессов метаногенеза, и поэтому метаногены лишаются источника энергии и проигрывают конкуренцию[17]. В анаэробных условиях углекислый газ редко является лимитирующим субстратом, так как он непрерывно высвобождается при реакциях брожения сопутствующими бактериями[1]. Большинство метаногенов предпочитают нейтральный pH, за исключением, например, Methanocalculus alkaliphilus или Methanosalsum natronophilum, у которых оптимум для роста находится в щелочной среде и составляют 9,5 или Methanoregula booneii 5,1 единиц pH[21]
См. также
Примечания
- Y. Liu, W. B. Whitman: Metabolic, phylogenetic, and ecological diversity of the methanogenic archaea. In: Annals of the New York Academy of Sciences. Band 1125, 2008. PMID 18378594, doi:10.1196/annals.1419.019, S. 171–189.
- Watkins, AJ. et al. (2012): Choline and N,N-dimethylethanolamine as direct substrates for methanogens. In: Appl Environ Microbiol. 78(23); 8298–8303; PMID 23001649; doi:10.1128/AEM.01941-12; PDF
- Watkins, AJ. et al. (2014): Glycine betaine as a direct substrate for methanogens (Methanococcoides spp.). In: Appl Environ Microbiol. 80(1); 289–293; PMID 24162571; doi:10.1128/AEM.03076-13; PDF.
- Fricke, WF. et al. (2006): The genome sequence of Methanosphaera stadtmanae reveals why this human intestinal archaeon is restricted to methanol and H2 for methane formation and ATP synthesis. In: J Bacteriol. 188(2); 642–658; PMID 16385054; PMC 1347301.
- Thauer, R.K., Kaster,A.K., Seedorf, H., Buckel, W. and Hedderich, R. = methanogenic archaea: ecologically relevant differences in energy conservation // Nat. Rev. Microbiol.. — № 6. — С. 579—591.
- U. Deppenmeier, V. Müller: Life close to the thermodynamic limit: how methanogenic archaea conserve energy. In: Results and Problems in Cell Differentiation. Band 45, 2008. PMID 17713742, doi:10.1007/400_2006_026, S. 123–152.
- Lupa, B. et al. (2008): Formate-dependent H2 production by the mesophilic methanogen Methanococcus maripaludis. In: Applied and Environmental Microbiology. Bd. 74, Nr. 21, 2008, S. 6584–6590, PMID 18791018; PDF (freier Volltextzugriff, engl.).
- Rudolf K. Thauer, Anne Kristin Kaster, Meike Goenrich, Michael Schick, Takeshi Hiromoto, Seigo Shima: Hydrogenases from methanogenic archaea, nickel, a novel cofactor, and H2 storage. In: Annual Review of Biochemistry. Bd. 79, 2010, S. 507–536, PMID 20235826, doi:10.1146/annurev.biochem.030508.152103.
- U. Deppenmeier: The unique biochemistry of methanogenesis. In: Progress in Nucleic Acid Research and Molecular Biology. Band 71, 2002. PMID 12102556, doi:10.1016/S0079-6603(02)71045-3, S. 223–283
- Ferry, JG. (2010): How to make a living by exhaling methane. In: Annu Rev Microbiol. 64; 453–473; PMID 20528692; doi:10.1146/annurev.micro.112408.134051
- Fournier, G. (2009): Horizontal gene transfer and the evolution of methanogenic pathways. In: Methods Mol Biol. 532; 163—179; PMID 19271184; doi:10.1007/978-1-60327-853-9_9.
- Deppenmeier U., Lienard T., Gottschalk G. Novel reaction involved in energy conservation by methanogenic archaea. (англ.) // FEBS Lett : журнал. — 1999. — Vol. 457, no. 3. — P. 291—7. — PMID 10471795.
- Murakami E., Deppenmeier U., Ragsdale S.W. Characterization of the intramolecular electron transfer pathway from 2-hydroxyphenazine to the heterodisulfide reductase from Methanosarcina thermophila. (англ.) // J Biol Chem : журнал. — 2001. — Vol. 276, no. 4. — P. 2432—9. — PMID 11034998.
- E. Oelgeschläger, M. Rother: Carbon monoxide-dependent energy metabolism in anaerobic bacteria and archaea. In: Archives of Microbiology. Band 190(3), 2008. PMID 18575848, doi:10.1007/s00203-008-0382-6, S. 257—269.
- Martin, W. und Russell, MJ. (2007): On the origin of biochemistry at an alkaline hydrothermal vent. In: Philos Trans R Soc Lond B Biol Sci. 362(1486); 1887—1925; PMID 17255002; PMC 2442388.
- U. Deppenmeier: Redox-driven proton translocation in methanogenic Archaea. In: Cellular and Molecular Life Sciences. Band 59 (9), 2002. PMID 12440773, doi:10.1007/s00018-002-8526-3, S. 1513—1533.
- Rudolf K. Thauer, Anne Kristin Kaster, Henning Seedorf, Wolfgang Buckel, Reiner Hedderich: Methanogenic archaea: ecologically relevant differences in energy conservation. In: Nature Reviews Microbiology. Band 6, Nr. 8, 2008, PMID 18587410, doi:10.1038/nrmicro1931, S. 579—591.
- S. Sakai et al.: Methanocella paludicola gen. nov., sp. nov., a methane-producing archaeon, the first isolate of the lineage 'Rice Cluster I', and proposal of the new archaeal order Methanocellales ord. nov. In: International Journal of Systematic and Evolutionary Microbiology. Band 58 (Pt 4), 2008. PMID 18398197, S. 929—936. PDF (недоступная ссылка) (freier Volltextzugriff, engl.).
- S. Sakai et al.: Methanocella arvoryzae sp. nov., a hydrogenotrophic methanogen isolated from rice field soil. In: International Journal of Systematic and Evolutionary Microbiology. Band 60(Pt 12), 2010. PMID 20097796, doi:10.1099/ijs.0.020883-0, S. 2918—2923.
- K. Paul et al.: 'Methanoplasmatales': Thermoplasmatales-related archaea in termite guts and other environments are the seventh order of methanogens. In: Applied and Environmental Microbiology. 2012, PMID 23001661, doi:10.1128/AEM.02193-12.
- Franziska Enzmann et al. Methanogens: biochemical background and biotechnological applications.
- Beschreibung: Diversity, ultrastructure, and comparative genomics of “Methanoplasmatales”, the seventh order of methanogens (англ.). Дата обращения: 22 апреля 2018.
- S. Gribaldo, C. Brochier-Armanet: The origin and evolution of Archaea: a state of the art. In: Philosophical Transactions of the Royal Society B: Biological Sciences. Band 361 (1470), 2006. PMID 16754611, PMC 1578729, S,1007-1022.
- Martin Kruger, Anke Meyerdierks, Frank Oliver Glockner, Rudolf Amann, Friedrich Widdel, Michael Kube, Richard Reinhardt, Jorg Kahnt, Reinhard Bocher, Rudolf K. Thauer, Seigo Shima. A conspicuous nickel protein in microbial mats that oxidize methane anaerobically (англ.) // Nature : journal. — 2003. — Vol. 426, no. 6968. — P. 878—881. — doi:10.1038/nature02207..
- Gregory P. Fournier, J. Peter Gogarten. Evolution of acetoclastic methanogenesis in Methanosarcina via horizontal gene transfer from cellulolytic Clostridia (англ.) // American Society for Microbiology : journal. — 2008. — Vol. 190, no. 3. — P. 1124—1127.
- Sofya K. Garushyants, Marat D. Kazanov, Mikhail S. Gelfand. Horizontal gene transfer and genome evolution in Methanosarcina (англ.) // BioMed Central : journal. — 2015. — Vol. 15, no. 1. — P. 1—14. — doi:10.1186/s12862-015-0393-2.
- Georg Fuchs (Hrsg.): Allgemeine Mikrobiologie, begründet von Hans-Günter Schlegel. 8. Auflage. Georg Thieme Verlag, Stuttgart, New York 2007, ISBN 978-3-13-444608-1, S. 397.
- Joan L. Slonczewski, John W. Foster: Mikrobiologie: Eine Wissenschaft mit Zukunft. 2. Auflage. Spektrum Akademischer Verlag, Berlin, Heidelberg 2012, ISBN 978-3-8274-2909-4, S. 854.
- R. K. Dhaked, P. Singh, L. Singh: Biomethanation under psychrophilic conditions. In: Waste Manag. Band 30 (12), 2010. PMID 2072413, doi:10.1016/j.wasman.2010.07.015, S. 2490—2496.
Литература
- Гусев М. В., Минеева Л. А. Микробиология. — М: Изд-во Московского университета, 2004. — 448 с.
- Современная микробиология. Прокариоты: В 2-х томах. Пер. с англ./Под ред. Й. Ленглера, Г. Древса, Г. Шлегеля. — М.: Мир, 2005. ISBN 5-03-003706-3 ISBN 5-03-003707-1 (1 том) ISBN 5-03-003708-X (2 том)
- Пиневич А. В. Микробиология. Биология прокариотов: в 3 т. — СПб.: Издательство С.-Петербургского университета, 2007. — Т. 2. — 331 с. — ISBN 978-5-288-04269-0.
- Нетрусов А. И., Котова И. Б. Микробиология. — 4-е изд., перераб. и доп. — М.: Издательский центр «Академия», 2012. — 384 с. — ISBN 978-5-7695-7979-0.