Янтарная кислота
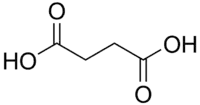
Янта́рная кислота́ (бутандиóвая кислота, химическая формула — C4H6O4 или НООС−СН2−СН2−СООН) — cлабая химическая органическая кислота, относящаяся к классу карбоновых кислот.
| Янтарная кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
этан-1,2-дикарбоновая кислота |
| Традиционные названия |
Янтарная кислота или бутандиóвая кислота |
| Хим. формула | C4H6O4 |
| Рац. формула | НООС−СН2−СН2−СООН |
| Физические свойства | |
| Молярная масса | 118.09 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 183[1] |
| Классификация | |
| Рег. номер CAS | 110-15-6 |
| PubChem | 1110 |
| Рег. номер EINECS | 203-740-4 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E363 |
| ChEBI | 15741 |
| ChemSpider | 1078 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
При стандартных условиях, янтарная кислота — это двухосновная карбоновая кислота, представляющая собой бесцветные кристаллические вещества без запаха.
Соли и эфиры янтарной кислоты называются сукцина́тами (от лат. succinum — «янта́рь»).
История
Впервые янтарная кислота была получена в XVII веке перегонкой янтаря.
Свойства
Органолептические
Янтарная кислота представляет собой белые кристаллы, обладающие слабокислым и слегка солоновато-горьким привкусом[2].
Физические
Температура плавления 183 °C. Температура кипения 235 °C. Выше 235 °C отщепляет Н2О и переходит в янтарный ангидрид. Янтарная кислота легко возгоняется при 130—140 °С. Растворимость в воде (в 100 г воды): 6,8 г (при 20 °С), 121 г (при 100 °С). Также растворяется в этиловом спирте: 9,9 г (5 °С); в диэтиловом эфире — 1,2 г (15 °С). Нерастворима кислота в бензоле, бензине и хлороформе. Константы диссоциации таковы: Ка1 = 7,4⋅10−5, Ка2 = 4,5⋅10−6.
Химические
Метиленовые группы янтарной кислоты обладают высокой реакционной способностью, что связано с влиянием карбоксильных групп. При бромировании янтарная кислота даёт дибромянтарную кислоту HOOC−(CHBr)2−COOH. Диэфиры янтарной кислоты конденсируются с кетонами (конденсация Штоббе) и с альдегидами.
С аммиаком и аминами янтарная кислота образует сукцинимид и его N-замещённые аналоги (R−H, алкильная или арильная группа). Моно- и диамиды янтарной кислоты, получаемые с ароматическими и гетероциклическими аминами, применяют для синтеза некоторых красителей, инсектицидов и лекарственных веществ.
Янтарная кислота и её ангидрид легко вступают в реакцию Фриделя — Крафтса с ароматическими соединениями (так называемое сукцинилирование), образуя производные 4-арил-4-кетомасляной кислоты.
Получение
В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
Биохимическая роль

Янтарная кислота участвует в процессе клеточного дыхания кислорододышащих организмов (см. Цикл трикарбоновых кислот).
Летальные дозы (LD50): орально — 2,26 г/кг (крысы), внутривенно — 1,4 г/кг (мыши)[3]. ПДК в воде водоёмов 0,01 мг/л.
Применение
Янтарная кислота используется в аналитической химии, а также в химическом синтезе для получения пластмасс, смол и лекарственных препаратов.
В пищевой промышленности используется в качестве подкислителя, известна также как пищевая добавка E363[2]. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы.
В медицине
В лекарственных препаратах янтарная кислота применяется в качестве активного вещества как метаболическое средство, улучшающее метаболизм и энергообеспечение тканей, уменьшающее гипоксию тканей[4].
При воздействии сукцината и гиалуроновой кислоты на клетки кожи достигается омолаживающий эффект редермализации.
Примечания
- Янтарная кислота: физические и химические свойства.
- Янтарная кислота E363 // Пищевые добавки. Энциклопедия / Н. В. Куркина. — 2-е изд. — СПб.: ГИОРД, 2004. — С. 724. — 808 с. — ISBN 5-901065-79-4.
- Safety (MSDS) data for succinic acid (недоступная ссылка) (англ.).
- Succinic acid (янтарная кислота). Справочник Видаль «Лекарственные препараты в России». Дата обращения: 2 декабря 2017.
Литература
- Химическая энциклопедия. В 5 т. Т. 5. Три-Ятр / Н. С. Зефиров (гл. ред.) и др. — М. : Большая Российская Энциклопедия, 1998. — 783 с. — ISBN 5-85270-310-9.
- Горбов А. И. Янтарная кислота и ее гомологи // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.