Путь Вуда — Льюнгдаля
Путь Вуда — Льюнгдаля, восстановительный Ацетил-КоА путь (англ. acetyl-CoA pathway, Wood-Ljungdahl pathway) [1] — метаболический путь, представляющий собой серию биохимических реакций, используемых некоторыми анаэробными хемолитоавтотрофными бактериями (ацетогенами в процессе ацетогенеза) и археями-метаногенами в процессе (метаногенеза) для фиксации СO2 и получения энергии. Этот путь позволяет организмам использовать водород в качестве донора электронов и диоксид углерода — в качестве акцептора и строительного блока для биосинтеза органических молекул.
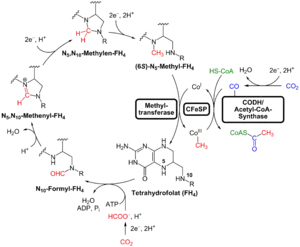
Этот путь описывает автотрофное получение молекулы ацетил-КоА из двух молекул СО2 с использованием коферментов и ферментов с металл-содержащими центрами в качестве акцепторов СО2[2][3][4][5]. Суммарная реакция пути Вуда-Льюнгдаля: идет с выделением энергии ΔG0‘=-59,2 кДж/моль[6]. Этой энергии достаточно для перекачки пары ионов через мембрану и создания электрохимического градиента, но недостаточно для субстратного фосфорилирования[7].
Две молекулы СО2 восстанавливаются независимо, в разных (карбонильной и метильной) ветках пути Вуда-Льюнгдаля. Метильная ветвь включает последовательность реакций, которая приводит к восстановлению СО2 до метильной группы -СН3. Метильная группа при этом связана тетрагидрофолатом (FH4) в бактериях и метанофураном (MFR) и тетрагидрометаноптерином (H4MPT) в археях, в качестве коферментов-переносчиков. Карбонильная часть пути включает восстановление второй молекулы CO2 до карбонильной группы (-СО), связанной с ферментом CO-дегидрогеназой, катализирующим эту реакцию. Затем метильная группа комбинируется с карбонильной группой и коферментом А, образуя молекулу ацетил-КоА. В этом участвуют особый фермент: ацетил-КоА-синтетаза[1][8]. В микроорганизмах они могут быть представлены как два отдельных фермента, так и как бифункциональный ферментный комплекс, объединяющий обе эти активности. Ключевой фермент пути (СО-дегидрогеназа/ацетил-КоА синтаза) может составлять существенную часть от всего растворимого клеточного белка (например, от 6 до 9% у Moorella thermoacetica)[9]. СО-дегидрогеназа/ацетил-КоА синтаза имеет общее происхождение у всех прокариот, использующих этот путь[10].
Особенностью этого пути является производство большого количества уксусной кислоты в качестве побочного продукта, который не используется и выводится из клетки наружу.
История открытия
Этот путь был назван в честь двух исследователей, Harland G. Wood и Lars G. Ljungdahl, которые обнаружили большинство энзимологических свойств модельной ацетогенной бактерии Moorella thermoacetica. В дальнейшем она была переклассифицирована под названием Clostridium thermoaceticum[11].
Распространенность
Путь Вуда — Льюнгдаля встречается, только у прокариот, например, у гидрогенотрофных метаногенных архей[12] и гомоацетогенных бактерий, таких как клостридии[13], аммоний-окисляющих планктомицетов[14], некоторых сульфатредуцирующих бактерий Desulfobacterium sp., Deltaproteobacteria[15] и автотрофной археи Archaeoglobales (Euryarchaeota)[16][17]. Таким образом, этот путь представлен только у строгих анаэробов. Это связано с высокой чувствительностью ферментов этого пути и их кофакторов к кислороду. Также это связано с высокой потребностью в ионах металлов (Mo, или W, Co, Ni, и Fe), которые находятся в растворенном состоянии в воде преимущественно в низкой степени окисления (то есть в анаэробных условиях без доступа кислорода). Таким образом ограничения накладываемые на доступность металлов, кофакторов и чувствительность к кислороду определяет использование этого пути в ограниченном числе экологических ниш, несмотря на его энергетическую эффективность.
Восстановительный ацетил-КоА путь функционирует в психрофилах также хорошо, как и в гипертермофилах. Его функционирование известно при температурах, которые являются максимально возможными для размножения клеток (Methanopyrus kandlery; 122°C)[18].
Вариации
Хотя общая схема пути консервативна, в археях и бактериях используются отличающиеся С1-переносчики, кофакторы, переносчики электронов и ферменты [19] Известно много вариантов данного пути.
- Например, на начальной стадии может образвываться свободный формиат, или СО, или формильная группа, связанная с коферментом.
- В качестве различных С1 переносящих коферментов используются тетрагидрофолат, или тетрагидрометаноптерин. Источником связанных с тетрагидрофолиевой кислотой С1-фрагментов могут служить как СО2, так и различные экзогенные С1-соединения (CO, формиат, формальдегид, метанол) или содержащие, присоединенную через атом О, N, или S метильную группу соединения (метиламин, метилмеркаптан, и простые и сложные О-ароматические эфиры). При этом осуществляется тетрагидрофолат-зависимое деметилирование таких метиловых эфиров при котором спирт R-ОН высвобождается, а метильная группа переносится на белок и затем на тетрагидрофолиевую кислоту. Для использования таких соединений необходимы некоторые дополнительные ферменты, например, специфичные метилтрансферазы.
- В качестве донора электронов для восстановления могут использоваться НАДН, НАДФН, ферредоксин, фактор F420 или Н2.
Эти отличия в типе кофактора, отличающегося в разных ферментах и видах микроорганизмов делает возможным объяснить часть отличий наблюдаемых в продуктивности и скорости роста.
Обратный (окислительный) ацетил-КоА путь
Все реакции восстановительного ацетил-КоА пути обратимы. Путь Вуда-Льюнгдаля используется в обратном направлении в метаболизме:
- сульфатредуцирующих бактерий. При этом электроны, взятые из органических молекул, переносятся посредством ацетил-КоА на НАДН, ацетил-КоА окисляется до СO2[20].
- Гомоацетогенов [13].
- При расщеплении ацетата до СО2 и СН4 у ацетокластических метаногенных бактерий.
- У анаэробных метилотрофов, использующих метиловые эфиры.
- Синтрофные бактерии Clostridium ultunenece и Thermoacetogenium phaeum окисляют ацетат до СО2 и Н2 в ассоциации с потребляющими сульфидогенами или метаногенами. Окисление ацетата до СО2 и Н2 является эндэргоничной реакцией (∆G0’=+107,1 кДж/моль ацетата), и ее протекание возможно при очень низком парциальном давлении водорода. Это становится возможным когда партнер в синтрофной паре потребляет образующийся при окислении ацетата водород.
Отличия от других путей фиксации углерода
- В отличие от обратного цикла Кребса и цикла Калвина, восстановительный ацетил-КоА путь линеен и не является циклическим.
- В отличие от других путей фиксации углерода, путь Вуда-Льюнгдаля может идти в обратном направлении, для получения восстановительных эквивалентов из органических соединений в течение органо-гетеротрофного роста[21][15][22]
- В противоположность другим путям фиксации углерода, восстановительный путь Вуда-Льюнгдаля может быть использован не только для фиксации, но также и для запасания энергии, через образование водородного[23] или натриевого электрохимического градиента на мембране[24][4][25][26][27][28]. Созданный градиент потребляется АТФ-азой для синтеза АТФ из АДФ и фосфата [29].
Эволюционное значение
В настоящее время активно обсуждаются гипотезы, что первые живые организмы на земле были хемолитоавтотрофами, способными синтезировать все или большинство их органических соединений из СО2, используя Н2 или другой неорганический донор электронов как восстановитель[30]. Метаногены, использующие этот путь (или предки метаногенов), могли быть первыми автотрофными организмами[31][32]. Поскольку жизнь зародилась в аноксигенных условиях, ацетил-КоА путь или очень похожий на него может быть первым процессом, используемым для автотрофной фиксации СО2[33][34]. Последние исследования геномов ряда бактерий и архей приводят к мысли, что последний универсальный общий предок (LUCA) использовал путь Вуда-Льюнгдаля в гидротермальных источниках[35]. Филогенетические реконструкции[36] также как и химические эксперименты наводят на мысль, что этот путь мог использоваться еще при возникновении жизни[37] . Неясно, была ли первоначальная цель использования этого пути для ассимиляции углерода (восстановление и фиксация углерода) или в окислении ацетата. Филогенетическое исследование ацетил-КоА синтетазы показывает что микроорганизмы (ацетогены и метаногены), имеющие этот фермент или ферменты, близкородственные ему, имеют общего предка[38].
См. также
Примечания
- Stephen W. Ragsdale. Metals and Their Scaffolds To Promote Difficult Enzymatic Reactions (англ.) // Chemical Reviews : журнал. — 2006. — Vol. 106, no. 8. — P. 3317—3337. — doi:10.1021/cr0503153.
- Ljungdahl, L.C. The autotrophic pathway of acetate synthesis in acetogenic bacteria (англ.) // Annu. Rev. Microbiol. : журнал. — 1986. — Vol. 40. — P. 415-450.
- Ragsdale, S. W. Enzymology of the Wood-Ljungdahl pathway of acetogenesis. (англ.) // Ann. N. Y. Acad. Sci. : журнал. — 2008. — Vol. 1125. — P. 129-136.
- Ragsdale, S. W. and Pierce, E. Acetogenesis and the Wood-Ljungdahl pathway of CO2 fixation. (англ.) // Biochim. Biophys. Acta : журнал. — 2008. — Vol. 1784. — P. 1873-1898.
- Wood, H. G. Life with CO or CO2 and H2 as a source of carbon and energy. (англ.) // FASEB J. : журнал. — 1991. — Vol. 5. — P. 156-163.
- Fuchs, G. Variation of the acetyl-CoA pathway in diversely related microorganisms that are not acetogens (англ.) // Acetogenesis (Drake, G., Ed.) : книга. — 1994. — P. 506-538 Chapman and Hall, New York.
- Thauer, R.K., Jungermann, K., and Decker, K. Energy-conservation in chemotrophic anaerobic bacteria. (англ.) // Bacteriol. Rev. : журнал. — 1977. — Vol. 41. — P. 100-180.
- Paul A. Lindahl. Nickel-Carbon Bonds in Acetyl-Coenzyme A Synthases/Carbon Monoxide Dehydrogenases (англ.) // Metal Ions in Life Sciences : сборник / сост. Sigel A., Sigel H., Sigel R. K. O. — Royal Society of Chemistry, 2009. — 4 February (vol. 6). — P. 133—150. — ISBN 978-1-84755-915-9. — doi:10.1039/9781847559333-00133. — PMID 20877794.
- Roberts, J.R., W.-P. Lu, and Ragsdale, S.W. Acetyl-coenzyme A synthesis from methyltetrahydrofolate, CO, and coenzyme A by enzymes purified from Clostridium thermoaceticum: attainment of in vivo rates and identification of rate-limiting steps. (англ.) // J. Bacteriol. : журнал. — 1992. — Vol. 174. — P. 4667-4676.
- Ragsdale, S.W., and Kumar, M.,. Nickel-containing carbon monoxide dehydrogenase/acetyl-CoA synthase. (англ.) // Chem. Rev. : журнал. — 1996. — Vol. 96. — P. 2515-2539.
- Collins, M.D., Lawson, P.A., Cordoba, J.J., Fernandez-Garayzabal, J., Garsia, P., Cai, J., Hippe, H., Farrow, J.A.E. The phylogeny of the genus Clostridium: proposal of five new genera and eleven new species combinations. (англ.) // Int J Syst Bacteriol : журнал. — 1994. — Vol. 44. — P. 812-826.
- Matschiavelli N., Oelgeschläger E., Cocchiararo B., Finke J., Rother M. Function and Regulation of Isoforms of Carbon Monoxide Dehydrogenase/Acetyl Coenzyme A Synthase in Methanosarcina acetivorans (англ.) // Journal of Bacteriology : журнал. — 2012. — Vol. 194, no. 19. — P. 5377—5387. — doi:10.1128/JB.00881-12. — PMID 22865842.
- Jansen, K., Stupperich, E., Fuchs, G. Carbohydrate synthesys from acetyl CoA in the autotroph Methanobacterium thermoautotrophicum (англ.) // Archives of Microbiology : журнал. — 1982. — Vol. 132, no. 4. — P. 355—364.
- Strous, M., et al. Deciphering the evolution and metabolism of an anammox bacterium from a community genome. (англ.) // Nature : журнал. — 2006. — Vol. 440. — P. 790-794.
- Schauder, R., Preuß, A., Jetten, M., Fuchs, G. Oxidative and reductive acetyl CoA/carbon monoxide dehydrogenase pathway in Desulfobacterium autotrophicum – 2. Demonstration of the enzymes of the pathway and comparision of CO dehydrogenase. (англ.) // Arch. Microbiol. : журнал. — 1989. — Vol. 151. — P. 84-89. — doi:10.1007/BF00444674.
- Vorholt, J.A., Hafenbradl, D., Stetter, K.O., and Thauer, R.K. Pathways of autotrophic CO2 fixation and of dissimilatory nitrate reduction to N2O in Ferroglobus placidus. (англ.) // Arch. Microbiol. : журнал. — 1997. — Vol. 167. — P. 19-23.
- Vorholt, J.A., Kunow, J., Stetter, K.O., and Thauer, R.K. Enzymes and coenzymes of the carbon monooxide dehydrogenase pathway for autotrophic CO2 fixation in Archaeoglobus lithotrophicus and the lack of carbon monoxide dehydrogenase in the heterotrophic A. profundus. (англ.) // Arch. Microbiol. : журнал. — 1995. — Vol. 163. — P. 112-118.
- Takai, K., et al. Cell proliferation at 122 degrees C and isotopically heavy CH4 production by a hyperthermophilic methanogen under high-pressure cultivation. (англ.) // Proc. Natl. Acad. Sci. U.S.A. : журнал. — 2008. — Vol. 105. — P. 10949-10954.
- Fuchs, G. Alternative pathways of carbon dioxide fixation: insights into the early evolution of life? (англ.) // Annu. Rev. Microbiol. : журнал. — 2011. — Vol. 65. — P. 631-658. — doi:10.1146/annurev-micro-090110-102801.
- Rabus, R., Hansen, T.A., Widdel, F. Dissimilatory Sulfate- and Sulfur-reducing prokaryotes (англ.) // Prokaryotes : журнал. — 2006. — Vol. 2. — P. 659-768.
- Vorholt, J., Kunov, J., Stetter, K.O., Thauer, R.K. Enzymes and coenzymes oh the carbon monoxide dehydrogenase pathway for autotrophic CO2 fixation in Archaeoglobus lithotrophicus and the lack of carbon monoxide dehydrogenase in the heterotrophic A. profundus. (англ.) // Arch. Microbiol. : журнал. — 1995. — Vol. 163. — P. 112-118. — doi:10.1007/BF00381784.
- Hattori, S., Galushko, A.S., Kamagata, Y., Schink, B. Operation of the CO dehydrogenase/acetyl coenzyme A pathway in both acetate oxidation and acetate formation by the syntrophically acetate-oxidizing bacterium Thermacetogenium phaeum. (англ.) // J. Bacteriol. : журнал. — 2005. — Vol. 187. — P. 3471-3476. — doi:10.1128/JB.187.10.3471-3476.2005.
- Ljungdahl, L.G. The acetyl-CoA pathway and the chemiosmotic generation of ATP during acetogenesis. (англ.) // Drake HL (ed) Acetogenesis. Chapman and Hall, New York. — 1994. — P. 63-87.
- Biegel, E., and Müller, V.,. Bacterial Na+-translocating ferredoxin:NAD+ oxidoreductase (англ.) // Proc. Natl. Acad. Sci. U.S.A. : журнал. — 2010. — Vol. 107. — P. 18138-18142.
- Thauer, R.K., Kaster, A.K., Seedorf, H., Buckel, W. and Hedderich, R. Methanogenic archaea: ecologically relevant differences in energy conservation. (англ.) // Nat. Rev. Microbiol. : журнал. — 2008. — Vol. 6. — P. 579-591.
- Müller, V., Gottschalk, G. The sodium ion cycle in acetogenic and methanogenic bacteria: generation and utilization of a primary electrochemical sodium ion gradient (англ.) // Drake HL (ed) Acetogenesis. Chapman and Hall, New York. — 1994. — P. 127-156.
- Müller, V., Aufurth, S., Rahlfs, S. The Na+-cycle in Acetobacterium woodii: identification and characterization of a Na+-translocating F1F0-ATPase with a mixed oligomer of 8 and 16-kDa proteolipids. (англ.) // Biochim Biophys Acta : журнал. — 2001. — No. 1505. — P. 108-120.
- Spruth, M., Reidlinger, J., Müller, V. Sodium ion dependence of inhibition of the Na+-translocating F1F0-ATPase from Acetobacterium woodii: probing the site(s) involved in ion transport. (англ.) // Biochim Biophys Acta : журнал. — 1995. — No. 1229. — P. 96-102.
- Müller, V. Energy conservation in acetogenic bacteria (англ.) // Appl. Environ. Microbiol. : журнал. — 2003. — Vol. 69. — P. 6345-6353. — doi:10.1128/AEM.69.11.6345-6353.2003.
- Sousa, F.L., Thiergart, T., Landan, G., Nelson-Sathi, S., Pereira, I.A.C., Allen, J.F., et al. Early bioenegetic evolution. (англ.) // Philos.Trans. R. Soc. Lond. B Biol. Sci : журнал. — 2013. — Vol. 368. — P. 1-30. — doi:10.1098/rstb.2013.0088.
- Schopf, J.W., Hayes, J.M., Walter, M.R. Evolution of the earth’s earliest ecosystems: recent progress and unsolved problems. (англ.) // Schopf JW (ed) Earth’s earliest biosphere. Princeton University Press, Princeton. — 1983. — P. 361-384.
- Brock, T.D. Evolutionary relationships of the autotrophic bacteria. (англ.) // Schlegel HG, Bowien B (eds) Autotrophic bacteria. Science Tech, Madison. — 1989. — P. 499-512.
- Wood, H.G., Ljungdahl, L.G. Autotrophic character of the acetogenic bacteria. (англ.) // Shively JM, Barton LL (eds) Variations in autotrophic life. Academic, San Diego. — 1991. — P. 201-250.
- Lindahl, P.A., Chang, B. The evolution of acetyl-CoA synthase. (англ.) // Orig Life Evol Biosph. — 2001. — No. 31. — P. 403-434.
- M. C. Weiss , и др. The physiology and habitat of the last universal common ancestor (англ.) // Nature Microbiology : журнал. — 2016. — Vol. 16116, no. 1. — doi:10.1038/nmicrobiol.2016.116.. — PMID 27562259.
- Braakman, Rogier, Smith, Eric. The Emergence and Early Evolution of Biological Carbon-Fixation (англ.) // PLOS Computational Biology : журнал. — 2012-04-19. — Vol. 8, no. 4. — P. e1002455. — ISSN 1553-7358.. — doi:10.1371/journal.pcbi.1002455.
- Varma, Sreejith J., Muchowska, Kamila B., Chatelain, Paul, Moran, Joseph. Native iron reduces CO2 to intermediates and end-products of the acetyl-CoA pathway (англ.) // Nature Ecology & Evolution : журнал. — 2018-04-23. — ISSN 2397-334X.. — doi:10.1038/s41559-018-0542-2..
- Lindahl, P.A., Chang, B. The evolution of acetyl-CoA synthase. (англ.) // Orig Life Evol Biosph : журнал. — 2001. — No. 31. — P. 403-434.
Литература
- Соколова Т. Г. Термофильные гидрогеногенные карбоксидотрофные прокариоты : диссертация на соискание учёной степени доктора биологических наук. — М. : 2008. : 03.00.07. — 283 с.
- Wood HG. Life with CO or CO2 and H2 as a source of carbon and energy (англ.) // FASEB Journal : журнал. — 1991. — February (vol. 5, no. 2). — P. 156—163. — PMID 1900793.
- Diekert G., Wohlfarth G. Metabolism of homoacetogens (англ.) // Antonie Van Leeuwenhoek : журнал. — Kluwer Academic Publishers, 1994. — March (vol. 66, no. 1—3). — P. 209—221. — doi:10.1007/BF00871640. — PMID 7747932.