Липидные рафты
Липи́дные ра́фты — особые участки (микродомены) плазматической мембраны, обогащённые гликосфинголипидами и холестерином[1][2][3][4][5]. Эти участки координируют клеточные процессы, влияют на текучесть мембраны, служат организующими центрами для сборки сигнальных молекул, регулируют перемещение мембранных белков, рецепторов, а также регулируют нейротрансмиссию[5][6]. Липидные рафты более структурированы и упакованы плотнее, чем окружающий их липидный бислой; при этом они способны свободно в нём перемещаться[7].
История изучения
До 1982 года было широко распространено мнение, что фосфолипиды и мембранные белки распределены в клеточной мембране случайным образом — в соответствии с мозаичной моделью строения клеточной мембраны, предложенной в 1972 году С. Дж. Сингером и Г. Николсоном[6][8]. В модели предполагалось, что мембранные белки «плавают» в однородном липидном море[9].
Однако в 1970-х годах А. Штир и Э. Закман, а также М. Дж. Карновски с коллегами с использованием физических методов доказали существование особых мембранных микродоменов[10][11]. Существование этих микродоменов объяснялось физическими свойствами и организацией липидных смесей[12]. В 1974 году наблюдение влияния температуры на поведение мембраны позволило выдвинуть предположение о существовании в мембранах «кластеров липидов», а в 1975 году было открыто, что эти кластеры могут представлять собой «квазикристаллические» участки, располагающиеся внутри более жидких липидных областей. В 1978 году исследования с использованием метода рассеяния рентгеновских лучей дали новый толчок развитию идеи «кластеров» и позволили определить микродомены как «липиды в более упорядоченном состоянии». В 1982 году Карновски и его сотрудники сформулировали концепцию липидных доменов в мембране. Их исследования установили неоднородность во времени жизни флуоресценции молекул 1,6-дифенил-1,3,5-гексатриена, что свидетельствует о наличии нескольких липидных фаз в мембране[6]. Один тип таких микродоменов образован холестерином и сфинголипидами. Они формируются в результате выделения данных липидов в отдельную фазу, что было показано экспериментально[13]. Также было установлено, что такие микродомены («рафты») имеются и в клеточных мембранах[14].
В результате постепенно сформировалась новая концепция строения клеточной мембраны, отражающая динамическую реструктуризацию с формированием молекулярных высокоуровневых кластеров[9]. Термин «липидные рафты» был впервые предложен в 1988 году К. Симонсом и Г. ван Меером[15]. Они применили данный термин (англ. lipid raft ‘липидный плот’) к участкам плотно упакованного липида, плавающего на поверхности более текучего фосфолипида[9]. Первоначально концепция рафтов использовалась для объяснения транспорта холестерина из транс-отдела аппарата Гольджи в плазматическую мембрану. Эту идею впервые представили Симонс и Э. Иконен в 1997 году[16]. В 2006 году на Главном симпозиуме по липидным рафтам и клеточным функциям (англ. Keystone Symposium of Lipid Rafts and Cell Function) липидные рафты были определены как «небольшие (10—200 нм), гетерогенные, высоко динамичные домены, обогащенные стеролами и сфинголипидами, которые компартментализуют клеточные процессы. Небольшие рафты могут иногда объединяться в более крупные через белок-белковые взаимодействия». В последнее время было опубликовано много противоречивых работ, касающихся липидных рафтов; к числу спорных моментов можно отнести размер и время существования липидных рафтов (подробнее см. Споры вокруг липидных рафтов).
К настоящему моменту следующие вопросы о липидных рафтах остаются без ответов[6]:
- Какой эффект оказывают различия в содержании мембранных белков?
- Какова физиологическая роль липидных рафтов?
- Какой эффект на образование рафтов оказывает перемещение липидов?
- Какой эффект на липидные рафты оказывает питание и приём различных препаратов?
- Какое действие на липидные рафты оказывают белки, расположенные на их границе?
Основные свойства
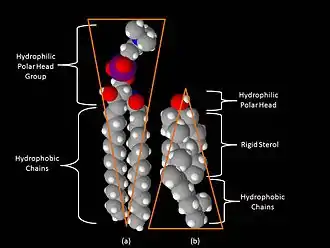
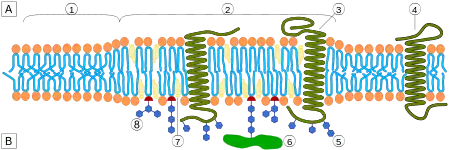
Одним из главных различий липидных рафтов и плазматической мембраны является их липидный состав. Исследования показали, что липидные рафты содержат в 3—5 раз больше холестерина, чем окружающий их липидный бислой[17]. Кроме того, липидные рафты обогащены сфинголипидами — например, сфингомиелином, содержание которого в липидных рафтах обычно на 50 % превышает таковое в плазматической мембране. Глицерофосфолипидов в рафтах практически нет[2]. Чтобы компенсировать повышенное содержание сфингомиелина, доля фосфатидилхолина в липидных рафтах снижена, в результате чего процент холин-содержащих липидов в них также почти на 50 % ниже по сравнению с окружающей мембраной. Холестерин предпочтительнее взаимодействует со сфинголипидами (хотя и не только с ними), что обусловлено их структурой и степенью насыщения их углеводородных цепочек. Хотя не все фосфолипиды в рафте полностью насыщены, их гидрофобные ацильные группировки более насыщены и упакованы плотнее, чем в липидах окружающего бислоя[6].
Холестерин служит динамическим «клеем», который скрепляет липиды рафта воедино[5] и заполняет все пустоты между ними. Из-за жёсткой природы стерольной группы холестерин предпочтительнее располагается в рафтах, где длинные насыщенные ацильные хвосты сфинголипидов могут образовывать более компактные и прочные связи с его кольцевой системой, чем более короткие и часто ненасыщенные хвосты фосфолипидов окружающего бислоя. По этой причине липидные рафты являются менее жидкими по сравнению с остальным бислоем[2].
Некоторые исследователи связывают возникновение рафтов в модельных мембранах с разделением мембраны на упорядоченную (Lo-фаза) и неупорядоченную (Ld-, или Lα-фаза) жидкие фазы[18]. Причины такого разделения на фазы неясны, однако их несмешиваемость, по-видимому, сводит к минимуму свободную энергию этих двух фаз. Показано, что липидные рафты и окружающая мембрана имеют различную толщину по причине того, что углеводородные цепи у сфинголипидов более длинные и прямые, чем у других липидов мембраны[1]. Это приводит к тому, что гидрофобные слои рафтов и остального бислоя не стыкуются друг с другом на границе двух фаз. Было установлено, что такое различие в толщине увеличивает поверхностное натяжение на границе разделения двух фаз, в результате чего возникают более крупные рафты с округлыми границами, и тем самым затраты энергии на поддержание рафтов как отдельных фаз сводятся к минимуму. Другие спонтанные события — такие, как изгиб мембраны или слияние мелких рафтов в более крупные — могут также минимизировать натяжение на границе разделения фаз[6].
Из-за своего строения и устойчивости к действию неионных детергентов[2] — таких, как Triton X-100 или Brij-98 — липидные рафты также называют детергент-нерастворимыми комплексами, обогащёнными гликолипидами (англ. detergent-insoluble glycolipid-enriched complexes (GEMs) or DIGs)[19] или детергент-устойчивыми мембранами (англ. Detergent Resistant Membranes (DRMs)). Это свойство липидных рафтов можно использовать для того, чтобы оценить долю поверхности клетки, занятой рафтами, по фракции, устойчивой к солюбилизации детергентами. В некоторых случаях она может составлять 50 %. Косвенные измерения размеров рафтов позволяют грубо оценить диаметр одного рафта в 50 нм[20] (впрочем, на этот счёт есть и другие мнения, см. Споры вокруг липидных рафтов).
Липидные рафты чрезвычайно обогащены интегральными мембранными белками двух классов: одни заякорены в мембране при помощи двух ковалентно связанных с этими белками длинноцепочечных насыщенных жирных кислот (две пальмитоильные или пальмитоильная и миристоильная группы), а другие — посредством гликозилфосфатидилинозитольного (GPI-) якоря. Между белками рафта и остального бислоя происходит постоянный обмен: мембранные белки могут заходить внутрь рафтов и выходить наружу за время порядка нескольких секунд. Стоит отметить, что для процесса, в котором взаимодействуют два мембранных белка, их одновременное присутствие в одном и том же рафте очень сильно увеличивает вероятность их столкновения. Поэтому некоторые мембранные рецепторы и сигнальные белки обособляются вместе именно в мембранных рафтах, причём передачу сигнала через эти белки можно прервать с помощью манипуляций, которые выводят холестерин из мембраны и разрушают рафты; таким образом, липидные рафты принимают участие во многих сигнальных путях клетки[20].
Типы липидных рафтов
Предполагают существование двух типов липидных рафтов: планарные (также известные как некавеолярные, или гликолипидные рафты) и кавеолярные липидные рафты. Планарные липидные рафты лежат в плоскости плазматической мембраны (не образуют впячиваний) и не имеют отличительных морфологических особенностей. Кавеолярные рафты, напротив, формируют в плазматической мембране колбообразные впячивания, содержащие белок кавеолин, который входит в состав особых углублений мембраны — кавеол; большинство наблюдаемых рафтов относятся к этому типу. Кавеолины интенсивно экспрессируются в мозге, микрососудах нервной системы, эндотелиальных клетках, астроцитах, олигодендроцитах, шванновских клетках, спинальных ганглиях и нейронах гиппокампа. Планарные рафты содержат белок флотиллин и встречаются в нейронах, лишённых кавеол. Оба типа рафтов имеют сходный липидный состав (обогащены холестерином и сфинголипидами). Флотиллин и кавеолин обладают способностью рекрутировать сигнальные молекулы к липидным рафтам, тем самым играя важную роль в передаче сигналов, опосредованной нейромедиаторами. Было высказано предположение, что эти микродомены отвечают за такую пространственную организацию сигнальных молекул, которая способствует кинетически выгодным взаимодействиям, необходимым для передачи сигнала. Впрочем, эти же микродомены и разделяют сигнальные молекулы, подавляя ненужные взаимодействия и приводя к затуханию сигнала[21].
Роль в передаче сигналов
Термин «передача сигнала» относится к любому процессу, при помощи которого клетка превращает один тип сигнала или стимула в другой. Путь сигнала или стимула может быть простым, как в случае с молекулами рецепторов. Более сложная передача сигнала включает участие комплексов лиганд-рецептор во многих внутриклеточных процессах, например, фосфорилирование тирозинкиназами или серин-треонинкиназами[22]. Специфичность и точность передачи сигнала необходимы для эффективного ответа клетки на изменения окружающей среды. Отчасти это достигается при помощи различной локализации белков, участвующих в сигнальных путях. В плазматической мембране отчасти такую компартментализацию осуществляют липидные рафты[23].
Одним из важных доказательств в пользу существования липидных рафтов является их работа как платформ, на которых концентрируются отдельные рецепторы после активации при связывании с лигандом[24]. Если же активация рецептора происходит в самом липидном рафте, то сигнальный комплекс оказывается защищённым рафтом от внешних ферментов, например, мембранных фосфатаз. В общем, липидные рафты привлекают белки в новую микросреду, так что их (де)фосфорилированное состояние может быть изменено локальными киназами и фосфатазами и дать начало последующим реакциям сигнального пути[25]. Было установлено, что липидные рафты участвуют во многих сигнальных путях — например, сигнальном пути иммуноглобулина Е, Т- и В-клеточных антигеновых рецепторов, рецептора эпидермального фактора роста (EGF), инсулинового рецептора и др. Некоторые примеры таких сигнальных путей приведены ниже.
Сигнальный путь иммуноглобулина E
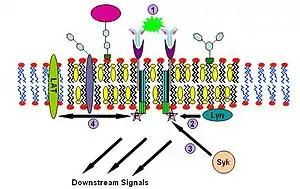
1. Соединение нескольких рецепторов FcεR.
2. Рекрутирование киназы Lyn и фосфорилирование ITAM.
3. Связывание киназы Syk с рецепторным комплексом.
4. Киназа Syk связывает и активирует другие белки, включая LAT и др., что запускает сигнальный каскад.
Изучение сигнального пути иммуноглобулина Е (IgE) впервые убедительно продемонстрировало участие липидных рафтов в передаче сигнала[26][27][28]. Доказательствами участия липидных рафтов в этом процессе служат сниженная растворимость Fc-эпсилон рецепторов (FcεR) в детергенте Triton X-100 при переходе от одиночного состояния к связанному поперечными сшивками с другим рецептором того же типа[26]; формирование скоплений из ганглиозидов и GPI-заякоренных белков, достаточно больших для того, чтобы быть различимыми в флуоресцентный микроскоп[29][30]; прекращение работы пути при удалении поверхностного холестерина при помощи метил-β-циклодекстрина[31] и др.
Последовательность событий этого сигнального пути такова. Сначала IgE связывается с Fc-эпсилон рецепторами, находящимися в плазматических мембранах тучных клеток и базофилов, через их Fc-сегмент. Тетрамер FcεR состоит из одной α-, одной β- и двух γ-цепей[28]. Сначала один тетрамер FcεR связывается с одной молекулой IgE. С IgE связывается α-цепь, а три другие цепи содержат активационный тирозиновый мотив иммунных рецепторов (англ. immune receptor tyrosine-based activation motifs (ITAM)). Далее олигомерный антиген связывается с несколькими молекулами IgE, уже связанным к тому моменту с FcεR, сшивая вместе два или более рецепторных комплексов. После такого соединения для фосфорилирования ITAM двух рецепторов привлекается дважды ацетилированная нерецепторная Src-подобная тирозинкиназа Lyn. Далее тирозинкиназа семейства Syk связывается с фосфотирозиновыми остатками ITAM (результат работы Lyn) и начинает сигнальный каскад[26][27]. Syk, в свою очередь, может активировать другие белки, например, LAT. Белки LAT, связываясь друг с другом, могут рекрутировать в рафт другие белки и дополнительно амплифицировать (усиливать) сигнал[32].
Сигнальный путь Т-клеточного антигенового рецептора

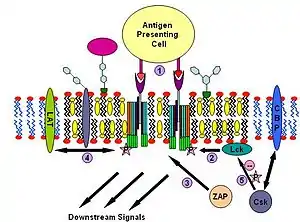
Т-клеточный антигеновый рецептор (TCR) — это молекула, имеющаяся на поверхности Т-лимфоцитов (Т-клеток). Он включает в себя αβ-гетеродимер, CD3- (γδε) комплекс и ξ-гомодимер. α- и β-субъединицы содержат внеклеточные сайты связывания для пептидов, которые представлены на белках главного комплекса гистосовместимости (МНС) I и II классов, расположенных на поверхности антигенпрезентирующих клеток (APC). CD3- и ξ-субъединицы содержат цитоплазматические мотивы ITAM. При передаче сигнала молекулы MHC связываются с TCR, соединяя два или более рецептора вместе. Такое соединение рецепторов, как и в сигнальном пути IgE, рекрутирует дважды ацетилированные нерецепторные Src-подобные тирозинкиназы для фосфорилирования мотивов ITAM. TCR привлекает не только тирозинкиназу Lyn, но и Fyn[23][33]. После этого белок ZAP-70, не участвующий в сигнальном пути IgE, связывается с фосфорилированными ITAM, благодаря чему активируется сам и активирует LAT. Активация LAT даёт амплификацию сигнала. Другое отличие сигнального пути TCR от сигнального пути IgE заключается в том, что TCR активируют белок Lck, что может приводить к более сильной кластеризации рафтов[34][35] и тем самым дополнительно усиливать сигнал. Одним из возможных механизмов отрицательной регуляции этого пути может быть связывание цитозольной киназы Csk с ассоциированным с рафтами белком CBP. После этого Csk может подавлять работу киназ семейства Src через фосфорилирование[36].
Сигнальный путь В-клеточного антигенового рецептора
В-клеточный антигеновый рецептор (BCR) представляет собой комплекс мембранносвязанной молекулы иммуноглобулина (mIg) и гетеродимера Igα-Igβ, состоящего из двух полипептидов, которые связаны друг с другом дисульфидными связями[37]. И Igα, и Igβ содержат мотив ITAM.
Сигнальный путь BCR схож с сигнализацией IgE и TCR. Широко распространено мнение, что, помимо действия через BCR, липидные рафты могут принимать участие во многих событиях, происходящих на поверхности В-клетки при её активации. К функциям липидных рафтов в В-клетках относится их участие в сигнальном пути BCR, модуляция работы сигнальных путей при помощи корецепторов, сигнальные пути CD40, эндоцитоз пептидных антигенов, связанных с BCR, и их последующая загрузка в ранние эндосомы (пептиды, образующиеся при разрушении пептидного антигена ферментами эндосом, в дальнейшем будут выставлена на поверхности клетки в комплексе с молекулами MHC II и презентированы Т-клеткам)[37].
Липидные рафты как платформы для проникновения вирусов в клетку
Для проникновения в клетку вирусов, облигатных внутриклеточных паразитов, необходимо специфическое взаимодействие вируса и клеточных рецепторов на плазматической мембране. Накапливаются подтверждения того, что вирусы попадают в клетку через специфические мембранные микродомены, в том числе липидные рафты.
Вирусы без оболочки
Наиболее хорошо изученными примерами проникновения в клетку через липидные рафты вирусов, не имеющих оболочки, являются вирус обезьян SV40 (сем. Papovaviridae) и эховирус I типа (EV1, сем. Picornaviridae)[38][39].
Для проникновения в клетку SV40 использует два различных рецептора: ганглиозид GM1, располагающийся в липидных рафтах, и молекулу MHC I типа[38]. Связывание SV40 с молекулой MHC I типа вызывает кластеризацию и перераспределение рецепторов. SV40 может привлечь к себе больше кавеол из цитоплазмы и даже вызвать образование новых кавеол в месте проникновения. Сигнальный каскад, запускаемый при присоединении вируса к клетке, приводит к опосредованному кавеолами эндоцитозу вируса в течение 20 минут. В некоторых типах клеток вирус может проникать в кавеосомы (отпочковавшиеся от мембраны кавеолы) непосредственно из неокаймлённых везикул, отпочковавшихся от липидных рафтов[39][40].
EV1 в качестве клеточного рецептора использует интегрин α2β1. Множество интегриновых гетеродимеров может связываться с соседними участками на капсиде вируса. Как и в случае с SV40, прикрепление вируса и его связывание с клеткой запускает кластеризацию и перемещение молекул интегрина из липидных рафтов в кавеолоподобные структуры. При удалении холестерина из липидных рафтов эховирусная инфекция не развивается[38][39].
Существуют также вирусы, которые используют некавеолярный эндоцитоз, опосредованный рафтами, например, эховирус 11 (EV11, сем. Picornaviridae), однако детальный механизм этих процессов ещё не изучен[39].
Вирусы с оболочкой
Вирусы гриппа связываются с клеточным рецептором — сиаловой кислотой, которая присоединена к гликоконъюгату, инициирующему эндоцитоз. После переноса вируса в поздние эндосомы из-за низкого значения pH происходит изменение конформации вирусного гемагглютинина (HA), после чего липидная оболочка вируса сливается с мембраной эндосомы, и вирусные рибонуклеопротеиновые комплексы высвобождаются в цитоплазму. Этот выход запускается потоком протонов через вирусный протонный канал М2, для работы которого необходимо связывание с холестерином. Для проникновения в клетку вирус леса Семлики (SFV, сем. Togaviridae) и вирус Синдбис (SIN, сем. Togaviridae) используют холестерин и сфинголипиды и задействуют липидные рафты для слияния их липидной оболочки с мембраной, опосредованного содержащимся в их оболочке гликопротеином, и последующего попадания в цитоплазму[41]. Т-лимфотропный вирус человека I типа (HTLV-1, сем. Retroviridae) попадает в клетку через глюкозный транспортер 1 (GLUT1). Вирус Эбола и вирус Марбург используют в качестве клеточного рецептора фолатный рецептор-α (FRα), являющийся GPI-заякоренным белком. Вирус гепатита B распознает человеческий рецептор комплемента 2-го типа (CR2, или CD21). Человеческий вирус герпеса 6 типа (HHV-6) связывается с рецептором CD46 на поверхности клетки. Все эти клеточные рецепторы располагаются в липидных рафтах или перемещаются туда при инфекции.
Вирус иммунодефицита человека (ВИЧ), передающийся половым путём, для проникновения в организм хозяина должен преодолеть барьер эпителиальных клеток, которые не экспрессируют рецептор CD4 или рецепторы хемокинов (эти рецепторы часто используются для попадания в клетку). Альтернативным рецептором для гликопротеина оболочки ВИЧ на эпителиальных клетках является гликосфинголипид галактозилцерамид (GalCer), которым изобилуют липидные рафты[42][43].
Методы изучения
Одной из причин многочисленных противоречий, возникших вокруг липидных рафтов, является сложность их изучения в живых клетках, которые не находятся в термодинамическом равновесии[21]. Липидные рафты представляют собой маленькие микродомены размером 10—200 нм[6]. Поскольку их размер находится за дифракционным пределом светового микроскопа, визуализировать липидные рафты непосредственно чрезвычайно сложно. В настоящий момент исследуются искусственные мембраны, однако их использование имеет массу недостатков. Во-первых, содержание белков в искусственных мембранах значительно меньше такового в биологических мембранах. Во-вторых, сложно смоделировать взаимодействия мембраны и цитоскелета, которые имеют место в биомембранах. В-третьих, искусственные мембраны лишены естественной асимметрии, и их невозможно изучать в неравновесном состоянии[6][44].
Другой интенсивно используемый метод изучения липидных рафтов — флуоресцентная микроскопия. Например, широко используются флуорофоры, связанные с В-субъединицей холерного токсина, который связывается с обязательной составляющей рафтов — ганглиозидом GM1. Также используются липофильные мембранные красители, которые либо встраиваются между рафтами и остальной мембраной, либо изменяют свои флуоресцентные свойства в зависимости от фазы мембраны. Примером таких красителей может служить часто используемый лаурдан. Рафты также можно пометить с помощью экспрессии флуоресцентно-меченных белков — например, Lck-GFP.
Секвестрация холестерина с помощью филипина, нистатина и амфотерицина В, удаление с помощью метил-В-циклодекстрина, подавление его синтеза с помощью ингибиторов HGM-СоА-редуктазы служат примерами таких методов. Они позволяют пронаблюдать за изменениями передачи сигналов нейромедиаторами при уменьшении уровня холестерина в мембране[21].
При использовании визуализации с высоким разрешением и математического моделирования было показано, что белки липидных рафтов собраны в нанокластеры высокой плотности радиусом 5—20 нм. Используя измерение резонансного переноса энергии флоуресценции (англ. fluorescence resonance energy transfer, FRET) между одними и теми же пробами (гомо-FRET или флуоресцентная анизотропия), Шарма и коллеги заключили, что часть (20—40 %) GPI-заякоренных белков организована в кластеры высокой плотности и радиусом 4—5 нм[45]. В настоящее время для преодоления проблемы малого размера и динамической природы липидных рафтов всё чаще используется наблюдение за движением отдельных частиц и молекул при помощи охлаждённых, чувствительных ПЗС-камер и микроскопии с полным внутренним отражением (TIRF). Эта техника позволяет получить информацию о способности частиц диффундировать в исследуемой мембране, а также выявить на этой мембране зоны с ограниченной диффузией и барьеры для диффузии[46].
Используются и другие оптические техники. Например, флуоресцентная корреляционная спектроскопия и взаимнокорелляционная спектроскопия (англ. Fluorescence Correlation and Cross-Correlation Spectroscopy (FCS/FCCS)) могут применяться для получения информации о подвижности флуорофора в мембране. С помощью техники FRET (англ. Fluorescence Resonance Energy Transfer) можно определить, когда флуорофоры находятся в непосредственной близости, а техники с применением оптических пинцетов могут дать информацию о вязкости мембраны[21].
Для изучения липидных рафтов также используют атомно-силовая микроскопия, сканирующая ион-проводящая микроскопия (англ. Scanning Ion Conductance Microscopy (SICM)), двуполяризационная интерферометрия, ядерный магнитный резонанс; однако флуоресцентная микроскопия по-прежнему выступает доминирующей техникой изучения липидных рафтов. Есть надежды, что в будущем микроскопия со сверхразрешением (например, STED-микроскопия[47]) и различные формы структурированной иллюминационной микроскопии помогут преодолеть проблемы, вызванные дифракционным ограничением.
Кроме того, для работы с рафтами используются иммуноферментный анализ (ELISA), вестерн-блоттинг и флуоресцентно-активированная сортировка клеток (FACS)[48][49][3].
Споры вокруг липидных рафтов
Роль рафтов во внутриклеточной передаче сигналов, метаболизме и поддержании структуры клетки ещё не полностью определена, несмотря на множество проведенных экспериментов, использующих различные методы, и даже само существование липидных рафтов ставится под вопрос[50].
Против существования липидных рафтов свидетельствуют следующие аргументы:
- Во-первых, между Lα- и Lo-фазами должно существовать линейное натяжение, а значит, и граница фаз. Такая граница, действительно, наблюдается в модельных мембранах, но не в клеточных системах.
- Во-вторых, не существует единого мнения относительно размеров рафта, причём возможные их значения в разных работах оцениваются от 1 до 1000 нм.
- В-третьих, время существования рафтов неизвестно. Если они существуют, то время их существования может не соответствовать временной шкале биологических процессов.
- В-четвёртых, вся мембрана может существовать в Lo-фазе.
Первое опровержение последнего пункта — Lo-фаза рафта более плотная из-за межмолекулярных водородных связей между молекулами сфинголипидов и холестерина, причём эти связи не образуются в других местах[51].
Второй аргумент против существования липидных рафтов обусловлен эффективностью разрушения липидных рафтов при исследованиях. Удаление холестерина из рафтов может иметь негативные последствия для достоверности дальнейших результатов о функциях рафтов[52]. Большинство исследователей использовало жёсткие методы удаления холестерина из мембран, которые разрушали не только рафты, но и другой мембранный фосфолипид — фосфатидилинозитол-4,5-бисфосфат (PI(4,5)P2). Данный фосфолипид играет важную роль в регуляции цитоскелета[53], и его разрушение может привести к тем результатам, которые обычно объясняют удалением холестерина, в том числе латеральную диффузию белков в мембране[54]. Так как наиболее часто используемые методы разрушают и рафты, и PI(4,5)P2, то влияние удаления холестерина на определённый процесс не может быть отнесено только лишь к разрушению рафтов, поскольку могут быть затронуты и многие процессы, не связанные с рафтами. Наконец, хотя сейчас предполагается, что рафты каким-то образом присоединены к белкам, некоторые исследователи считают, что белки могут привлекаться в рафт только за счёт взаимодействия с ацильными хвостами липидов, которые скрыты внутри мембраны, и никак иначе[55].
Примечания
- Альбертс и др., 2013, с. 964.
- Нельсон, Кокс, 2011, с. 543.
- Thomas S., Preda-Pais A., Casares S., Brumeanu T. D. Analysis of lipid rafts in T cells. (англ.) // Molecular immunology. — 2004. — Vol. 41, no. 4. — P. 399—409. — doi:10.1016/j.molimm.2004.03.022. — PMID 15163537.
- Thomas S., Kumar R. S., Brumeanu T. D. Role of lipid rafts in T cells. (англ.) // Archivum immunologiae et therapiae experimentalis. — 2004. — Vol. 52, no. 4. — P. 215—224. — PMID 15467486.
- Korade Z., Kenworthy A. K. Lipid rafts, cholesterol, and the brain. (англ.) // Neuropharmacology. — 2008. — Vol. 55, no. 8. — P. 1265—1273. — doi:10.1016/j.neuropharm.2008.02.019. — PMID 18402986.
- Pike L. J. The challenge of lipid rafts. (англ.) // Journal of lipid research. — 2009. — Vol. 50 Suppl. — P. 323—328. — doi:10.1194/jlr.R800040-JLR200. — PMID 18955730.
- Simons K., Ehehalt R. Cholesterol, lipid rafts, and disease. (англ.) // The Journal of clinical investigation. — 2002. — Vol. 110, no. 5. — P. 597—603. — doi:10.1172/JCI16390. — PMID 12208858.
- Singer S. J., Nicolson G. L. The fluid mosaic model of the structure of cell membranes. (англ.) // Science (New York, N.Y.). — 1972. — Vol. 175, no. 4023. — P. 720—731. — PMID 4333397.
- Веснина Л. Э. Липидные рафты: роль в регуляции функционального состояния клеточных мембран // Актуальні проблеми сучасної медицини. — 2013. — Т. 13, вип. 2 (42). — С. 5—10.
- Stier A., Sackmann E. Spin labels as enzyme substrates. Heterogeneous lipid distribution in liver microsomal membranes. (англ.) // Biochimica et biophysica acta. — 1973. — Vol. 311, no. 3. — P. 400—408. — PMID 4354130.
- Karnovsky M. J., Kleinfeld A. M., Hoover R. L., Klausner R. D. The concept of lipid domains in membranes. (англ.) // The Journal of cell biology. — 1982. — Vol. 94, no. 1. — P. 1—6. — PMID 6889603.
- Israelachvili J. N., Marcelja S., Horn R. G. Physical principles of membrane organization. (англ.) // Quarterly reviews of biophysics. — 1980. — Vol. 13, no. 2. — P. 121—200. — PMID 7015403.
- Estep T. N., Mountcastle D. B., Barenholz Y., Biltonen R. L., Thompson T. E. Thermal behavior of synthetic sphingomyelin-cholesterol dispersions. (англ.) // Biochemistry. — 1979. — Vol. 18, no. 10. — P. 2112—2117. — PMID 435470.
- Goodsaid-Zalduondo F., Rintoul D. A., Carlson J. C., Hansel W. Luteolysis-induced changes in phase composition and fluidity of bovine luteal cell membranes. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1982. — Vol. 79, no. 14. — P. 4332—4336. — PMID 6956862.
- Simons K., van Meer G. Lipid sorting in epithelial cells. (англ.) // Biochemistry. — 1988. — Vol. 27, no. 17. — P. 6197—6202. — PMID 3064805.
- Simons K., Ikonen E. Functional rafts in cell membranes. (англ.) // Nature. — 1997. — Vol. 387, no. 6633. — P. 569—572. — doi:10.1038/42408. — PMID 9177342.
- Anchisi L., Dessì S., Pani A., Mandas A. Cholesterol homeostasis: a key to prevent or slow down neurodegeneration. (англ.) // Frontiers in physiology. — 2012. — Vol. 3. — P. 486. — doi:10.3389/fphys.2012.00486. — PMID 23316166.
- Rietveld A., Simons K. The differential miscibility of lipids as the basis for the formation of functional membrane rafts. (англ.) // Biochimica et biophysica acta. — 1998. — Vol. 1376, no. 3. — P. 467—479. — PMID 9805010.
- Fivaz M., Abrami L., van der Goot F. G. Landing on lipid rafts. (англ.) // Trends in cell biology. — 1999. — Vol. 9, no. 6. — P. 212—213. — PMID 10354632.
- Нельсон, Кокс, 2011, с. 545.
- Allen J. A., Halverson-Tamboli R. A., Rasenick M. M. Lipid raft microdomains and neurotransmitter signalling. (англ.) // Nature reviews. Neuroscience. — 2007. — Vol. 8, no. 2. — P. 128—140. — doi:10.1038/nrn2059. — PMID 17195035.
- King, Michael W. Mechanisms of Signal Transduction (February 10, 2013).
- Janes P. W., Ley S. C., Magee A. I., Kabouridis P. S. The role of lipid rafts in T cell antigen receptor (TCR) signalling. (англ.) // Seminars in immunology. — 2000. — Vol. 12, no. 1. — P. 23—34. — doi:10.1006/smim.2000.0204. — PMID 10723795.
- Schmitz G., Grandl M. Update on lipid membrane microdomains. (англ.) // Current opinion in clinical nutrition and metabolic care. — 2008. — Vol. 11, no. 2. — P. 106—112. — doi:10.1097/MCO.0b013e3282f44c2c. — PMID 18301084.
- Simons K., Toomre D. Lipid rafts and signal transduction. (англ.) // Nature reviews. Molecular cell biology. — 2000. — Vol. 1, no. 1. — P. 31—39. — doi:10.1038/35036052. — PMID 11413487.
- Field K. A., Holowka D., Baird B. Fc epsilon RI-mediated recruitment of p53/56lyn to detergent-resistant membrane domains accompanies cellular signaling. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1995. — Vol. 92, no. 20. — P. 9201—9205. — PMID 7568101.
- Sheets E. D., Holowka D., Baird B. Membrane organization in immunoglobulin E receptor signaling. (англ.) // Current opinion in chemical biology. — 1999. — Vol. 3, no. 1. — P. 95—99. — PMID 10021405.
- Baird B., Sheets E. D., Holowka D. How does the plasma membrane participate in cellular signaling by receptors for immunoglobulin E? (англ.) // Biophysical chemistry. — 1999. — Vol. 82, no. 2-3. — P. 109—119. — PMID 10631794.
- Stauffer T. P., Meyer T. Compartmentalized IgE receptor-mediated signal transduction in living cells. (англ.) // The Journal of cell biology. — 1997. — Vol. 139, no. 6. — P. 1447—1454. — PMID 9396750.
- Holowka D., Sheets E. D., Baird B. Interactions between Fc(epsilon)RI and lipid raft components are regulated by the actin cytoskeleton. (англ.) // Journal of cell science. — 2000. — Vol. 113 ( Pt 6). — P. 1009—1019. — PMID 10683149.
- Sheets E. D., Holowka D., Baird B. Critical role for cholesterol in Lyn-mediated tyrosine phosphorylation of FcepsilonRI and their association with detergent-resistant membranes. (англ.) // The Journal of cell biology. — 1999. — Vol. 145, no. 4. — P. 877—887. — PMID 10330413.
- Goitsuka R., Kanazashi H., Sasanuma H., Fujimura Y., Hidaka Y., Tatsuno A., Ra C., Hayashi K., Kitamura D. A BASH/SLP-76-related adaptor protein MIST/Clnk involved in IgE receptor-mediated mast cell degranulation. (англ.) // International immunology. — 2000. — Vol. 12, no. 4. — P. 573—580. — PMID 10744659.
- Langlet C., Bernard A. M., Drevot P., He H. T. Membrane rafts and signaling by the multichain immune recognition receptors. (англ.) // Current opinion in immunology. — 2000. — Vol. 12, no. 3. — P. 250—255. — PMID 10781401.
- Zhang W., Trible R. P., Samelson L. E. LAT palmitoylation: its essential role in membrane microdomain targeting and tyrosine phosphorylation during T cell activation. (англ.) // Immunity. — 1998. — Vol. 9, no. 2. — P. 239—246. — PMID 9729044.
- Brdiĉka T., Cerný J., Horejŝí V. T cell receptor signalling results in rapid tyrosine phosphorylation of the linker protein LAT present in detergent-resistant membrane microdomains. (англ.) // Biochemical and biophysical research communications. — 1998. — Vol. 248, no. 2. — P. 356—360. — PMID 9675140.
- Cary L. A., Cooper J. A. Molecular switches in lipid rafts. (англ.) // Nature. — 2000. — Vol. 404, no. 6781. — P. 945—947. — doi:10.1038/35010257. — PMID 10801110.
- Gupta N., DeFranco A. L. Lipid rafts and B cell signaling. (англ.) // Seminars in cell & developmental biology. — 2007. — Vol. 18, no. 5. — P. 616—626. — doi:10.1016/j.semcdb.2007.07.009. — PMID 17719248.
- Chazal N., Gerlier D. Virus entry, assembly, budding, and membrane rafts. (англ.) // Microbiology and molecular biology reviews : MMBR. — 2003. — Vol. 67, no. 2. — P. 226—237. — PMID 12794191.
- Pietiäinen V. M., Marjomäki V., Heino J., Hyypiä T. Viral entry, lipid rafts and caveosomes. (англ.) // Annals of medicine. — 2005. — Vol. 37, no. 6. — P. 394—403. — doi:10.1080/07853890510011976. — PMID 16203612.
- Rajendran L., Simons K. Lipid rafts and membrane dynamics. (англ.) // Journal of cell science. — 2005. — Vol. 118, no. Pt 6. — P. 1099—1102. — doi:10.1242/jcs.01681. — PMID 15764592.
- Rawat S. S., Viard M., Gallo S. A., Rein A., Blumenthal R., Puri A. Modulation of entry of enveloped viruses by cholesterol and sphingolipids (Review). (англ.) // Molecular membrane biology. — 2003. — Vol. 20, no. 3. — P. 243—254. — doi:10.1080/0968768031000104944. — PMID 12893532.
- Campbell S. M., Crowe S. M., Mak J. Lipid rafts and HIV-1: from viral entry to assembly of progeny virions. (англ.) // Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. — 2001. — Vol. 22, no. 3. — P. 217—227. — PMID 11564586.
- Alving C. R., Beck Z., Karasavva N., Matyas G. R., Rao M. HIV-1, lipid rafts, and antibodies to liposomes: implications for anti-viral-neutralizing antibodies. (англ.) // Molecular membrane biology. — 2006. — Vol. 23, no. 6. — P. 453—465. — doi:10.1080/09687860600935348. — PMID 17127618.
- Jacobson K., Mouritsen O. G., Anderson R. G. Lipid rafts: at a crossroad between cell biology and physics. (англ.) // Nature cell biology. — 2007. — Vol. 9, no. 1. — P. 7—14. — doi:10.1038/ncb0107-7. — PMID 17199125.
- Sharma P., Varma R., Sarasij R. C., Ira, Gousset K., Krishnamoorthy G., Rao M., Mayor S. Nanoscale organization of multiple GPI-anchored proteins in living cell membranes. (англ.) // Cell. — 2004. — Vol. 116, no. 4. — P. 577—589. — PMID 14980224.
- Ritchie K., Shan X. Y., Kondo J., Iwasawa K., Fujiwara T., Kusumi A. Detection of non-Brownian diffusion in the cell membrane in single molecule tracking. (англ.) // Biophysical journal. — 2005. — Vol. 88, no. 3. — P. 2266—2277. — doi:10.1529/biophysj.104.054106. — PMID 15613635.
- Eggeling C., Ringemann C., Medda R., Schwarzmann G., Sandhoff K., Polyakova S., Belov V. N., Hein B., von Middendorff C., Schönle A., Hell S. W. Direct observation of the nanoscale dynamics of membrane lipids in a living cell. (англ.) // Nature. — 2009. — Vol. 457, no. 7233. — P. 1159—1162. — doi:10.1038/nature07596. — PMID 19098897.
- Thomas S., Kumar R. S., Casares S., Brumeanu T. D. Sensitive detection of GM1 lipid rafts and TCR partitioning in the T cell membrane. (англ.) // Journal of immunological methods. — 2003. — Vol. 275, no. 1-2. — P. 161—168. — PMID 12667680.
- Thomas S., Kumar R., Preda-Pais A., Casares S., Brumeanu T. D. A model for antigen-specific T-cell anergy: displacement of CD4-p56(lck) signalosome from the lipid rafts by a soluble, dimeric peptide-MHC class II chimera. (англ.) // Journal of immunology (Baltimore, Md. : 1950). — 2003. — Vol. 170, no. 12. — P. 5981—5992. — PMID 12794125.
- Munro S. Lipid rafts: elusive or illusive? (англ.) // Cell. — 2003. — Vol. 115, no. 4. — P. 377—388. — PMID 14622593.
- Barenholz Y. Sphingomyelin and cholesterol: from membrane biophysics and rafts to potential medical applications. (англ.) // Sub-cellular biochemistry. — 2004. — Vol. 37. — P. 167—215. — PMID 15376621.
- Pike L. J., Miller J. M. Cholesterol depletion delocalizes phosphatidylinositol bisphosphate and inhibits hormone-stimulated phosphatidylinositol turnover. (англ.) // The Journal of biological chemistry. — 1998. — Vol. 273, no. 35. — P. 22298—22304. — PMID 9712847.
- Caroni P. New EMBO members' review: actin cytoskeleton regulation through modulation of PI(4,5)P(2) rafts. (англ.) // The EMBO journal. — 2001. — Vol. 20, no. 16. — P. 4332—4336. — doi:10.1093/emboj/20.16.4332. — PMID 11500359.
- Kwik J., Boyle S., Fooksman D., Margolis L., Sheetz M. P., Edidin M. Membrane cholesterol, lateral mobility, and the phosphatidylinositol 4,5-bisphosphate-dependent organization of cell actin. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 2003. — Vol. 100, no. 24. — P. 13964—13969. — doi:10.1073/pnas.2336102100. — PMID 14612561.
- Edidin M. The state of lipid rafts: from model membranes to cells. (англ.) // Annual review of biophysics and biomolecular structure. — 2003. — Vol. 32. — P. 257—283. — doi:10.1146/annurev.biophys.32.110601.142439. — PMID 12543707.
Литература
- Альбертс Б., Джонсон А., Льюис Д. и др. Молекулярная биология клетки / Пер. с англ. А. Н. Дьяконовой, А. В. Дюбы и А. А. Светлова. Под ред. Е. С. Шилова, Б. П. Копнина, М. А. Лагарьковой, Д. В. Купраша. — М.—Ижевск: НИЦ «Регулярная и хаотическая динамика», 2013. — Т. 2. — С. 964. — 1052 с. — ISBN 978-5-4344-0137-1.
- Нельсон Д., Кокс М. Основы биохимии Ленинджера: в 3 т. — М.: БИНОМ, 2011. — Т. 1. — С. 543—546. — 694 с. — ISBN 978-5-94774-365-4.
Ссылки
- Чугунов, Антон; Полянский, Антон. Липидный фундамент жизни. // Сайт Biomolecula.ru (22.01.2012). Дата обращения: 24 марта 2018.
- Усик, Мария. Клетки под давлением. // Сайт Biomolecula.ru (8.12.2015). Дата обращения: 24 марта 2018.