Ишемический инсульт
Ишеми́ческий инсу́льт (инфаркт мозга) — нарушение мозгового кровообращения с повреждением ткани мозга, нарушением его функций вследствие затруднения или прекращения поступления крови к тому или иному отделу. Может быть обусловлен недостаточностью кровоснабжения определённого участка головного мозга по причине снижения мозгового кровотока, тромбоза или эмболии, связанных с заболеваниями сосудов, сердца или крови[2]. Является одной из основных причин смертности среди людей[3].
| Ишемический инсульт | |
|---|---|
 Компьютерная томограмма головного мозга, демонстрирующая инфаркт в правом полушарии головного мозга (зона инфаркта обведена красным.) | |
| МКБ-11 | 8B11.5 |
| МКБ-10 | I63 |
| МКБ-10-КМ | I63.9 и I63 |
| МКБ-9 | 434.01, 434.11, 434.91 |
| МКБ-9-КМ | 433.01[1], 433.31[1], 434.91[1], 433.81[1] и 433.21[1] |
| OMIM | 601367 |
| MeSH | D002544 |
История изучения
Первыми сохранившимися упоминаниями инсульта являются описания отца медицины Гиппократа, называвшего заболевание «апоплексия» (др.-греч. ἀποπληξία) — удар[4]. Теоретические основы по вопросу этиологии инсульта были заложены швейцарским патологом XVII века Иоганном Якобом Вепфером, обнаружившим, что причиной апоплексии может служить закупорка сосуда головного мозга или сосудистое повреждение с внутримозговым кровоизлиянием[5]. Этим же учёным впервые были описаны клинические случаи очень быстрого регресса слабости в конечностях[6]. Однако окончательно сосудистая природа инсультов была признана лишь в первой половине XIX столетия. «Размягчение» мозга различали от геморрагического «удара», вместе с тем их этиология оставалась до конца неясной. Развитие знаний об инсульте было медленным, по-видимому, в связи с ограниченным интересом у знаменитых неврологов того времени. Так, первые важные сведения о причинах инсульта были получены не неврологами, а патологами Рокитанским и Вирховом[7]. В середине XIX века хирургом и анатомом Джоном Лиделлом был предложен термин «красный инфаркт», подчёркивающий вторичность кровоизлияния при геморрагическом инфаркте[8]. Клинико-топографические исследования Жюля Дежерина, Пьера Мари, а также их последователя Шарля Фуа — родоначальника современных клинических исследований инсульта, вызвали заинтересованность и дальнейшие исследования неврологов данного заболевания[7]. В 1928 году инсульт был разделён на отдельные типы с учётом характера сосудистой патологии[6].
Эпидемиология
Согласно официальным материалам министерства здравоохранения России за последние годы, смертность от болезней системы кровообращения занимает первое место и при этом продолжает неуклонно расти. В 2002 году вследствие болезней системы кровообращения погибло 56,1 % от общего числа умерших[9].
Смертность от инсульта находится на втором месте, уступая лишь смертности от ишемической болезни сердца. Суммарные показатели заболеваемости и смертности от инсульта во многих странах мира имеют тенденцию к росту. В России на 2001 год он достиг 331 на 100 тысяч населения[9].
Ишемические инсульты составляют 70—85 % от всех случаев инсульта, кровоизлияние в мозг — 20—25 %, субарахноидальное кровоизлияние — 5 %. Соотношение частоты ишемических и геморрагических типов инсульта составляет 4:1[9].
Классификация
Существуют различные классификации ишемических инсультов, в зависимости от этиопатогенетических и клинических аспектов, локализации зоны инфаркта.
По темпу формирования неврологического дефицита и его продолжительности
- транзиторные ишемические атаки (ТИА) (G45.9 согласно МКБ-10[10]) — характеризуются очаговыми неврологическими нарушениями, включая монокулярную слепоту (слепоту на один глаз), которые полностью регрессируют в течение 24 часов после их возникновения[11]:245.
- «малый инсульт» (англ. minor stroke) — согласно определению экспертов ВОЗ: «пролонгированные ишемические атаки с обратным неврологическим дефектом». Вариант ишемического инсульта, при котором восстановление неврологических функций завершается от 2 до 21 суток[11]:245.
- прогрессирующий ишемический инсульт (англ. stroke-in-evolution) — характеризуется постепенным развитием общемозговых и очаговых симптомов на протяжении нескольких часов или 2—3 суток с последующим неполным восстановлением функций. Обычно у больного остаётся минимальная неврологическая симптоматика[11]:245.
- завершённый (тотальный) ишемический инсульт — сформировавшийся инфаркт мозга со стабильным или неполно регрессирующим дефицитом[12].
По тяжести состояния больных
- лёгкой степени тяжести — неврологическая симптоматика выражена незначительно, регрессирует в течение трёх недель заболевания. Вариант малого инсульта[11][12]:247
- средней степени тяжести — преобладание очаговой неврологической симптоматики над общемозговой, отсутствуют расстройства сознания[11][12]:247
- тяжёлый инсульт — протекает с выраженными общемозговыми нарушениями, угнетением сознания, грубым очаговым неврологическим дефицитом, часто дислокационными симптомами[11][12]:247
Патогенетическая (Методические рекомендации по ОНМК, 2000)
- атеротромботический инсульт (включая артерио-артериальную эмболию) (34 %) — возникает на фоне атеросклероза церебральных артерий крупного или среднего калибра. Этот тип инсульта развивается ступенеобразно, с нарастанием симптоматики на протяжении нескольких часов или суток, часто дебютирует во сне. Нередко атеротромботический инсульт предваряется транзиторными ишемическими атаками. Размеры очага ишемического повреждения варьируют[13][14].
- кардиоэмболический инсульт (22 %) — возникает при полной или частичной закупорке эмболом артерии мозга. Начало кардиоэмболического инсульта, как правило, внезапное, в состоянии бодрствования. В дебюте заболевания наиболее выражен неврологический дефицит. Чаще инсульт локализуется в зоне кровоснабжения средней мозговой артерии, размер очага ишемического повреждения средний или большой, характерен геморрагический компонент. В анамнезе возможны тромбоэмболии других органов[13][14].
- гемодинамический инсульт (15 %) — обусловлен гемодинамическими факторами — снижением артериального давления (физиологическим, например, во время сна; ортостатической, ятрогенной артериальной гипотензией, гиповолемией) или падением минутного объёма сердца (вследствие ишемии миокарда, выраженной брадикардии и т. д.). Начало гемодинамического инсульта может быть внезапным или ступенеобразным, в покое или активном состоянии пациента. Размеры инфарктов различны, локализация обычно в зоне смежного кровоснабжения (корковая, перивентрикулярная и др.). Гемодинамические инсульты возникают на фоне патологии экстра- и/или интракраниальных артерий (атеросклероз, септальные стенозы артерий, аномалии сосудистой системы мозга)[13][14].
- лакунарный инсульт (20 %) — обусловлен поражением небольших перфорирующих артерий. Как правило, возникает на фоне повышенного артериального давления. Развивается постепенно, в течение нескольких часов. Локализуются в подкорковых и стволовых структурах (базальных ганглиях, внутренней капсуле, белом веществе семиовального центра, основании моста), размеры очагов не превышают 1,5 см. Общемозговые и менингеальные симптомы отсутствуют, отмечается соответствующая поражённой структуре очаговая симптоматика[13][14][15].
- инсульт по типу гемореологической микроокклюзии (9 %) (в некоторых источниках также используется термин «реологический инсульт»[16]) — возникает на фоне отсутствия какого-либо сосудистого или гематологического заболевания установленной этиологии. Причиной инсульта служат выраженные гемореологические изменения, нарушения в системе гемостаза и фибринолиза. Характерна скудная неврологическая симптоматика в сочетании со значительными гемореологическими нарушениями[13][14].
По локализации инфаркта мозга
В соответствии с топической характеристикой очаговой неврологической симптоматики, по пораженному артериальному бассейну[12]:
- внутренняя сонная артерия;
- позвоночные, основная артерия и их ветви;
- средняя, передняя и задняя мозговые артерии.
Факторы риска

К основным факторам риска ишемических нарушений мозгового кровообращения относят[16]:232:
- пожилой и старческий возраст
- артериальную гипертензию — повышение диастолического артериального давления на 7,5 мм рт. ст. увеличивает риск инсульта почти в 2 раза
- гиперхолестеринемию
- атеросклероз церебральных и прецеребральных (сонных и позвоночных) артерий
- курение
- заболевания сердца (мерцательная аритмия, инфаркт миокарда и др.)
- сахарный диабет
- болезнь Фабри[17][18]
Этиология
В качестве локальных этиотропных факторов инсульта различают[19]:
- атеросклероз и тромбообразование — наиболее распространённая патология церебральных и прецеребральных артерий, вызывающая ишемические нарушения мозгового кровообращения. Образование атеросклеротической бляшки обусловлено отложением липидов в стенке артерий. Рост атеросклеротической бляшки осложняется её изъязвлением и тромбообразованием вследствие адгезии тромбоцитов. Увеличение атеротромботической бляшки может привести к сужению просвета артерии и её полной закупорке; снижение кровотока возникает при гемодинамически значимом стенозе (сужение 70—75 % площади просвета) и далее нарастает пропорционально степени сужения. Фрагменты тромба и атеротромботической бляшки могут быть источником эмболии более дистального отдела артерии (артерио-артериальная эмболия). Исход атеросклеротического тромбоза или эмболии определяется скоростью его развития, локализацией закупорки, состоянием коллатерального кровообращения и активностью фибринолитической системы крови. При постепенном развитии атеросклероза формируется коллатеральное кровообращение, поэтому закупорка одной или даже нескольких прецеребральных артерий может не привести к локальной ишемии мозга и протекать бессимптомно. В случаях быстрого развития тромботической окклюзии или эмболии прецеребральной либо церебральной артерии возможности коллатерального кровообращения ограничены. В тех случаях, когда защитные механизмы не могут компенсировать сужение или закупорку артерии, развивается клинически значимая локальная ишемия мозга. Атеротромбоз и артерио-артериальная эмболия являются причиной до 50 % ишемических нарушений мозгового кровообращения[16]:232-233.
- кардиогенная эмболия является причиной приблизительно 20 %[16]:233 (по некоторым данным до 60 % инсультов обусловлены заболеваниями сердца[19]) ишемических инсультов и ТИА. Она обычно развивается вследствие формирования эмболических фрагментов на клапанах сердца или образования внутрисердечного тромба. Большинство кардиогенных эмболий возникает при мерцательной аритмии. Она, в свою очередь, обычно вызвана ишемической болезнью сердца на фоне атеросклероза коронарных артерий и артериальной гипертензии. Риск развития инсульта при мерцательной аритмии составляет 4,5 % в год, если больной не принимает соответствующее лечение. При инфекционном эндокардите примерно у 20 % больных возникает эмболия сосудов мозга. Для всех искусственных клапанов сердца общий риск эмболии составляет около 2 % в год, если не принимаются антикоагулянты. Инфаркт миокарда примерно в 2 % случаев осложняется ишемическим инсультом; чаще это происходит первые 2 недели после развития сердечного заболевания[16]:233-234.
- гемодинамические ишемические нарушения мозгового кровообращения могут возникнуть при стенозе прецеребральных (чаще всего при стенозе сонных артерий) и (или) церебральных артерий, когда артериальное давление падает ниже нижней границы ауторегуляции мозгового кровообращения[16]:234. Дегенеративные и деформирующие изменения в шейном отделе позвоночника (остеохондроз позвоночника, деформирующий спондилёз, аномалии краниовертебральной области) могут приводить к сдавлению позвоночных или подключичных артерий извне с возможным развитием инсультов в вертебрально-базилярном бассейне[19] либо синдромов обкрадывания[16]:234.
- редкая сосудистая патология: болезнь Такаясу, Мойамойа, инфекционные артерииты и др.
В качестве системных факторов, способствующих развитию ишемического инсульта, различают:
- нарушение центральной гемодинамики:
- кардиальный гиподинамический синдром — проявляется нарушением кровообращения, сердечного ритма, снижением минутного объёма крови и ударного объёма крови, что приводит к снижению кровотока в артериальной системе мозга, срыву механизмов ауторегуляции мозгового кровообращения и формированию тромботического инсульта или развитию ишемии мозга по типу сосудисто-мозговой недостаточности (гемодинамический инсульт).
- артериальная гипертензия — приводит к развитию ишемических нарушений мозгового кровообращения напрямую, вызывая изменения в стенках артерий — липогиалиноз и фибриноидный некроз, а также опосредованно — через стимулирование атеросклероза прецеребральных крупных и средних церебральных артерий и развитие сердечных заболеваний, например, инфаркта миокарда и мерцательной аритмии, осложняющихся кардиогенной эмболией[16]:232.
- аритмии — фактор риска возникновения артерио-артериальных и кардиогенных эмболий.
- гематологические нарушения (коагулопатии, эритроцитоз и полицитемия) могут привести к гиперкоагуляции и повышенной вязкости крови, предрасполагающими к развитию тромбозов в церебральных артериях и возникновению «реологического инсульта»[16][19]:235.
Патогенез
Независимо от причины, вызвавшей локальную ишемию мозга, развивается каскад патобиохимических изменений, приводящих к необратимому повреждению нервной ткани по механизмам некроза и апоптоза[16]:235. Эта серия взаимосвязанных изменений получила название «патобиохимический каскад» или «ишемический каскад» (Гусев Е. И. с соавт.,1997).
Процесс ишемии мозга динамический, и, как правило, потенциально обратимый. Степень ишемического повреждения находится в зависимости от глубины и длительности снижения церебрального кровотока.
Оптимальный объём мозгового кровотока составляет 50—60 мл на 100 г/мин. При уровне церебрального кровотока ниже 55 мл на 100 г вещества в минуту отмечается первичная реакция, которая характеризуется торможением синтеза белков в нейронах — «маргинальная зона ишемии». При церебральном кровотоке ниже 35 мл на 100 г/мин биохимические реакции в клетках мозга нарушаются — гликолиз (расщепление глюкозы) завершается по анаэробному пути с накоплением лактата и образованием всего 2 молекул АТФ. При дальнейшем снижении кровотока возникает нарушение функционального состояния коры большого мозга, а снижение до 10—15 мл на 100 г/мин приводит к быстрым в течение нескольких минут необратимым изменениям в нейронах и формированию центральной зоны инфаркта («ядра ишемии»). В течение 6—8 минут нейроны остаются жизнеспособными и могут восстановить свои функции при нормализации кровообращения.
При локальной ишемии мозга вокруг участка с необратимыми изменениями формируется зона, кровоснабжение которой ниже уровня, необходимого для нормального функционирования, но выше критического порога необратимых изменений — «ишемическая полутень» или «пенумбра» (англ. penumbra). В этой зоне морфологические изменения отсутствуют. Гибель клеток в области пенумбры приводит к расширению зоны инфаркта. Однако эти клетки в течение определённого времени могут сохранять свою жизнеспособность. Окончательное формирование зоны инфаркта завершается через 48—56 часов[12][16]:235-236[19].
Продолжительность «терапевтического окна» — периода, в течение которого возможно восстановление функции нейронов в области «ишемической полутени» — точно не установлено. Хотя для большинства клеток это время ограничено 3—6 часами, не исключено, что способность к восстановлению сохраняется в течение нескольких суток.
По Скворцовой В. И. (2000 г.), этапами ишемического каскада являются:
- снижение мозгового кровотока.
- глутаматная эксайтотоксичность (возбуждающие медиаторы глутамат и аспартат обладают цитотоксическим действием).
- внутриклеточное накопление кальция.
- активация внутриклеточных ферментов.
- повышение синтеза NO и развитие оксидантного стресса.
- экспрессия генов раннего реагирования.
- отдаленные последствия ишемии (реакция местного воспаления, микроваскулярные нарушения, повреждение гемато-энцефалического барьера).
- апоптоз — генетически запрограммированная клеточная гибель[12][19].
Ишемические процессы в ткани мозга сопровождаются отёком мозга. Отёк головного мозга развивается через несколько минут после развития локальной ишемии, его выраженность напрямую зависит от размеров инфаркта мозга. Пусковым моментом развития отёка является проникновение в клетки воды из межклеточного пространства вследствие недостатка энергии у нейронов для поддержания внутриклеточного гомеостаза. После этого к внутриклеточному отёку (цитотоксическому) присоединяется внеклеточный (вазогенный), который обусловлен гибелью клеточных элементов, составляющих гемато-энцефалический барьер, с накоплением в зоне повреждения недоокисленных продуктов, формирующихся в процессе анаэробного гликолиза[20][21][22][23][24][25]. Повреждение гемато-энцефалического барьера сопровождается также трансэндотелиальной миграцией лейкоцитов в ткань мозга, которые вызывают в том числе поражение здоровых клеток нервной ткани[26][27] Внутри- и внеклеточный отёк вызывают увеличение объёма мозга и развитие внутричерепной гипертензии. При повышении давления в определённом отделе мозга и черепной коробки (появление области дистензии) происходит смещение частей головного мозга относительно друг друга, что вызывает развитие тех или иных дислокационных синдромов. Вклинение в большое затылочное отверстие миндалин мозжечка со сдавлением нижних отделов продолговатого мозга — наиболее частая причина смерти больных[12][19].
Патологическая анатомия
Морфологические изменения при транзиторной ишемической атаке головного мозга проявляются сосудистыми расстройствами (спазм артериол, плазматическое просачивание их стенок, периваскулярный отёк и единичные небольшие геморрагии), а также появлением очагов изменённой мозговой ткани (отёк, дистрофические изменения групп клеток). Эти изменения обратимы[28]:359.
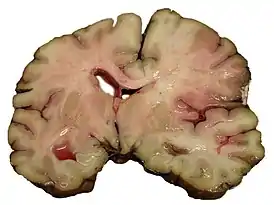
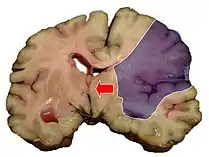
Ишемический инфаркт является самым частым проявлением (75 % случаев) ишемического инсульта. Он выглядит как очаг серого размягчения ткани мозга. При микроскопическом исследовании среди некротизированных масс находят погибшие нейроны[28]:360.
Геморрагический инфаркт мозга внешне похож на очаг геморрагического инсульта, однако имеет другой механизм возникновения. Первично возникает ишемия головного мозга; вторично — кровоизлияние в ишемизированную ткань. Геморрагический инфаркт чаще встречается в коре мозга, реже — в подкорковых узлах[28]:360.
При смешанном инфаркте, который всегда возникает в сером веществе мозга, можно найти участки как ишемического, так и геморрагического инфакта[28]:360.
Клиническая картина
Клиническая картина ишемического инсульта у больных людей складывается из общемозговой и очаговой неврологической симптоматики.
Прогрессирующее течение инсульта (постепенное или ступенеобразное нарастание неврологических нарушений в течение нескольких часов или дней) наблюдается у 20 % больных людей с ишемическим инсультом в каротидном бассейне и у 40 % больных с ишемическим инсультом в вертебробазилярном бассейне. Оно чаще вызвано увеличением размера внутриартериального тромба, повторными эмболиями, нарастанием отёка мозга, геморрагической трансформацией инфаркта или увеличением его размеров вследствие снижения системного артериального давления[16]:237.
Повышение артериального давления наблюдается у 70—80 % больных людей в первые дни инсульта. В дальнейшем у большинства из них отмечается спонтанное снижение давления. Транзиторное повышение артериального давления может быть вызвано отёком головного мозга и повышением внутричерепного давления, а также стрессом, обусловленным развитием заболевания[16]:237.
Общемозговые симптомы
Общемозговые симптомы характерны для инсультов средней и тяжёлой степени. Характерны нарушения сознания — оглушённость, сонливость или возбуждение, возможна кратковременная потеря сознания. Типична головная боль, которая может сопровождаться тошнотой или рвотой, головокружение, боль в глазных яблоках, усиливающаяся при движении глаз. Реже наблюдаются судорожные явления. Возможны вегетативные расстройства: чувство жара, повышенная потливость, ощущение сердцебиения, сухость во рту[29][30].
Очаговая неврологическая симптоматика
На фоне общемозговых симптомов инсульта появляются очаговые симптомы поражения головного мозга. Клиническая картина у каждого конкретного больного человека определяется тем, какой участок мозга пострадал из-за повреждения кровоснабжающего его сосуда.
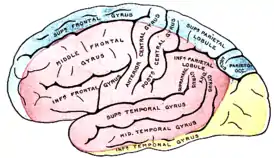 Латеральная поверхность левого полушария |
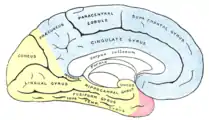 Медиальная поверхность левого полушария |
Зоны кровоснабжения: Arteria cerebri anterior (синий цвет) |
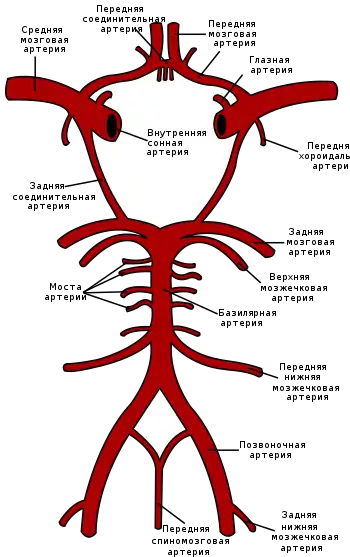
Нарушения кровотока в бассейне внутренней сонной артерии (ВСА)
Закупорка ВСА может возникать в её начале (области бифуркации общей сонной артерии), каротидном сифоне и супраклиноидной части (чаще вследствие образования тромба на месте атеросклеротической бляшки) и протекать бессимптомно при достаточном коллатеральном кровообращении через артериальный круг большого мозга и другие анастомозы. При недостаточном коллатеральном кровообращении или в случаях артерио-артериальной эмболии возникают геми- или моноплегия, афазия и другие расстройства[16]:237. Развитие монокулярной слепоты на одной стороне и гемипареза на противоположной (окулопирамидный синдром) — характерно (патогномонично) для стеноза или закупорки ВСА[31].
Окклюзия передней ворсинчатой (хороидальной) артерии
Закупорка передней ворсинчатой артерии, отходящей от ВСА до её деления на среднюю и переднюю мозговые артерии обычно проявляется в виде контрлатерального (на противоположной стороне от окклюзии) гемипареза и гемигипалгезии вследствие поражения внутренней капсулы. Иногда отмечаются нарушения речи и зрительно-пространственной ориентации в результате ишемии таламуса, а также гемианопсии при поражении латерального коленчатого тела[16]:238.
Окклюзия передней мозговой артерии (ПМА)
Если закупорка возникла до отхождения передней соединительной артерии, то она может протекать бессимптомно вследствие коллатерального кровотока из противоположной ПМА[16]:238. Инфаркт при окклюзии ПМА проявляется контрлатеральным параличом нижней конечности и хватательным рефлексом. Характерны спастичность с непроизвольным сопротивлением пассивным движениям, абулия, абазия, персеверации и недержание мочи[31].
Закупорка возвратной артерии Гюбнера, ветви ПМА, приводит к поражению хвостатого ядра и передней ножки внутренней капсулы, что вызывает контрлатеральный парез руки, лица и языка, сопровождающийся дизартрией[16]:238.
Окклюзия средней мозговой артерии (СМА)
Для окклюзии СМА характерны контрлатеральные гемиплегия, гемигипестезия, гомонимная гемианопсия. Наблюдается контрлатеральный парез взора. При поражении доминантного полушария развивается афазия, при поражении недоминантного — апраксия, агнозия, асоматогнозия и анозогнозия.
При окклюзии отдельных ветвей СМА возникают парциальные синдромы: моторная афазия в сочетании с контрлатеральным парезом верхней конечности и лицевого нерва при поражении верхних ветвей; сенсорная афазия при поражении нижних ветвей[31].
Окклюзия задней мозговой артерии (ЗМА)
При окклюзии задней мозговой артерии возможно развитие одного из двух синдромов: сочетание гомонимной гемианопсии с амнезией, дислексией (без дисграфии) и лёгкого контрлатерального гемипареза с гемианестезией; либо сочетание поражения ипсилатерального глазодвигательного нерва с контрлатеральными непроизвольными движениями и контрлатеральной гемиплегией или атаксией[31].
Нарушение кровотока в базилярной и позвоночных артериях
При окклюзии ветвей базилярной артерии (в зависимости от уровня поражения) наблюдаются: ипсилатеральная атаксия; контрлатеральная гемиплегия и гемианестезия; ипсилатеральный парез взора с контрлатеральной гемиплегией; поражение ипсилатерального лицевого нерва; межъядерная офтальмоплегия; нистагм в сочетании с головокружением, тошнотой и рвотой; шум в ушах и потеря слуха; нёбная миоклония и осциллопсия.
При окклюзии ствола базилярной артерии или обеих позвоночных артерий наблюдается тетраплегия, двусторонний горизонтальный парез взора, кома или синдром изоляции («запертого человека», англ. locked-in state).
Поражение внутричерепного отдела позвоночной артерии или задненижней мозжечковой артерии сопровождается синдромами поражения продолговатого мозга. Наиболее часто наблюдается латеральный синдром продолговатого мозга: нистагм, головокружение, тошнота, рвота, дисфагия, охриплость голоса; ипсилатеральные нарушения чувствительности на лице, синдром Горнера и атаксия; контрлатеральное нарушение болевой и температурной чувствительности[31].
Лакунарные инфаркты
Наиболее часто возникают одномоментно, реже проявляется постепенным нарастанием неврологических нарушений. Расстройства сознания, эпилептические припадки, нарушения высших психических функций и полей зрения не характерны. В литературе описано более 25 синдромов, при которых обнаруживаются лакунарные инфаркты, однако наиболее типичны и часто встречаются пять его вариантов:
- Чисто двигательный инсульт (до 60 % случаев) — проявляется только двигательными нарушениями — парезом руки, ноги, лица и языка по центральному типу с одной стороны. Степень двигательных нарушений колеблется. Очаги поражения при данном типе чаще обнаруживают в задней ножке внутренней капсулы или лучистом венце, реже — в колене или передней ножке внутренней капсулы либо в таламусе.
- Сенсомоторный инсульт — отмечается сочетание двигательных и чувствительных нарушений по гемитипу. Очаги поражения имеют наибольшие размеры в сравнении с другими вариантами лакунарного инсульта.
- Чисто сенсорный инсульт — проявляется ощущением онемения и/или расстройством чувствительности по гемитипу. Очаг поражения обычно выявляется в таламусе.
- Синдром дизартрии и неловкой руки — состоит из выраженной дизартрии в сочетании с лёгкой слабостью и неловкостью руки, парезом мышц лица по центральному типу с одной стороны. Очаг поражения обнаруживается в основании моста или передней ножке внутренней капсулы
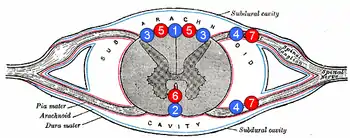
1. задняя спинальная вена
2. передняя спинальная вена
3. заднелатеральная спинальная вена
4. радикулярная (или сегментарная) вена
5. задние спинальные артерии
6. передняя спинальная артерия
7. радикулярная (или сегментарная) артерия
.
- Синдром атактического гемипареза — проявляется центральным гемипарезом в сочетании с атаксией в паретичных конечностях. Очаг поражения выявляется в задней ножке внутренней капсулы, основании моста или лучистом венце[16]241.
Для небольших, глубинно расположенных инфарктов, характерны лакунарные синдромы: изолированный моторный инсульт, изолированный сенсорный инсульт, синдром дизартрия/неловкая кисть, ипсилатеральная атаксия с парезом ноги[31].
Спинальный инсульт
Спинальный инсульт — острое нарушение спинального кровообращения с повреждением спинного мозга и расстройством его функций. Его частота составляет около 1 % от всех инсультов[32]. В зависимости от повреждённых структур спинного мозга, уровня его поражения возникают чувствительные и двигательные расстройства в руках и ногах различной степени выраженности, нарушения функции тазовых органов.
Диагностика
Для выбора лечебной тактики решающее значение имеет ранняя диагностика и дифференциальная диагностика ишемического, геморрагического инсультов и субарахноидального кровоизлияния. Точная диагностика характера инсульта клинически возможна лишь в 70 % случаев[12].
Физикальное обследование занимает важное место в диагностике и определении состояния больного. Оцениваются функции дыхания и сердечно-сосудистой системы (в первую очередь, нарушения центральной гемодинамики для экстренной коррекции), что в ряде случаев позволяет определить патогенетический характер инсульта (наличие аритмии и шумов в сердце позволяют предположить кардиоэмболический инсульт; систолический шум в области бифуркации общей сонной артерии говорит о её стенозе; разница в артериальном давлении и пульсе на противоположных сторонах свидетельствует о стенозе дуги аорты и подключичных артерий).
При неврологическом осмотре уточняется состояние и уровень сознания; проводится топическая диагностика очаговых повреждений мозга.
Для получения информации о причине ишемического инсульта проводится дуплексное и триплексное ультразвуковое сканирование прецеребральных артерий головы и мозговых артерий. Этот метод позволяет визуализировать сонные артерии, исследовать кровоток с помощью спектральной допплерографии. Транскраниальная допплерография позволяет определить состояние некоторых внутричерепных артерий, косвенно оценить скорость кровотока в них.
Наиболее информативным методом диагностики является ангиография, которая позволяет обнаружить сужения просвета, аневризмы и другие патологические изменения в артериях. Ангиографию, учитывая возможные осложнения, следует применять по показаниям. Также может применяться нетравматичные методы диагностики состояния мозговых сосудов — МР-ангиография или КТ-ангиография.
Помимо указанных выше методов, обязательно проведение ЭКГ и эхокардиографии для исключения сопутствующей кардиальной патологии, рентгенологическое исследование лёгких для диагностики лёгочных осложнений (аспирационная пневмония, ТЭЛА и др.), проведение клинического, биохимического анализов крови и других рутинных анализов, коагулограммы, газового состава крови. Обязательна консультация терапевта и офтальмолога[12][33].
Магнитно-резонансная и компьютерная томография в диагностике ишемического инсульта
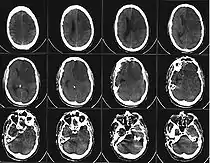
При остром периоде ишемического инфаркта мозга магнитно-резонансная томография (МРТ) является более эффективным методом ранней визуализации, чем компьютерная томография. На стандартных томограммах в 80 % наблюдений в первые 24 часа после развития окклюзии сосуда ишемические изменения уже становятся видимыми. При дополнительном введении контрастных препаратов в области ишемии отмечается контрастирование артериальных сосудов на Т1-взвешенных изображениях, что говорит о снижении в них скорости кровотока. Эти изменения могут развиваться уже в течение первых минут после окклюзии. Кроме того, к ранним МР-проявлениям относят изменения паренхимы мозга, выражающиеся в утолщении извилин и сужении субарахноидальных пространств на Т1-взвешенных томограммах, и повышение сигнала в режиме Т2. Эти изменения обычно выявляются не ранее чем через 8 часов после окклюзии[34]:347-348.
При компьютерной томографии (КТ) головы область гиподенсивности (пониженной плотности) у большинства больных выявляется через 12—24 ч с момента развития ишемического инсульта. При меньшей давности поражение не обнаруживается почти в половине случаев. Небольшие по размеру инфаркты мозга (инфаркты в мозговом стволе и лакунарные инфаркты) часто не дифференцируются на бесконтрастных КТ-изображениях даже на 3—4-й день заболевания (в период, когда инфаркты других локализаций визуализируются наилучшим образом), однако могут быть обнаружены при КТ с контрастированием. Проведение КТ с внутривенным контрастным усилением также показано в неясных случаях для дифференциальной диагностики[35].
В течение первых 3 суток развития инфаркта мозга на МРТ с контрастированием примерно в 30 % случаев может наблюдаться усиление сигнала от соседней твёрдой мозговой оболочки. Однако в 10—20 % наблюдений МР томография не выявляет каких-либо патологических изменений. Магнитно-резонансная ангиография выявляет окклюзию или выраженный стеноз в основном крупных артериальных стволов[34]:348.
В последние годы появились новые диагностические возможности определения ишемических повреждений в максимально ранние сроки. К ним можно отнести транскраниальную допплерографию, МР-спектроскопию, диффузионные и перфузионные МР-исследования[34]:348.
В подостром периоде ишемического инсульта происходят дальнейшие изменения. В течение первых 2—4 дней начинает уменьшаться и может совсем исчезнуть внутриартериальное и менингеальное контрастное усиление. Вслед за этим начинает выявляться паренхиматозное контрастирование за счёт усиливающегося повреждения гемато-энцефалического барьера. Контрастное усиление на 3—4 сут имеет типичную картину, повторяющую конфигурацию извилин, сохраняясь иногда до 8—10 нед[34]:348-349.
Отёк в зоне ишемии проявляется снижением сигнала на Т1-взвешенных и повышением сигнала на Т2-взвешенных изображениях. Иногда в течение второй недели после начала инфаркта отмечается снижение интенсивности сигнала на Т2-взвешенных томограммах. Начально высокий сигнал может даже полностью исчезнуть. Тем не менее, выполнение в эти сроки МР-томографии с контрастным усилением выявляет обширные поля накопления контраста, даже в тех зонах, которые представляются абсолютно интактными на Т2-изображениях[34]:349.
В хроническом периоде ишемического инфаркта на КТ и МРТ в бассейне окклюзированного сосуда определяется хорошо отграниченная зона энцефаломаляции, имеющая плотность на КТ и сигнал на МРТ, приближающийся по характеристикам к ликвору. Отмечается расширение расположенных по соседству субарахноидальных щелей мозга и соответствующего участка желудочковой системы с подтягиванием прилежащих её отделов к зоне поражения мозгового вещества. Контрастное усиление мозгового вещества, как правило, исчезает через 8—10 недель после развития заболевания[34]:349.
Лакунарные инфаркты имеют округлую форму, низкий сигнал на Т1-взвешенных и повышенную интенсивность сигнала на Т2-взвешенных томограммах. Имеют характерное расположение в глубоких отделах мозга[34]:349-350.
Дифференциальная диагностика
Для дифференциальной диагностики может потребоваться проведение люмбальной пункции. Люмбальная пункция проводится при отсутствии противопоказаний — смещения срединных структур по данным КТ и/или МРТ, либо смещения срединного М-Эхо более чем на 5 мм (что свидетельствует о дислокации мозга)[36], согласно эхоэнцефалографии. При ишемическом инсульте спинномозговая жидкость обычно прозрачна, с нормальным содержанием белка и клеточных элементов.
| Симптомы | Ишемический инфаркт мозга | Кровоизлияние в мозг | Субарахноидальное кровоизлияние |
|---|---|---|---|
| Предшествующие преходящие ишемические атаки | Часто | Редко | Отсутствуют |
| Начало | Более медленное | Быстрое (минуты или часы) | Внезапное (1—2 минуты) |
| Головная боль | Слабая или отсутствует | Очень сильная | Очень сильная |
| Рвота | Не типична, за исключением поражения ствола мозга | Часто | Часто |
| Артериальная гипертензия | Часто | Имеется почти всегда | Не часто |
| Сознание | Может быть потеряно на непродолжительное время | Обычно длительная потеря | Может быть кратковременная потеря |
| Ригидность мышц затылка | Отсутствует | Часто | Всегда |
| Гемипарез (монопарез) | Часто, с самого начала болезни | Часто, с самого начала болезни | Редко, не с самого начала болезни |
| Нарушение речи | Часто | Часто | Очень редко |
| Спинномозговая жидкость (ранний анализ) | Обычно бесцветный | Часто кровянистый | Всегда кровянистый |
| Кровоизлияние в сетчатку | Отсутствует | Редко | Может быть |
Лечение
Всем больным с инсультом, вне зависимости от его характера, проводится базисная терапия. Помимо этого, проводится дифференциальная терапия ишемического инсульта с учётом его патогенетического подтипа[33].
Базисная терапия
Тактика базисной терапии направлена на общие мероприятия по стабилизации жизненно важных функций, профилактику и лечение возможных осложнений[12]. Министерством здравоохранения РФ (2000) всем пациентам с острым нарушением церебрального кровообращения рекомендуется проведение следующей базисной терапии:
- мероприятия, направленные на нормализацию функции внешнего дыхания и оксигенации — санация дыхательных путей, установка воздуховода, интубация трахеи, при необходимости — проведение ИВЛ.
- регуляция функции сердечно-сосудистой системы: поддержание артериального давления на 10 % выше цифр, к которым адаптирован пациент; антиаритмическая терапия при нарушениях ритма сердца; при ишемической болезни сердца назначаются антиангинальные препараты (нитраты); препараты, улучшающие насосную функцию миокарда — сердечные гликозиды, антиоксиданты, оптимизаторы тканевого энергетического метаболизма.
- контроль и поддержание гомеостаза, включая биохимические константы, водно-солевой и кислотно-щелочной баланс.
- нейропротекция — комплекс универсальных методов защиты мозга от структурных повреждений — начинается на догоспитальном этапе (может иметь некоторые особенности при различных подтипах ОНМК).
- мероприятия, направленные на уменьшение отека головного мозга
- мероприятия по профилактике и лечению осложнений
- симптоматическая терапия, в том числе противосудорожная, психотропная (при психомоторном возбуждении), миорелаксанты, анальгетики и др.[33]
Специфическая терапия
Согласно методическим рекомендациям министерства здравоохранения Российской Федерации за 2000 год[33], стратегия лечения больных основана на ранней диагностике патогенетического подтипа инсульта. Основные принципы патогенетического лечения включают:
- восстановление кровообращения в зоне ишемии (рециркуляция, реперфузия)
- поддержание метаболизма ткани мозга, её защиту от структурных повреждений (нейропротекция).
Основные методы рециркуляции:
- восстановление и поддержание системной гемодинамики
- медикаментозный тромболизис
- гемангиокоррекция (нормализация реологических свойств крови и функциональных возможностей сосудистой стенки)
- хирургические методы рециркуляции: наложение экстраинтракраниального микроанастомоза, тромбэктомия, реконструктивные операции на артериях.
Основные методы нейропротекции:
- восстановление и поддержание гомеостаза нервной ткани
- медикаментозная защита мозга
- немедикаментозные методы (гипербарическая оксигенация, церебральная гипотермия).
Восстановление кровообращения и поддержание метаболизма ткани мозга требуют проведение лечебных мероприятий, направленных на борьбу с отёком мозга. Противоотечная терапия при ишемических инсультах включает:
- назначение осмотических диуретиков
- гипервентиляцию
- нейропротекторы и поддержание гомеостаза нервной ткани оказывают противоотёчное действие
Тромболитическая терапия
При поступлении больного в сроки до 6 часов с момента заболевания и подтверждения ишемического характера инсульта возможно применение тромболитической терапии с целью лизиса тромба или эмбола и восстановления кровотока в ишемизированной ткани мозга. Предполагается, что она наиболее целесообразна при острой закупорке средней мозговой или базилярной артерии, кардиоэмболическом типе инсульта[16]:250. С 1995 по 2000 год было проведено 10 рандомизированных и плацебо-контролируемых исследований[38][39][40][41][42][43][44][45][46][47] по применению тромболитической терапии при ишемическом инсульте.
Согласно проведённым исследованиям целесообразно и оправдано применение тканевого активатора плазминогена (в дозе 0,9 мг/кг, максимум 90 мг; 10 % вводится внутривенно струйно в течение 1 минуты, а 90 % — внутривенно капельно в течение часа) в первые 3 часа после появления первых симптомов заболевания и нецелесообразна при более длительном анамнезе. После 3 и до 6 часов от появления симптомов инсульта показан только интраартериальный (селективный) тромболизис тканевым активатором плазминогена. Применение стрептокиназы не рекомендуется в связи с недопустимым риском кровоизлияний и смерти[48][49].
Противопоказания к данному виду терапии включают[16][50]:250:
- наличие в анамнезе внутричерепного кровоизлияния, геморрагического диатеза, а также недавнего (до 3 нед.) кровотечения из желудочно-кишечного тракта или мочевыводящих путей
- возраст старше 80 лет
- лёгкая степень или значительный регресс неврологических нарушений перед началом тромболизиса, а также тяжёлый инсульт
- артериальное давление выше 185/110 мм рт. ст.
- нарушение сознания до степени оглушённости и комы
- нарушения свёртывания крови
- недавнее хирургическое вмешательство
Антикоагулянты и антиаггреганты
Применение антикоагулянтов в лечении ишемического инсульта противоречиво. В некоторых источниках[16]:250-251 они рекомендуются с целью предупреждения дальнейшего тромбообразования и повторной эмболии. Однако проведённые на основе принципов доказательной медицины исследования показали нецелесообразность антикоагулянтов в первые 2 суток инсульта. Положительные эффекты гепарина и других подобных препаратов нивелируется повышением риска кровоизлияний и других осложнений (уровень доказательности А)[51].
Необходимость применения антиагрегантов подтверждается данными доказательной медицины[51]. С их помощью уменьшается тромбообразование и риск эмболии церебральных сосудов. Применяются ацетилсалициловая кислота по 75—300 мг/сут или клопидогрель по 75 мг/сут.
Ноотропы
В лечении ишемического инсульта используются нейропротекторные препараты, предназначенные для уменьшения поражения мозга и обратного развития возникших в нём изменений. На данный момент их эффективность дискутабельна. Проведённые исследования не дали статистически достоверных результатов об уменьшении или увеличении смертности при применении ноотропов[52][53][54][55]. Окончательно проблема о целесообразности их применения не решена.
Ноотропы начинают назначать в первые часы инсульта (в период «терапевтического окна»). Церебролизин рекомендуют в больших дозах (20—50 мл/сут), вводимых 1 или 2 раза на 100—200 мл изотонического раствора хлорида натрия внутривенно капельно (в течение 60—90 мин) на протяжении 10—15 дней. Пирацетам используют в дозе 4—12 г/сут[16]:251.
Антагонисты кальция
Применение вазоактивных препаратов направлено на увеличение кровоснабжения в ишемизированной ткани, хотя их эффективность сомнительна. При этом нельзя исключить развитие феномена «внутримозгового обкрадывания», проявляющегося уменьшением кровотока в зоне ишемии за счёт усиления кровотока в здоровых тканях. Целесообразность применения оправдывается их возможным нейропротекторным действием. Комбинация двух или нескольких вазоактивных препаратов не рекомендуется. Нимодипин (нимотоп) вводят в дозе 4—10 мг внутривенно капельно 2 раза в сутки в течение 7—10 дней, после этого (или с начала лечения) назначают внутрь по 30—60 мг 3—4 раза в сутки. Рекомендуется использование и других антагонистов ионов кальция[16]:251.
Статистически достоверная информация об эффективности использования данных препаратов при ишемическом инсульте отсутствует[56].
Гемодилюция и улучшение реологических свойств крови
С целью гемодилюции могут быть использованы реополиглюкин или другие инфузионные растворы по 200—400 мл внутривенно капельно 1—2 раза в день в течение 5—7 дней. Для улучшения реологических свойств крови применяют пентоксифиллин по 200 мг внутривенно капельно 2 раза в сутки в течение 5—7 дней, а затем (или с начала лечения) внутрь по 100—200 мг 3—4 раза в сутки. Эффективность этой терапии дискутабельна[16]:252.
Согласно данным кохрейновского сообщества статистически достоверные данные об эффективности этих видов лечения отсутствуют[57][58].
Гипербарическая оксигенация
Гипербарическая оксигенация является методом лечения, при котором больной в специальной камере дышит чистым кислородом. Предполагается, что при этом происходит насыщение крови кислородом и увеличение его поступления в ишемизированную ткань мозга. По данным кокрейновского сотрудничества на 2010 год было проведено всего лишь 6 рандомизированных исследований 283 пациентов. Полученных данных недостаточно, для статистически достоверного вывода о том, повышает ли выживаемость данный метод лечения у больных с ишемическим инсультом. При этом отмечено незначительное улучшение качества жизни у больных, которым проводилась гипербарическая оксигенация[59].
Прогноз
Определяется локализацией и объёмом инфаркта, выраженностью отёка мозга, а также наличием сопутствующих заболеваний и/или развитием осложнений в течение инсульта (пневмония, пролежни, уросепсис и др.). В первые 30 дней умирает около 15—25 % больных. Смертность выше при атеротромботическом и кардиоэмболическом инсультах и составляет только 2 % при лакунарном.
Тяжесть и прогрессирование инсульта часто оценивают, используя стандартизированные измерители, например, шкалу инсульта Национального Института Здоровья (NIH)[60].
Причина смерти в половине случаев — отёк мозга и вызванная им дислокация структур мозга, в остальных случаях — пневмония, сердечные заболевания, эмболия легочной артерии, почечная недостаточность или септицемия. Значительная часть (40 %) летальных исходов возникает в первые 2 сут заболевания и связана с обширными размерами инфаркта и отёком мозга.
Из оставшихся в живых около 60—70 % больных имеют инвалидизирующие неврологические расстройства к концу месяца. Через 6 мес после инсульта инвалидизирующие неврологические расстройства остаются у 40 % выживших больных, к концу года — у 30 %. Чем более значителен неврологический дефицит к концу 1-го месяца заболевания, тем менее вероятно полное восстановление.
Восстановление двигательных функций наиболее существенно в первые 3 месяца после инсульта, при этом функция ноги часто восстанавливается лучше, чем функция руки. Полное отсутствие движений руки к концу 1-го месяца заболевания — плохой прогностический признак. Спустя год после инсульта дальнейшее восстановление неврологических функций маловероятно. У больных с лакунарным инсультом отмечается лучшее восстановление, чем при других типах ишемического инсульта[16]:252-253.
Выживаемость больных после перенесённого ишемического инсульта составляет примерно 60—70 % к концу 1-го года заболевания, 50 % — через 5 лет после инсульта, 25 % — через 10 лет. К плохим прогностическим признакам выживаемости в первые 5 лет после инсульта относят пожилой возраст больного, перенесённый инфаркт миокарда, мерцательную аритмию, предшествующую инсульту застойную сердечную недостаточность. Повторный ишемический инсульт возникает примерно у 30 % больных в период 5 лет после первого инсульта[16]:253.
Влияние последствий ишемического инсульта у исторических личностей на историю
Разрушительные последствия ишемического инсульта влияли на ход мировой истории. Лидеры государств подвергаются болезням так же, как и простые люди. Джеймс Тул (англ. James F. Toole) в своей книге о цереброваскулярных заболеваниях писал[61]:
В феврале 1945 года перед окончанием Второй мировой войны Франклин Делано Рузвельт, Уинстон Черчилль и Иосиф Сталин собрались в Ялте для заключения договора о послевоенном делении мира. Болезненные эффекты этого договора остались до сегодняшнего дня и в той или иной степени сыграли роль в конфликтах в Корее, Вьетнаме, Чехословакии и Польше. В то же время лидеры великих держав, собравшиеся в Ялте, страдали цереброваскулярными заболеваниями. Так, Рузвельт умер спустя 3 месяца от массивного кровоизлияния в мозг. И.Сталин позже умер от той же причины. У Черчилля была серия малых инсультов, которые позже привели его к деменции.
Рузвельт, видимо, перенес несколько цереброваскулярных эпизодов во время своего второго срока на посту президента. На Ялтинской конференции в 1945 году его состояние было тяжёлым. Лорд Моран, врач Черчилля, так описывает Рузвельта[61]:
У него была пелерина или шаль, покрывающая плечи, что делало его похожим на птицу сорокопут. Он сидел, глядя прямо вперед с открытым ртом как если бы у него там что-то было. Каждый испытывал шок от его вида и кажется соглашался с тем, что Президент идет к физической дряхлости. Не только его физическое разрушение давало это впечатление. Он очень мало участвовал в дискуссиях. Когда в прошлом он иногда был недостаточно осведомлен об объекте дискуссии, его выручала необыкновенная проницательность. Сейчас говорят, что его проницательность ушла и никогда не вернется.
Вудро Вильсон, 28-й президент США, занимавший свой пост во время Первой мировой войны, перенёс инсульт в 1919 году. Вследствие инсульта у него парализовало всю левую сторону тела и он ослеп на один глаз. Вильсон стал нетрудоспособным до конца президентского срока. Он практически не руководил своим кабинетом, посредником между правительством и президентом была миссис Вильсон, которая, в конце концов, стала заниматься перемещениями в американской администрации. В это критическое время завершалось создание Лиги Наций. Вильсон как активный поборник её создания был неспособен вследствие болезни убедить конгресс США в важности вступления в предшественницу ООН. В результате США так и не вступили в Лигу Наций[61].
Из пятнадцати президентов США с 1900 года от Теодора Рузвельта до Рональда Рейгана тринадцать умерли от инсульта или болезни коронарных артерий, исключая Герберта Гувера и убитого в Далласе Джона Кеннеди[61].
Хотя неизвестен ряд деталей смерти Владимира Ленина, наиболее общее мнение состоит в том, что она произошла от инсульта[61].
Примечания
- Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
- Ишемический инсульт Архивная копия от 27 мая 2009 на Wayback Machine
- Ответный удар по глобальной эпидемии — Интервью с В. И. Скворцовой Архивировано 10 мая 2011 года.
- Sam Safavi-Abbasi, MD, PHD; Cassius Reis, MD et al — Rudolf Ludwig Karl Virchow: Pathologist, Physician, Anthropologist, and Politician. Implications of His Work For the Understanding of Cerebrovascular Pathology and Stroke (англ.)
- Stroke - History of Stroke (англ.). Carilion Clinic. Дата обращения: 2 октября 2010. Архивировано 13 августа 2011 года.
- История инсульта. сайт correctdiagnosis.ru. Дата обращения: 2 октября 2010.
- Paciaroni M, Bogousslavsky J. How did stroke become of interest to neurologists?: a slow 19th century saga (англ.) // Neurology. — М.: Наука, 2009. — No. 73 (9). — P. 724—728.
- Е.И. Батищева, А.Н. Кузнецов. Геморрагический инфаркт головного мозга (недоступная ссылка). Национальный медико-хирургический центр им. Н.И.Пирогова. Дата обращения: 2 октября 2010. Архивировано 13 августа 2011 года.
- Исмагилов М.Ф. Ишемический мозговой инсульт: терминология, эпидемиология, принципы диагностики, патогенетические подтипы, терапия острого периода заболевания // Неврологический вестник. — 2005. — Т. XXXVII, № 1—2. — С. 67—76.
- Сайт всемирной организации здоровья
- С.М.Віничук, Є.Г.Дубенко, Є.Л.Мачерет та ін. укр. Судинні захворювання головного та спинного мозку // укр. Нервові хвороби. — К.:: "Здоров'я", 2001. — С. 207—285. — 408 с. — 3000 экз. — ISBN 5-311-01224-2.
- Евзельман М. А. — Ишемический инсульт. Орёл, 2003.
- З. А. Суслина, Н. В. Верещагин, М. А. Пирадов — Подтипы ишемических нарушений мозгового кровообращения: диагностика и лечение Consilium Medicum, Том 3/N 5/2001
- Н. В. Верещагин — Гетерогенность инсульта в клинической практике.
- ММА им. И. М. Сеченова — Инсульт лакунарный Архивная копия от 15 июля 2009 на Wayback Machine
- И. В. Дамулин, В. А. Парфёнов, А. А. Скоромец, Н. Н. Яхно. Нарушения кровообращения в головном и спинном мозге // Болезни нервной системы / Под редакцией Н. Н. Яхно, Д. Р. Штульмана. — М.:: Медицина, 2003. — Т. 1. — С. 231—302. — 744 с. — ISBN 5-225-04662-2.
- Dubuc V., Moore D.F., Gioia L.C. [et al.] Prevalence of Fabry Disease in Young Patients with Cryptogenic Ischemic Stroke (англ.) // Journal of stroke. — 2013. — November (vol. 22, no. 8). — P. 1288—1292.
- Zenonea T., Chanb V. Young woman with recurrent ischemic strokes diagnosed as Fabry disease: Lessons learned from a case report (англ.) // Clinical Neurology and Neurosurgery. — 2011. — September (vol. 113, no. 7). — P. 586—588.
- Валикова Т.А, Алифирова В.М — Инсульт: этиология, патогенез, классификация, клинические формы, лечение и профилактика (недоступная ссылка)
- Dirnagl U, Iadecola C, Moskowitz MA. Pathobiology of ischaemic stroke: an integrated view // Trends Neurosci. — 1999. — № 22. — С. 391—397.
- Бакай Л., Ли Д. Отёк мозга. — М.:: Медицина, 1969.
- Квитницкий-Рыжов Ю. Н. Современное учение об отёке и набухании головного мозга. — К.:: Здоров’я, 1988.
- Лесницкая В. Л., Морозов В. В., Пашкова В. С., Иванова И. А. Отёк мозга в эксперименте и клинике. — Симферополь, 1959.
- Мчедлишвили Г. И. Отёк головного мозга. — Тбилиси: «Мецниереба», 1986.
- Черний В. И., Кардаш А. М., Городник Г. А., В.Г. Дроботько. Диагностика и лечение отёка и набухания головного мозга. — К.:: Здоров’я, 1997. — С. 228.
- Kuroda S, Siesjö BK. Reperfusion damage following focal ischemia: pathophysiology and therapeutic windows // Clin Neurosci. — 1997. — № 4. — С. 199—212.
- Planas AM, Gorina R, Chamorro A. Signalling pathways mediating inflammatory responses in brain ischaemia // Biochem Soc Trans. — 2006. — № 34. — С. 1267—1270.
- А.І.Струков, В.В.Сєров. укр. Цереброваскулярні захворювання // укр. Патологічна анатомія. — 4. — Х.:: Факт, 1999. — С. 358—361. — 864 с. — 3500 экз. — ISBN 966-7099-60-1.
- Патронаж.ру: Каковы признаки инсульта. Симптомы инсульта.
- Нарушение мозгового кровообращения. Основные симптомы заболевания.
- От редакции, на основе руководства «Неврология» под ред. М.Самуэльса. Издательство «Практика», 1997. Consilium Medicum, Том 2/N 2/2000
- Sandson TA, Friedman JH. Spinal cord infarction. Report of 8 cases and review of the literature // Medicine (Baltimore). — 1989. — № 68. — С. 282—292.
- Министерство здравоохранения Российской Федерации — принципы диагностики и лечения больных с ОНМК, методические рекомендации
- Коновалов А.Н., Корниенко В.Н., Пронин И.Н. Ишемический инфаркт мозга // Магнитно-резонансная томография в нейрохирургии. — М.:: Видар, 1997. — 472 с. — 1500 экз. — ISBN 5-88429-022-5.
- Ишемический инсульт. Диагноз. www.n-bolezni.ru. Дата обращения: 25 сентября 2010.
- укр. Протокол надання медичної допомоги хворим із забоєм головного мозку тяжкого ступеня // укр. Протоколи надання медичної допомоги хворим з черепно-мозковою травмою. — К.:: "ВІПОЛ", 2006. — С. 6. — 36 с.
- В.В. Михеев, П.В. Мельничук. Нервные болезни. — «Медицина», 1981. — С. 543.
- Donnan GA, Davis SM, Chambers BR et al. Streptokinase for acute ischemic stroke with relationship to time of administration: Australian Streptokinase (ASK) Trial Study Group (англ.) // JAMA. — 1990. — No. 276. — P. 961—966.
- Randomised controlled trial of streptocinase, aspirin, and combination of both in treatment of acute ischaemic stroke. Multicenter Acute Stroke Trial-Italy (MAST-I) Group (англ.) // The Lancet. — Elsevier, 1995. — No. 346. — P. 1509—1514.
- Tissue plasminogen activator for acute ischemic stroke. The National Institute of Neurological Disorders and Stroke rt-PA Stroke Study Group // N Engl J Med. — 1995. — № 333. — С. 1581—1587.
- The Multicenter Acute Stroke Trial-Europe Study Group. Thrombolytic therapy with streptokinase in acute ischemic stroke // N Engl J Med. — 1996. — № 335. — С. 145—150.
- del Zoppo GJ, Higashida RT, Furlan AJ et al. PROACT: a phase II randomized trial of recombinant pro-urokinase by direct delivery in acute middle cerebral artery stroke (англ.) // Stroke. — Lippincott Williams & Wilkins, 1998. — No. 29. — P. 4—11.
- Hacke W, Kaste M, Fieschi C et al. Intravenous thrombolysis with recombinant tissue plasminogen activator for acute hemisphere stroke. The European Cooperative Acute Stroke Study (ECASS) (англ.) // JAMA. — 1995. — No. 274. — P. 1017—1025.
- Clark WM, Wissman S, Albers GW et al. Recombinant tissue-type plasminogen activator (Alteplase) for ischemic stroke 3 to 5 hours after symptom onset: the ATLANTIS Study; a randomized controlled trial. Alteplase-Thrombolysis for Acute Noninterventional Therapy in Ischemic Stroke (англ.) // JAMA. — 1999. — No. 282. — P. 2019—2026.
- Clark WM, Albers GW, Madden KP et al. The rtPA (alteplase) 0-to 6-hour acute stroke trial part A: results of a double-blind, placebo-controlled, multicenter study. Thrombolytic Therapy in Acute Ischemic study investigators (англ.) // Stroke. — Lippincott Williams & Wilkins, 2000. — No. 31. — P. 811—816.
- Furlan A, Higashida R, Wechsler L et al. Intra-arterial prourokinase for acute ischemic stroke: The PROACT II study; a randomized controlled trial. Prolyse in Acute Cerebral Thromboembolism (англ.) // JAMA. — 1999. — No. 282. — P. 2003—2011.
- Hacke W, Kaste M, Wechsler L et al. Randomised double-blind placebo-controlled trial of thrombolytic therapy with intravenous alteplase in acute ischaemic stroke (ECASS II). Second European-Australasian Acute Stroke Study Investigators (англ.) // The Lancet. — Elsevier, 1998. — No. 352. — P. 1245—1251.
- Thrombolytic Therapy in Acute Ischemic Stroke (англ.) (2 января 1997). Дата обращения: 7 ноября 2010. Архивировано 13 августа 2011 года.
- Multicentre Acute Stroke Trial—Italy (англ.) (10 февраля 1996). Дата обращения: 7 ноября 2010. Архивировано 13 августа 2011 года.
- A. John Camm, Thomas F. Luscher, Patrick Serruys. The ESC Textbook of Cardiovascular Medicine. — Wiley-Blackwell, 2006. — 1136 с.
- B.M. Coull, MD; L.S. Williams, MD; L.B. Goldstein et al. Anticoagulants and Antiplatelet Agents in Acute Ischemic Stroke (англ.) // Stroke. — Lippincott Williams & Wilkins, 2002. — No. 33. — P. 1934.
- Stefano Ricci, Maria Grazia Celani, Teresa Anna Cantisani et al. Piracetam for acute ischaemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2006. — No. 2.
- Ziganshina LE, Abakumova T, Kuchaeva A. Cerebrolysin for acute ischaemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2010. — No. 4.
- Muir KW, Lees KR. Excitatory amino acid antagonists for acute stroke (англ.) // Cochrane Database of Systematic Reviews. — 2003. — No. 3.
- Gandolfo C, Sandercock PAG, Conti M. Lubeluzole for acute ischaemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2010. — No. 9.
- Horn J, Limburg M. Calcium antagonists for acute ischemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2010. — No. 9.
- Asplund K. Haemodilution for acute ischaemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2002. — No. 4.
- Bath PMW, Bath-Hextall FJ. Pentoxifylline, propentofylline and pentifylline for acute ischaemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2004. — No. 3.
- Bennett MH, Wasiak J, Schnabel A et al. Hyperbaric oxygen therapy for acute ischaemic stroke (англ.) // Cochrane Database of Systematic Reviews. — 2010. — No. 9.
- Ischemic Stroke (англ.). Merck. Архивировано 13 августа 2011 года.
- А. В. Лаврентьев. Хирургическое лечение окклюзирующих поражений брахиоцефальных артерий. Русский медицинский сервер. Дата обращения: 24 сентября 2010.
