Фосфофруктокиназа-2
Фосфофруктокиназа-2 (ФФК-2) или фруктозо-2,6-бисфосфатаза (ФБФ-2) — бифункциональный фермент, регулирующий процессы гликолиза и глюконеогенеза в теле человека. Этот белок является димером, в котором каждый мономер, в зависимости от внешних условий, может действовать как киназа или фосфатаза. Регулируется глюкагоном и инсулином[1].
| 6-фосфофрукто-2-киназа | |
|---|---|
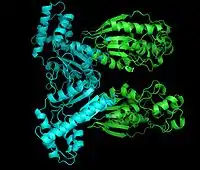 Фосфофруктокиназа-2: киназный домен показан бирюзовым, а фосфатазный - зелёным. | |
| Идентификаторы | |
| Шифр КФ | 2.7.1.105 |
| Номер CAS | 78689-77-7 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 78689-77-7 |
Структура
Каждый мономер данного белка разделён на два функциональных домена. Киназный домен расположен на N-конце[2]. Он состоит из шести-тяжевого бета-листа, в котором пять параллельных тяжей и один антипараллельный тяж, окружённый шестью альфа-спиралями[3]. Этот домен содержит нуклеотид-связывающую укладку (англ. nucleotide-binding fold) на C-конце первого β-тяжа[4], что объединяет его со структурой аденилаткиназы.
Фосфатазный домен расположен на C-конце[5]. Он схож с белками других семейств, таких как фосфоглицератмутазы и кислые фосфатазы[6] Этот домен имеет смешанную α/β-структуру, в которой присутствует шести-тяжевый центральный β-лист и дополнительный α-спиральный субдомен, предположительно покрывающий активный центр фермента молекулы[3]. Наконец, N-конечный регион модулирует активности фосфофруктокиназы-2 и фруктозо-2,6-бисфосфатазы и стабилизирует димерную форму фермента[6][7].
Механизм действия
Когда уровень глюкозы понижен, в кровь выпускается глюкагон, что активирует сигнальный каскад цАМФ-зависимого пути. В печени протеинкиназа A фосфорилирует Ser-32 этого бифункционального фермента (но этого не происходит в скелетных мышцах), что вызывает понижение киназной активности и стимулирует фосфатазную активность[8]. В результате происходит снижения уровня фруктозо-2,6-бисфосфата, которая в норме стимулирует активность фосфофруктокиназы-1, что и приводит к ослаблению гликолиза и стимуляции глюконеогенеза[9].
Когда концентрация глюкозы растёт, повышается и уровень фруктозо-6-фосфата. Фруктозо-6-фосфат стимулирует фосфопротеинфосфатазу-1, которая дефосфорилирует фосфофруктокиназу-2. В результате происходит активация её киназного домена, который катализирует образование Фр-2,6-Ф. Происходит стимуляция гликолиза и подавление глюконеогенеза.
Регуляция
Аллостерическая регуляция ФФК-2/ФБФ-2 схожа с таковой у ФФК-1[10]. Высокий уровень АМФ или неорганического фосфата означает, что в клетке не хватает энергии: такие условия стимулируют ФФК-2. С другой стороны, высокая концентрация фосфоенолпирувата (ФЕП) и цитрата означает, что в клетке много предшественников для биосинтеза АТФ, что ингибирует ФФК-2. В отличие от ФФК-1, активность ФФК-2 не зависит от концентрации АТФ.
Глюкагон подавляет киназную активность фермента, активируя протеинкиназу А, которая фосфорилирует фермент снижая киназную и стимулируя фосфатазную активность; через протеинкиназу А и ФФК-2/ФБФ-2 глюкагон снижает уровень фруктозо-2,6-бисфостфата, что приводит к подавлению гликолиза. Инсулин активирует обратный процесс, активируя протеинфосфатазу, которая дефосфорилирует ФФК-2/ФБФ-2, снижая её фосфатазную и усиливая киназную активность; в результате растёт концентрация фруктозо-2,6-бисфостфата, что активирует гликолиз.
Изоферменты
На сегодняшний день у млекопитающих обнаружено пять изоферментов, часть из них образуется в результате транскрипции отдельных генов, а часть — в результате альтернативного сплайсинга[11][12][13]. Все изоэнзимы радикально отличаются по своей регуляции: способ регуляции, описанный выше описан для самой изученной печёночной изоформы[3].
К генам человека, кодирующим белки с активностью фосфофруктокиназы-2 относятся:
- PFKFB1, PFKFB2, PFKFB3, PFKFB4
Значение для медицины
Было показано, что у европейцев мутации в гене Pfkfb2, кодирующем белок ФФК-2/ФБФ-2, связаны с предрасположенностью к шизофрении[14]. Более того, было обнаружено, что регуляция активности ФФК-2 связана с работой сердца и механизмом, не допускающим развития гипоксии[15].
Примечания
- Нельсон, Кокс, 2014, с. 143—146.
- Kurland I., Chapman B., Lee Y. H., Pilkis S. Evolutionary reengineering of the phosphofructokinase active site: ARG-104 does not stabilize the transition state in 6-phosphofructo-2-kinase. (англ.) // Biochemical and biophysical research communications. — 1995. — Vol. 213, no. 2. — P. 663—672. — doi:10.1006/bbrc.1995.2183. — PMID 7646523.
- Hasemann C. A., Istvan E. S., Uyeda K., Deisenhofer J. The crystal structure of the bifunctional enzyme 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase reveals distinct domain homologies. (англ.) // Structure (London, England : 1993). — 1996. — Vol. 4, no. 9. — P. 1017—1029. — PMID 8805587.
- Walker J. E., Saraste M., Runswick M. J., Gay N. J. Distantly related sequences in the alpha- and beta-subunits of ATP synthase, myosin, kinases and other ATP-requiring enzymes and a common nucleotide binding fold. (англ.) // The EMBO journal. — 1982. — Vol. 1, no. 8. — P. 945—951. — PMID 6329717.
- Li L., Lin K., Pilkis J., Correia J. J., Pilkis S. J. Hepatic 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. The role of surface loop basic residues in substrate binding to the fructose-2,6-bisphosphatase domain. (англ.) // The Journal of biological chemistry. — 1992. — Vol. 267, no. 30. — P. 21588—21594. — PMID 1328239.
- Stryer, Lubert; Berg, Jeremy Mark; Tymoczko, John L. The Balance Between Glycolysis and Gluconeogenesis in the Liver Is Sensitive to Blood-Glucose Concentration // Biochemistry (Looseleaf) (неопр.). — San Francisco: W. H. Freeman, 2008. — С. 466—467. — ISBN 1-4292-3502-0.
- Tominaga N., Minami Y., Sakakibara R., Uyeda K. Significance of the amino terminus of rat testis fructose-6-phosphate, 2-kinase:fructose-2,6-bisphosphatase. (англ.) // The Journal of biological chemistry. — 1993. — Vol. 268, no. 21. — P. 15951—15957. — PMID 8393455.
- Kurland I. J., el-Maghrabi MR, Correia J. J., Pilkis S. J. Rat liver 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. Properties of phospho- and dephospho- forms and of two mutants in which Ser32 has been changed by site-directed mutagenesis. (англ.) // The Journal of biological chemistry. — 1992. — Vol. 267, no. 7. — P. 4416—4423. — PMID 1339450.
- Pilkis S. J., Claus T. H., Kurland I. J., Lange A. J. 6-Phosphofructo-2-kinase/fructose-2,6-bisphosphatase: a metabolic signaling enzyme. (англ.) // Annual review of biochemistry. — 1995. — Vol. 64. — P. 799—835. — doi:10.1146/annurev.bi.64.070195.004055. — PMID 7574501.
- Van Schaftingen E., Hers H.G. Phosphofructokinase 2: the enzyme that forms fructose 2,6-bisphosphate from fructose 6-phosphate and ATP (англ.) // Biochem. Biophys. Res. Commun. : journal. — 1981. — August (vol. 101, no. 3). — P. 1078—1084. — doi:10.1016/0006-291X(81)91859-3. — PMID 6458291.
- Darville M. I., Crepin K. M., Hue L., Rousseau G. G. 5' flanking sequence and structure of a gene encoding rat 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase. (англ.) // Proceedings of the National Academy of Sciences of the United States of America. — 1989. — Vol. 86, no. 17. — P. 6543—6547. — PMID 2549541.
- Tsuchiya Y., Uyeda K. Bovine heart fructose 6-P,2-kinase:fructose 2,6-bisphosphatase mRNA and gene structure. (англ.) // Archives of biochemistry and biophysics. — 1994. — Vol. 310, no. 2. — P. 467—474. — PMID 8179334.
- Sakata J., Abe Y., Uyeda K. Molecular cloning of the DNA and expression and characterization of rat testes fructose-6-phosphate,2-kinase:fructose-2,6-bisphosphatase. (англ.) // The Journal of biological chemistry. — 1991. — Vol. 266, no. 24. — P. 15764—15770. — PMID 1651918.
- Stone W. S., Faraone S. V., Su J., Tarbox S. I., Van Eerdewegh P., Tsuang M. T. Evidence for linkage between regulatory enzymes in glycolysis and schizophrenia in a multiplex sample. (англ.) // American journal of medical genetics. Part B, Neuropsychiatric genetics : the official publication of the International Society of Psychiatric Genetics. — 2004. — Vol. 127B, no. 1. — P. 5—10. — doi:10.1002/ajmg.b.20132. — PMID 15108172.
- Wang Q., Donthi R. V., Wang J., Lange A. J., Watson L. J., Jones S. P., Epstein P. N. Cardiac phosphatase-deficient 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase increases glycolysis, hypertrophy, and myocyte resistance to hypoxia. (англ.) // American journal of physiology. Heart and circulatory physiology. — 2008. — Vol. 294, no. 6. — P. 2889—2897. — doi:10.1152/ajpheart.91501.2007. — PMID 18456722.
Литература
- Д. Нельсон, М. Кокс. Основы биохимии Ленинджера: в 3 т. — М.: БИНОМ, 2014. — Т. 2. — С. 144—146. — 636 с. — ISBN 978-5-94774-366-1.