Убиквитин карбокси-концевая гидролаза L1
Убиквитин карбокси-концевая гидролаза L1 (Шифр КФ 3.1.2.15, убиквитин-С-концевая гидролаза, UCH-L1) представляет собой деубиквитинирующий фермент.
Функция
UCH-L1 является членом семейства генов, продукты которого гидролизуют небольшие С-концевые аддукты убиквитина с образованием мономера убиквитина. Экспрессия UCH-L1 высокоспецифична для нейронов и клеток диффузной нейроэндокринной системы и их опухолей. Он широко присутствует во всех нейронах (составляет 1-2 % от общего белка мозга), специфически экспрессируется в нейронах и семенниках/яичниках[1][2].
Каталитическая триада UCH-L1 содержит цистеин в положении 90, аспартат в положении 176 и гистидин в положении 161, которые отвечают за его гидролазную активность[3].
Актуальность для нейродегенеративных расстройств
Точечная мутация (I93M) в гене, кодирующем этот белок, считается причиной болезни Паркинсона в одной немецкой семье, хотя это открытие является спорным, поскольку других пациентов с болезнью Паркинсона с этой мутацией обнаружено не было[4][5].
Кроме того, было обнаружено, что полиморфизм (S18Y) в этом гене связан со снижением риска болезни Паркинсона[6]. В частности, было показано, что этот полиморфизм обладает антиоксидантной активностью[7].
Другой потенциально защитной функцией UCH-L1 является его способность стабилизировать моноубиквитин, важный компонент протеасомной системы убиквитина. Считается, что, стабилизируя мономеры убиквитина и тем самым предотвращая их деградацию, UCH-L1 увеличивает доступный пул убиквитина, который должен быть помечен на белках, предназначенных для деградации протеасомой[8].
Ген также связан с болезнью Альцгеймера и необходим для нормальной синаптической и когнитивной функции[9]. Потеря UCH-L1 увеличивает восприимчивость бета-клеток поджелудочной железы к запрограммированной гибели клеток, что указывает на то, что этот белок играет защитную роль в нейроэндокринных клетках, и иллюстрирует связь между диабетом и нейродегенеративными заболеваниями[10].
У пациентов с ранней нейродегенерацией, у которых причинная мутация была в гене UCH-L1 (в частности, в связывающем домене убиквитина, E7A), демонстрируют слепоту, мозжечковую атаксию, нистагм, дисфункцию спинного столба и дисфункцию верхних мотонейронов[11].
Эктопическая экспрессия
Хотя экспрессия белка UCH-L1 специфична для нейронов и ткани яичка/яичника, было обнаружено, что он экспрессируется в определённых линиях клеток опухоли легких[12]. Эта аномальная экспрессия UCH-L1 вовлечена в ракообразование и привела к обозначению UCH-L1 как онкогена[13]. Кроме того, есть доказательства того, что UCH-L1 может играть роль в патогенезе мембранного гломерулонефрита, поскольку экспрессия UCH-L1 de novo в подоцитах наблюдалась в PHN, крысиной модели mGN человека[14]. Считается, что эта экспрессия UCH-L1 вызывает, по крайней мере, частичную гипертрофию подоцитов[15].
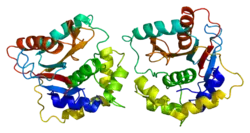
Белковая структура
Человеческий UCH-L1 и близкородственный белок UCHL3 имеют одну из самых сложных узловых структур из когда-либо обнаруженных у белков, с пятью пересечениями узлов. Предполагается, что структура узла может повысить устойчивость белка к деградации в протеасоме[16][17].
Конформация белка UCH-L1 также может быть важным признаком нейропротекции или патологии. Например, было показано, что димер UCH-L1 проявляет потенциально патогенную лигазную активность и может приводить к вышеупомянутому увеличению агрегации α-синуклеина[18]. Было показано, что полиморфизм S18Y UCH-L1 менее склонен к димеризации[8].
Взаимодействия
Убиквитин карбоксиконцевая гидролаза L1, как было показано, взаимодействует с субъединицей 5 конститутивного фотоморфогенного гомолога COP9[19].
Также было показано, что UCH-L1 взаимодействует с α-синуклеином, другим белком, участвующим в патологии болезни Паркинсона . Сообщается, что эта активность является результатом его активности убиквитиллигазы, которая может быть связана с патогенной мутацией I93M в гене[18].
Совсем недавно было продемонстрировано, что UCH-L1 взаимодействует с лигазой E3, паркином. Было продемонстрировано, что паркин связывает и убиквитинилирует UCH-L1, способствуя лизосомной деградации UCH-L1[20].
См. также
- Убиквитинкарбоксиконцевая эстераза L3 — ген UCHL3
- Альфа-синуклеин
- болезнь Паркинсона
- Протеасома
Примечания
- “Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis”. Journal of Neurochemistry. 40 (6): 1542—7. Jun 1983. DOI:10.1111/j.1471-4159.1983.tb08124.x. PMID 6343558.
- Entrez Gene: UCHL1 ubiquitin carboxyl-terminal esterase L1 (ubiquitin thiolesterase).
- “Structural basis for conformational plasticity of the Parkinson's disease-associated ubiquitin hydrolase UCH-L1”. Proceedings of the National Academy of Sciences of the United States of America. 103 (12): 4675—80. Mar 2006. DOI:10.1073/pnas.0510403103. PMID 16537382.
- “The ubiquitin pathway in Parkinson's disease”. Nature. 395 (6701): 451—2. Oct 1998. DOI:10.1038/26652. PMID 9774100.
- “The Ile93Met mutation in the ubiquitin carboxy-terminal-hydrolase-L1 gene is not observed in European cases with familial Parkinson's disease”. Neuroscience Letters. 270 (1): 1—4. Jul 1999. DOI:10.1016/s0304-3940(99)00465-6. PMID 10454131.
- “ACT and UCH-L1 polymorphisms in Parkinson's disease and age of onset”. Movement Disorders. 17 (4): 767—71. Jul 2002. DOI:10.1002/mds.10179. PMID 12210873.
- “The S18Y polymorphic variant of UCH-L1 confers an antioxidant function to neuronal cells”. Human Molecular Genetics. 17 (14): 2160—71. Jul 2008. DOI:10.1093/hmg/ddn115. PMID 18411255.
- “Ubiquitin carboxy-terminal hydrolase L1 binds to and stabilizes monoubiquitin in neuron”. Human Molecular Genetics. 12 (16): 1945—58. Aug 2003. DOI:10.1093/hmg/ddg211. PMID 12913066.
- “Ubiquitin hydrolase Uch-L1 rescues beta-amyloid-induced decreases in synaptic function and contextual memory”. Cell. 126 (4): 775—88. Aug 2006. DOI:10.1016/j.cell.2006.06.046. PMID 16923396.
- “Ubiquitin C-terminal hydrolase L1 is required for pancreatic beta cell survival and function in lipotoxic conditions”. Diabetologia. 55 (1): 128—40. Jan 2012. DOI:10.1007/s00125-011-2323-1. PMID 22038515.
- “Recessive loss of function of the neuronal ubiquitin hydrolase UCHL1 leads to early-onset progressive neurodegeneration”. Proceedings of the National Academy of Sciences of the United States of America. 110 (9): 3489—94. Feb 2013. DOI:10.1073/pnas.1222732110. PMID 23359680.
- “Discovery of inhibitors that elucidate the role of UCH-L1 activity in the H1299 lung cancer cell line”. Chemistry & Biology. 10 (9): 837—46. Sep 2003. DOI:10.1016/j.chembiol.2003.08.010. PMID 14522054.
- “The de-ubiquitinase UCH-L1 is an oncogene that drives the development of lymphoma in vivo by deregulating PHLPP1 and Akt signaling”. Leukemia. 24 (9): 1641—55. Sep 2010. DOI:10.1038/leu.2010.138. PMID 20574456.
- “A new role for the neuronal ubiquitin C-terminal hydrolase-L1 (UCH-L1) in podocyte process formation and podocyte injury in human glomerulopathies”. The Journal of Pathology. 217 (3): 452—64. Feb 2009. DOI:10.1002/path.2446. PMID 18985619.
- “UCH-L1 induces podocyte hypertrophy in membranous nephropathy by protein accumulation”. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease. 1842 (7): 945—58. Jul 2014. DOI:10.1016/j.bbadis.2014.02.011. PMID 24583340.
- Peterson. Knots in proteins. Science News (14 октября 2006). Дата обращения: 11 сентября 2008. Архивировано 21 апреля 2008 года.
- “Intricate knots in proteins: Function and evolution”. PLOS Computational Biology. 2 (9): e122. Sep 2006. DOI:10.1371/journal.pcbi.0020122. PMID 16978047.
- “The UCH-L1 gene encodes two opposing enzymatic activities that affect alpha-synuclein degradation and Parkinson's disease susceptibility”. Cell. 111 (2): 209—18. Oct 2002. DOI:10.1016/s0092-8674(02)01012-7. PMID 12408865.
- “Interaction and colocalization of PGP9.5 with JAB1 and p27(Kip1)”. Oncogene. 21 (19): 3003—10. May 2002. DOI:10.1038/sj.onc.1205390. PMID 12082530.
- “Parkin-mediated K63-polyubiquitination targets ubiquitin C-terminal hydrolase L1 for degradation by the autophagy-lysosome system”. Cellular and Molecular Life Sciences. 72 (9): 1811—24. May 2015. DOI:10.1007/s00018-014-1781-2. PMID 25403879.
Дальнейшее чтение
- Healy DG, Abou-Sleiman PM, Wood NW (Oct 2004). “Genetic causes of Parkinson's disease: UCHL-1”. Cell and Tissue Research. 318 (1): 189—94. DOI:10.1007/s00441-004-0917-3. PMID 15221445.
- Rasmussen HH, van Damme J, Puype M, Gesser B, Celis JE, Vandekerckhove J (Dec 1992). “Microsequences of 145 proteins recorded in the two-dimensional gel protein database of normal human epidermal keratinocytes”. Electrophoresis. 13 (12): 960—9. DOI:10.1002/elps.11501301199. PMID 1286667.
- Edwards YH, Fox MF, Povey S, Hinks LJ, Thompson RJ, Day IN (Oct 1991). “The gene for human neurone specific ubiquitin C-terminal hydrolase (UCHL1, PGP9.5) maps to chromosome 4p14”. Annals of Human Genetics. 55 (Pt 4): 273—8. DOI:10.1111/j.1469-1809.1991.tb00853.x. PMID 1840236.
- Honoré B, Rasmussen HH, Vandekerckhove J, Celis JE (Mar 1991). “Neuronal protein gene product 9.5 (IEF SSP 6104) is expressed in cultured human MRC-5 fibroblasts of normal origin and is strongly down-regulated in their SV40 transformed counterparts”. FEBS Letters. 280 (2): 235—40. DOI:10.1016/0014-5793(91)80300-R. PMID 1849484.
- Day IN, Hinks LJ, Thompson RJ (Jun 1990). “The structure of the human gene encoding protein gene product 9.5 (PGP9.5), a neuron-specific ubiquitin C-terminal hydrolase”. The Biochemical Journal. 268 (2): 521—4. DOI:10.1042/bj2680521. PMC 1131465. PMID 2163617.
- Day IN, Thompson RJ (Jan 1987). “Molecular cloning of cDNA coding for human PGP 9.5 protein. A novel cytoplasmic marker for neurones and neuroendocrine cells”. FEBS Letters. 210 (2): 157—60. DOI:10.1016/0014-5793(87)81327-3. PMID 2947814.
- Doran JF, Jackson P, Kynoch PA, Thompson RJ (Jun 1983). “Isolation of PGP 9.5, a new human neurone-specific protein detected by high-resolution two-dimensional electrophoresis”. Journal of Neurochemistry. 40 (6): 1542—7. DOI:10.1111/j.1471-4159.1983.tb08124.x. PMID 6343558.
- Onno M, Nakamura T, Mariage-Samson R, Hillova J, Hill M (Mar 1993). “Human TRE17 oncogene is generated from a family of homologous polymorphic sequences by single-base changes”. DNA and Cell Biology. 12 (2): 107—18. DOI:10.1089/dna.1993.12.107. PMID 8471161.
- Larsen CN, Price JS, Wilkinson KD (May 1996). “Substrate binding and catalysis by ubiquitin C-terminal hydrolases: identification of two active site residues”. Biochemistry. 35 (21): 6735—44. DOI:10.1021/bi960099f. PMID 8639624.
- Best CL, Pudney J, Welch WR, Burger N, Hill JA (Apr 1996). “Localization and characterization of white blood cell populations within the human ovary throughout the menstrual cycle and menopause”. Human Reproduction. 11 (4): 790—7. DOI:10.1093/oxfordjournals.humrep.a019256. PMID 8671330.
- D'Andrea V, Malinovsky L, Berni A, Biancari F, Biassoni L, Di Matteo FM, Corbellini L, Falvo L, Santoni F, Spyrou M, De Antoni E (Oct 1997). “The immunolocalization of PGP 9.5 in normal human kidney and renal cell carcinoma”. Il Giornale di Chirurgia. 18 (10): 521—4. PMID 9435142.
- Larsen CN, Krantz BA, Wilkinson KD (Mar 1998). “Substrate specificity of deubiquitinating enzymes: ubiquitin C-terminal hydrolases”. Biochemistry. 37 (10): 3358—68. DOI:10.1021/bi972274d. PMID 9521656.
- Leroy E, Boyer R, Auburger G, Leube B, Ulm G, Mezey E, Harta G, Brownstein MJ, Jonnalagada S, Chernova T, Dehejia A, Lavedan C, Gasser T, Steinbach PJ, Wilkinson KD, Polymeropoulos MH (Oct 1998). “The ubiquitin pathway in Parkinson's disease”. Nature. 395 (6701): 451—2. DOI:10.1038/26652. PMID 9774100.
- Wada H, Kito K, Caskey LS, Yeh ET, Kamitani T (Oct 1998). “Cleavage of the C-terminus of NEDD8 by UCH-L3”. Biochemical and Biophysical Research Communications. 251 (3): 688—92. DOI:10.1006/bbrc.1998.9532. PMID 9790970.
- Leroy E, Boyer R, Polymeropoulos MH (Dec 1998). “Intron-exon structure of ubiquitin c-terminal hydrolase-L1”. DNA Research. 5 (6): 397—400. DOI:10.1093/dnares/5.6.397. PMID 10048490.
- Lincoln S, Vaughan J, Wood N, Baker M, Adamson J, Gwinn-Hardy K, Lynch T, Hardy J, Farrer M (Feb 1999). “Low frequency of pathogenic mutations in the ubiquitin carboxy-terminal hydrolase gene in familial Parkinson's disease”. NeuroReport. 10 (2): 427—9. DOI:10.1097/00001756-199902050-00040. PMID 10203348.
- Harhangi BS, Farrer MJ, Lincoln S, Bonifati V, Meco G, De Michele G, Brice A, Dürr A, Martinez M, Gasser T, Bereznai B, Vaughan JR, Wood NW, Hardy J, Oostra BA, Breteler MM (Jul 1999). “The Ile93Met mutation in the ubiquitin carboxy-terminal-hydrolase-L1 gene is not observed in European cases with familial Parkinson's disease”. Neuroscience Letters. 270 (1): 1—4. DOI:10.1016/S0304-3940(99)00465-6. PMID 10454131.
- Saigoh K, Wang YL, Suh JG, Yamanishi T, Sakai Y, Kiyosawa H, Harada T, Ichihara N, Wakana S, Kikuchi T, Wada K (Sep 1999). “Intragenic deletion in the gene encoding ubiquitin carboxy-terminal hydrolase in gad mice”. Nature Genetics. 23 (1): 47—51. DOI:10.1038/12647. PMID 10471497.
- Mellick GD, Silburn PA (Oct 2000). “The ubiquitin carboxy-terminal hydrolase-L1 gene S18Y polymorphism does not confer protection against idiopathic Parkinson's disease”. Neuroscience Letters. 293 (2): 127—30. DOI:10.1016/S0304-3940(00)01510-X. PMID 11027850.
- Sharma N, McLean PJ, Kawamata H, Irizarry MC, Hyman BT (Oct 2001). “Alpha-synuclein has an altered conformation and shows a tight intermolecular interaction with ubiquitin in Lewy bodies”. Acta Neuropathologica. 102 (4): 329—34. DOI:10.1007/s004010100369. PMID 11603807.