Моноацилглицероллипаза
Моноацилглицероллипаза, также известная как МАГ липаза, ацилглицероллипаза, МАГЛ, МГЛ или МГЛЛ является ферментом, который, в организме человека, кодируются геном Mgll[1][2][3]. МГЛ является 33-кДа мембраносвязанным членом суперсемейства сериновых гидролаз и содержит классическую консенсусную последовательность GXSXG, общую для большинства сериновых гидролаз. Каталитическая триада фермента идентифицирована как Ser122, His269 и Asp239[2][4].
| Моноацилглицероллипаза | |
|---|---|
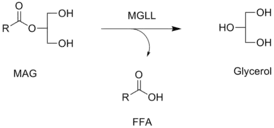 Реакция, катализируемая МГЛ, в которой свободная жирная кислота высвобождается из моноацилглицерина (МАГ) | |
| Идентификаторы | |
| Шифр КФ | 3.1.1.23 |
| Номер CAS | 9040-75-9 |
| Базы ферментов | |
| IntEnz | IntEnz view |
| BRENDA | BRENDA entry |
| ExPASy | NiceZyme view |
| MetaCyc | metabolic pathway |
| KEGG | KEGG entry |
| PRIAM | profile |
| PDB structures | RCSB PDB PDBe PDBj PDBsum |
| Gene Ontology | AmiGO • EGO |
| Поиск | |
| PMC | статьи |
| PubMed | статьи |
| NCBI | NCBI proteins |
| CAS | 9040-75-9 |
| Моноацилглицероллипаза | |
|---|---|
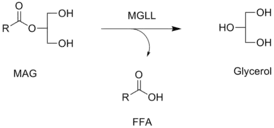 | |
| Обозначения | |
| Символы | MGLL |
| Entrez Gene | 11343 |
| HGNC | 17038 |
| OMIM | 609699 |
| RefSeq | NM_007283 |
| UniProt | Q99685 |
| Другие данные | |
| Шифр КФ | 3.1.1.23 |
| Локус | 3-я хр. , 3p13 -q13.33 |
Функция
Моноацилглицероллипаза катализирует химическую реакцию, в которой молекулы воды разрушают моноэфиры глицерина и длинноцепочечной жирной кислоты. Она функционирует вместе с гормон-чувствительной липазой, гидролизуя внутриклеточные запасы триглицеридов в адипоцитах и других клетках до жирных кислот и глицерина. МГЛ может также дополнять липопротеинлипазу (ЛПЛ) в завершении гидролиза моноглицеридов, возникающего в результате разложения триглицеридов липопротеинов[5].
Моноацилглицероллипаза является ключевым ферментом в гидролизе эндоканнабиноидного 2-арахидоноилглицерина (2-АГ)[6][7]. Он превращает моноацилглицерины в свободные жирные кислоты и глицерин. Вклад МГЛ в общую активность гидролиза 2-АГ мозга оценивается в ~ 85 % (ABHD6 и ABHD12 отвечают за ~ 4 % и ~ 9 %, соответственно, оставшейся части)[8][9], и это оценка in vitro была подтверждена in vivo селективным ингибитором МГЛ JZL184[10]. Хроническая инактивация МГЛ приводит к массивному (>10-кратному) повышению уровня 2-АГ в мозге у мышей, наряду с выраженной компенсаторной понижающей регуляцией рецепторов CB1 в селективных областях мозга[11].
Ингибиторы
Ингибиторы фермента MAGL (URB602, URB754, JZL184) вызывают у мышей каннабиноидные поведенческие эффекты[10].
Дополнительные примеры включают:
- KML-29
- JZL195
- JNJ-42165279
- JW 642
См. также
- Усилитель эндоканнабиноидов
- Ингибитор обратного захвата эндоканнабиноидов
- Триацилглицероллипаза
- Гидролаза амидов жирных кислот
Примечания
- “A novel poxvirus gene and its human homolog are similar to an E. coli lysophospholipase”. Virus Research. 52 (2): 157—67. December 1997. DOI:10.1016/S0168-1702(97)00122-6. PMID 9495531.
- “cDNA cloning, tissue distribution, and identification of the catalytic triad of monoglyceride lipase. Evolutionary relationship to esterases, lysophospholipases, and haloperoxidases”. The Journal of Biological Chemistry. 272 (43): 27218—23. October 1997. DOI:10.1074/jbc.272.43.27218. PMID 9341166.
- Entrez Gene: monoglyceride lipase.
- “Purification and some properties of a monoacylglycerol-hydrolyzing enzyme of rat adipose tissue”. The Journal of Biological Chemistry. 251 (3): 813—9. February 1976. DOI:10.1016/S0021-9258(17)33857-7. PMID 1249056.
- “Exon-intron organization and chromosomal localization of the mouse monoglyceride lipase gene”. Gene. 272 (1—2): 11—8. July 2001. DOI:10.1016/S0378-1119(01)00559-5. PMID 11470505.
- “Brain monoglyceride lipase participating in endocannabinoid inactivation”. Proceedings of the National Academy of Sciences of the United States of America. 99 (16): 10819—24. August 2002. DOI:10.1073/pnas.152334899. PMID 12136125.
- “Selective inhibition of 2-AG hydrolysis enhances endocannabinoid signaling in hippocampus”. Nature Neuroscience. 8 (9): 1139—41. September 2005. DOI:10.1038/nn1521. PMID 16116451.
- PhD, Q Ashton Acton. Cannabinoid Receptors ScholarlyBrief.. — Atlanta, GA: Scholarly Media LLC, 2012. — 1 online resource (96 p.) с. — ISBN 978-1-4816-0672-1, 1-4816-0672-7.
- “A comprehensive profile of brain enzymes that hydrolyze the endocannabinoid 2-arachidonoylglycerol”. Chemistry & Biology. 14 (12): 1347—56. December 2007. DOI:10.1016/j.chembiol.2007.11.006. PMID 18096503.
- “Selective blockade of 2-arachidonoylglycerol hydrolysis produces cannabinoid behavioral effects”. Nature Chemical Biology. 5 (1): 37—44. January 2009. DOI:10.1038/nchembio.129. PMID 19029917.
- Savinainen JR, Saario SM, Laitinen JT (February 2012). “The serine hydrolases MAGL, ABHD6 and ABHD12 as guardians of 2-arachidonoylglycerol signalling through cannabinoid receptors”. Acta Physiologica. 204 (2): 267—76. DOI:10.1111/j.1748-1716.2011.02280.x. PMC 3320662. PMID 21418147.
Дальнейшее чтение
- “Simultaneous purification and comparative characterization of six serine hydrolases from rat liver microsomes”. Arch. Biochem. Biophys. 200 (2): 547&ndash, 59. 1980. DOI:10.1016/0003-9861(80)90386-0. PMID 6776896.
- “A study of a monoglyceride-hydrolyzing enzyme of intestinal mucosa”. J. Biol. Chem. 241 (10): 2306&ndash, 10. 1966. DOI:10.1016/S0021-9258(18)96621-4. PMID 5916497.
Ссылки
Эта статья содержит текст из Национальной библиотеки медицины США, который находится в общественном достоянии.