Фруктозо-2,6-бисфосфат
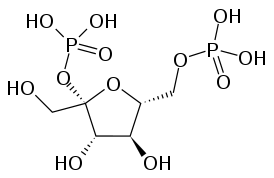
Фруктозо-2,6-бисфосфат[1] (фруктозо-2,6-дифосфат, Фр-2,6-Ф, Fru-2,6-P2) — регуляторная молекула всех эукариот, аллостерически, влияющая на активность ферментов фосфофруктокиназы 1 (ФФК-1) и фруктозо-1,6-бисфосфатазы (ФБФаза-1). Усиливает гликолиз и подавляет глюконеогенез[2]. Представляет собой эфир фосфорной кислоты и фруктозы.
| Фруктозо-2,6-бисфосфат | |
|---|---|
 | |
| Общие | |
| Сокращения | Фр-2,6-Ф; Fru-2,6-P2 |
| Хим. формула | C6H14O12P2 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 340,116 г/моль |
| Плотность | 2,06 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | 760,3 °C |
| • воспламенения | 413,6 °C |
| Давление пара | 1,11E-26 мм рт. ст. при 25°C |
| Оптические свойства | |
| Показатель преломления | 1,609 |
| Классификация | |
| Рег. номер CAS | 79082-92-1 |
| PubChem | 105021 |
| SMILES | |
| InChI | |
| ChEBI | 28602 |
| ChemSpider | 21106440 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
У растений и животных синтез и распад Фр-2,6-Ф осуществляется фосфофруктокиназой-2/фруктозо-2,6-бисфосфатазой (ФФК-2/ФБФ-2) — бифункциональным ферментом с двумя активными центрами[3]. Фр-2,6-Ф образуется путём фосфорилирования фруктозо-6-фосфата с использованием одной молекулы АТФ, а в результате деградации распадается на фруктозо-6-фосфат и Фн[4][5].
История открытия
Фруктозо-2,6-бисфосфат был открыт через 71 год после того, как Янг в лаборатории Гардена выделил из дрожжей первый двойной эфир фруктозы и фосфорной кислоты, который позже был идентифицирован как фруктозо-1,6-бисфосфат[6]. В 1979 году четыре группы исследователей сообщили, что в гепатоцитах, инкубированных в присутствии гормона глюкагона, происходит снижение активности фермента фосфофруктокиназы-1. В 1980 году Эмили Ван Шафтинген и коллеги[7] показали, что этот эффект исчезает после проведения гель фильтрации или очистки фермента. Далее, они показали, что можно добиться усиления активности фосфофруктокиназы-1 просто добавив к гепатоцитам низкомолекулярную фракцию, полученную после ультрацентрифугирования экстракта печени. Выделенный из этой фракции низкомолекулярный стимулятор был идентифицирован исследователями как фруктозо-2,6-бисфосфат[8].
Влияние на метаболизм глюкозы у животных
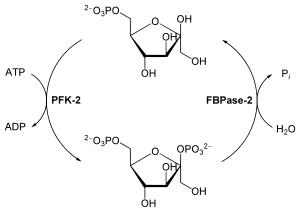
Фруктозо-2,6-бисфосфат стимулирует распад глюкозы, аллостерически активируя фосфофруктокиназу 1. Например, в печени высокая концентрация Фр-2,6-Ф активирует ФФК-1, увеличивая её сродство к фруктозо-6-фосфату и снижая сродство к её прямым ингибиторам: АТФ и цитрату. В своей физиологической концентрации ФФК-1 практически полностью не активна, но взаимодействие с Фр-2,6-Ф переводит фермент в активную форму и стимулирует гликолиз[2]. Помимо этого фруктозо-2,6-бисфосфат ингибирует фруктозо-1,6-бисфосфатазу, что предотвращает распад образовавшегося фруктозо-1,6-бисфосфата. Таким образом Фр-2,6-Ф не даёт одновременно идти процессам гликолиза и глюконеогенеза, что могло бы привести к бесполезному циклу, в котором глюкоза бесконечно превращалась бы в пируват, а затем обратно в глюкозу.
Уровень Фр-2,6-Ф в клетке контролируется через регуляцию его синтеза и распада ферментом ФФК-2/ФБФазой-2. Основную роль в этом процессе играют гормоны инсулин, глюкагон и адреналин, которые воздействуют на фермент через фосфорилирование/дефосфорилирование. Так, глюкагон активирует аденилатциклазу печени и запускает синтез цАМФ, который, в свою очередь, активирует цАМФ-зависимую протеинкиназу. Эта киназа фосфорилирует ФФК-2/ФБФазу-2 по N-концевому остатку серина, что стимулирует фруктозо-2,6-бисфосфатазную активность и подавляет его работу как фосфофруктокиназы-2. Происходит снижение уровня Фр-2,6-Ф в клетке. В условиях низкого уровня Фр-2,6-Ф гликолиз подавляется, в то время как глюконеогенез, напротив, усиливается. Инсулин запускает обратный процесс. При повышении его концентрации происходит снижение уровня цАМФ, что в свою очередь активирует протеинфосфатазу, которая дефосфорилирует ФФК-2/ФБФазу-2, активируя фосфофруктокиназную-2 и подавляя фруктозо-2,6-бисфосфатазную активность. Таким образом, повышение уровня Фр-2,6-Ф активирует фермент ФФК-1 и стимулирует гликолиз, подавляя глюконеогенез[4][9][10].
Влияние на метаболизм глюкозы у грибов
В целом, действие фруктозо-2,6-бисфосфата у грибов аналогично таковому у животных: повышение его концентрации стимулирует гликолиз и подавляет глюконеогенез. У части грибов фермент, ответственный за синтез Фр-2,6-Ф, не чувствителен к уровню цАМФ и АТФ. Вместо этого регуляция ФФК-2/ФБФ-2 осуществляется по уровню основного субстрата — фруктозо-6-фосфата и общего количества источника углерода[11][12]. У другой части грибов, в том числе и у дрожжей, напротив, есть цАМФ-зависимый путь регуляции ФФК-2/ФБФ-2, а его фосфофруктокиназная активность подавляется высокими уровнями АТФ[13][14]. В целом, нельзя выделить какой-то общий для всех грибов механизм регуляции уровня Фр-2,6-Ф. Скорее всего, он сильно зависит от его образа жизни и занимаемой грибом экологической ниши.
Регуляция синтеза сахарозы у растений
У растений, в отличие от животных, фруктозо-2,6-фосфат не действует на АТФ-зависимую фосфофруктокиназу 1, но чётко стимулирует пирофосфат-зависимую фосфофруктокиназу, которая фосфорилирует фруктозо-6-фосфат, используя неорганический пирофосфат, и ингибирует фосфатазу[15]. Фр-2,6-Ф играет важную роль в регуляции уровня триозофосфатов, конечного продукта цикла Кальвина. Он ингибирует образование фруктозо-6-фосфата, основного субстрата для синтеза сахарозы. При интенсивном фотосинтезе происходит постоянное образование триозофосфатов (глицеральдегид-3-фосфата и 3-фосфоглицерата), которые аллостерически взаимодействуют с ФФК-2/ФБФазой-2 и ингибируют синтез фруктозо-2,6-бисфосфата, стимулируя таким образом образование сахарозы. Фр-2,6-Ф начинает синтезироваться в темноте, когда не идут процессы фотосинтеза и образования триозофосфатов. У растений этот процесс аллостерически активизируется неорганическим фосфатом и фруктозо-6-фосфатом[16]. Таким образом, синтез регуляторной молекулы сложным образом зависит от соотношения С6/С3 сахаров в растительной клетке. На это соотношение будет активно влиять интенсивность синтеза сахарозы и транспорт в хлоропласты Фн в обмен на триозофосфат[15].
Примечания
- Биологическая химия с упражнениями и задачами / Под ред. С. Е. Северина. — М.: Издательская группа «ГЭОТАР-Медиа», 2011. — С. 95. — 624 с.
- Lange AJ. fructose-2,6-bisphosphate. University of Minnesota.
- Wu C., Khan S. A., Peng L. J., Lange A. J. Roles for fructose-2,6-bisphosphate in the control of fuel metabolism: beyond its allosteric effects on glycolytic and gluconeogenic enzymes (англ.) // Adv. Enzyme Regul. : journal. — 2006. — Vol. 46, no. 1. — P. 72—88. — doi:10.1016/j.advenzreg.2006.01.010. — PMID 16860376.
- Kurland I. J., Pilkis S. J. Covalent control of 6-phosphofructo-2-kinase/fructose-2,6-bisphosphatase: insights into autoregulation of a bifunctional enzyme (англ.) // Protein Sci. : journal. — 1995. — June (vol. 4, no. 6). — P. 1023—1037. — doi:10.1002/pro.5560040601. — PMID 7549867.
- Michels P. A., Rigden D. J. Evolutionary analysis of fructose 2,6-bisphosphate metabolism. (англ.) // IUBMB life. — 2006. — Vol. 58, no. 3. — P. 133—141. — doi:10.1080/15216540600688280. — PMID 16766380.
- Selected Topics in the History of Biochemistry: Personal Recollections (page 77)
- E. Van Schaftingen, L. Hue, and H. G. Hers. Fructose 2,6-bisphosphate, the probably structure of the glucose- and glucagon-sensitive stimulator of phosphofructokinase. (англ.) // Biochem J. : journal. — 1980. — 15 December (vol. 192, no. 3). — P. 897—901.
- H. G. Hers and E. Van Schaftingen. Fructose 2,6-bisphosphate 2 years after its discovery. (англ.) // Biochem J. : journal. — 1982. — 15 July (vol. 206, no. 1). — P. 1—12.
- Smith W. E., Langer S., Wu C., Baltrusch S., Okar D. A. Molecular coordination of hepatic glucose metabolism by the 6-phosphofructo-2-kinase/fructose-2,6- bisphosphatase:glucokinase complex (англ.) // Mol. Endocrinol. : journal. — 2007. — June (vol. 21, no. 6). — P. 1478—1487. — doi:10.1210/me.2006-0356. — PMID 17374851.
- Нельсон, Кокс, 2014, с. 144—146.
- José Abrahão Neto. Characterization of phosphofructokinase II and regulation of fructose 2,6-bisphosphate levels in Trichoderma reesei (англ.) // Microbiology : journal. — 1993. — June (vol. 139). — P. 1363—1369. — doi:10.1099/00221287-139-6-1363.
- Vandercammen A1, François J. M., Torres B. B., Maia J. C., Hers H. G. Fructose 2,6-bisphosphate and carbohydrate metabolism during the life cycle of the aquatic fungus Blastocladiella emersonii. (англ.) // Microbiology : journal. — Microbiology Society, 1990. — January (vol. 136, no. 1). — P. 137—146. — PMID 2161899.
- Gandhi Radis-BaptistaDavid N., Urquizo Valdivia, José Abrahão-Neto. Fructose 2,6-bisphosphate biosynthesis and regulation of carbohydrate metabolism in Aspergillus oryzae (англ.) // Canadian Journal of Microbiology : journal. — NRC Research Press, 2011. — January (vol. 44, no. 1). — P. 6—11. — doi:10.1139/w97-129.
- Dihazi H1, Kessler R., Eschrich K. Glucose-induced stimulation of the Ras-cAMP pathway in yeast leads to multiple phosphorylations and activation of 6-phosphofructo-2-kinase. (англ.) // Biochemistry : journal. — 2003. — 27 May (vol. 42, no. 20). — P. 6275—6282. — doi:10.1021/bi034167r. — PMID 12755632.
- Ермаков, 2005, с. 223.
- Nielsen T. H., Rung J. H., Villadsen D. Fructose-2,6-bisphosphate: a traffic signal in plant metabolism (англ.) // Trends Plant Sci. : journal. — 2004. — November (vol. 9, no. 11). — P. 556—563. — doi:10.1016/j.tplants.2004.09.004. — PMID 15501181.
Литература
- Д. Нельсон, М. Кокс. Основы биохимии Ленинджера: в 3 т. — М.: БИНОМ, 2014. — Т. 2. — С. 144—146. — 636 с. — ISBN 978-5-94774-366-1.
- Физиология растений / Под ред. И. П. Ермакова. — М.: Академия, 2005. — 634 с.