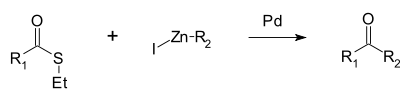Сложные тиоэфиры
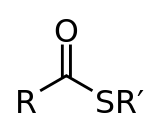
Сложные тиоэфиры — органические соединения, содержащие функциональную группу C-S-CO-C и являющиеся сложными эфирами тиолов и карбоновых кислот. Сложные тиоэфиры играют важную роль в биохимических процессах, наиболее известный представитель этого класса — ацетил-CoA.
Получение
Способы получения сложных тиоэфиров разнообразны,[1] но важнейшим является конденсация тиолов и карбоновых кислот в присутствии водоотнимающих реагентов[2] (например, N,N'-дициклогексилкарбодиимида[3] (DCC, ДЦК):
- RSH + R’CO2H → RSC(O)R' + H2O
Ангидриды карбоновых кислот и некоторые лактоны реагируют подобным же образом с тиолами в присутствии оснований.
Сложные тиоэфиры удобно получать по реакции Мицунобу из спиртов и тиокислот (например, тиоацетаты из тиоуксусной кислоты[4]).
Также они могут быть получены карбонилированием алкенов и алкинов в присутствии тиолов.[5]
Реакции
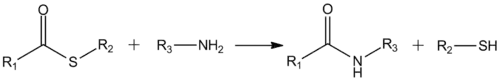
Карбонильная группа сложных тиоэфиров реакционноспособна по отношению к атаке нуклеофилами (в меньшей степени по сравнению с хлорангидридами кислот). Так, сложные тиоэфиры реагирут с аминами с образованием амидов:
Уникальна для сложных тиоэфиров реакция Фукуямы: при взаимодействии с цинкорганическим соединенем в присутствии палладиевого катализатора образуются кетоны.
Атомы водорода в α-положении к карбонильной группе сложных тиоэфиров проявляют умеренную кислотность, поэтому сложные тиоэфиры подвержены альдольной конденсации. Эта реакция имеет значение для биосинтеза жирных кислот.
Биохимия
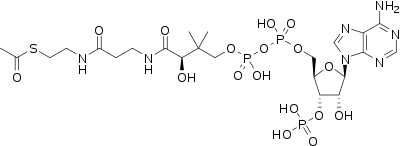
Сложные тиоэфиры — обычные интермедиаты во многих биохимических превращения, включая образование и распад жирных кислот и мевалоната — синтетического предшественника стероидов. Биосинтез лигнинов, составляющих значительную часть биомассы, протекает через образование сложного тиоэфира кофейной кислоты.[6] Другие примеры сложных тиоэфиров — малонил-CoA, ацетоацетил-CoA, пропионил-CoA и циннамоил-CoA. Ацетогенез протекает через образование ацетил-CoA. Сложные тиоэфиры образуются в живых организмах в результате реакций эстерификации, причем АТФ играет роль дегидратирующего агента. Они также играют ключевую роль в убиквитинировании протеинов убиквитинлигазами, помечающими белки для последующего разрушения протеосомами.
Предполагается, что окисление атома серы сложных тиоэфиров (тиолактонов) является необходимым этапом активации ряда ингибиторов агрегации тромбоцитов, таких как тиклопидин, клопидогрел и прасугрел.[7][8]
Тионовые эфиры
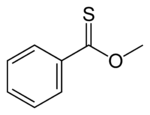
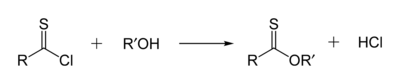
Тионовые эфиры (О-эфиры тиокарбоновых кислот) — изомеры сложных тиоэфиров. Атом серы в тионовых эфирах замещает карбонильный атом кислорода сложноэфирной группы, например: C6H5C(S)OCH3 (метилтионобензоат). Эти соединения обычно получают по реакции тиоацилхлоридов со спиртами, они также могут быть получены обработкой сложных эфиров реагентом Лоуссона.[9]
Примечания
- Fujiwara, S.; Kambe, N. Thio-, Seleno-, and Telluro-Carboxylic Acid Esters // Topics in Current Chemistry (неопр.). — Berlin / Heidelberg: Springer, 2005. — Т. 251. — С. 87—140. — ISBN 978-3-540-23012-0. — doi:10.1007/b101007.
- Synthesis of thioesters. Organic Chemistry Portal. Дата обращения: 21 августа 2012. Архивировано 29 октября 2012 года.
- Mori, Y.; Seki, M. (2007), Synthesis of Multifunctionalized Ketones Through the Fukuyama Coupling Reaction Catalyzed by Pearlman's Catalyst: Preparation of Ethyl 6-oxotridecanoate, Org. Synth. Т. 84: 285, <http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=V84P0285>; Coll. Vol. Т. 11: 281
- Volante, R. A new, highly efficient method for the conversion of alcohols to thiolesters and thiols (англ.) // Tetrahedron Letters : journal. — 1981. — Vol. 22, no. 33. — P. 3119—3122. — doi:10.1016/S0040-4039(01)81842-6.
- Bertleff, W.; Roeper, M.; Sava, X. Carbonylation // Ullmann's Encyclopedia of Industrial Chemistry (англ.). — Weinheim: Wiley-VCH, 2005. — doi:10.1002/14356007.a05_217.pub2.
- Lehninger, A. L.; Nelson, D. L.; Cox, M. M. Principles of Biochemistry (неопр.). — 3rd. — New York: Worth Publishing, 2000. — ISBN 1-57259-153-6.
- Mansuy, D.; Dansette, P. M. Sulfenic acids as reactive intermediates in xenobiotic metabolism (англ.) // Archives of Biochemistry and Biophysics : journal. — Elsevier, 2011. — Vol. 507, no. 1. — P. 174—185. — doi:10.1016/j.abb.2010.09.015.
- Dansette, P. M.; Rosi, J.; Debernardi, J.; Bertho, G.; Mansuy, D. Metabolic Activation of Prasugrel: Nature of the Two Competitive Pathways Resulting in the Opening of Its Thiophene Ring (англ.) // Chemical Research in Toxicology : journal. — 2012. — Vol. 25, no. 5. — P. 1058—1065. — doi:10.1021/tx3000279.
- Cremlyn, R. J. An Introduction to Organosulfur Chemistry (англ.). — Chichester: John Wiley and Sons, 1996. — ISBN 0-471-95512-4.