Нитроны
Нитроны (азометиноксиды) — N-оксиды иминов общей формулы R1R2C=N+(O−)R3 (R3 ≠ H)[1]. В зависимости от степени замещения при атоме углерода различают альдонитроны (R1 = Н, R2 — органический радикал) и кетонитроны (R1, R2 ≠ H). Изомерны с изонитронами (оксазиридинами).
Свойства
Нитроны — кристаллические вещества, в ИК-спектрах присутствует характеристическая полоса связи C=N при 1550—1620 см−1, в УФ-спектрах несопряженные нитроны поглощают в области λmax 240 нм. Слабые основания. Для нитронов, как и для оксимов, характерна цис-транс-изомерия по связи C=N.
Реакционная способность
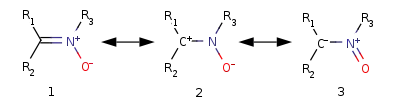
Строение нитронов может быть представлено как гибрид резонансных структур, основной вклад вносят 1,2-диполярная структура 1 и 1,3-диполярная структура 2:
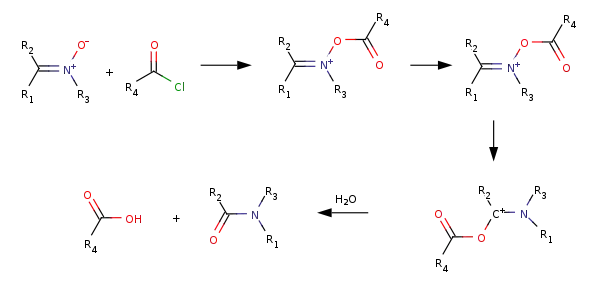
Кислородный атом нитронов является нуклеофильным центром, они протонируются по атому кислорода и образуют непрочные соли, алкилирование и ацилирование, продукты ацилирования обычно претерпевают перегруппировку в амиды:
Атом углерода нитронов электрофилен, они реагируют с нуклеофилами, образуя продукты 1,3-присоединения - N,N'-замещенные гидроксиламины:
- R1R2C=N+(O−)R3 + HX R1R2C(X)-N(OH)R3
- X = CN, OH
Такое нуклеофильное присоединение воды к нитронам является первой стадией их гидролиза, ведущего к кетонам и замещенным гидроксиламинам.
Синтез
Классическими методами синтеза нитронов являются конденсация карбонильных соединений с N-замещенными оксимами и N-алкилирование оксимов, нитроны также могут быть синтезированы окислением вторичных аминов пероксикарбоновыми кислотами[2] или пероксидом водорода[3] и дегидрированием N-замещенных гидроксиламинов соответствующих структур:
Специфическим методом синтеза N-арилзамещенных нитронов является конденсация ароматических нитрозосоединений с бензилгалогенидами или N-метиленпиридиниевыми солями:
- RCH2X + O=N-Ar RCH=N+(O-)Ar + HX ,
образование нитронов конденсацией 4-нитрозо-N,N-диметиланилина с метиленпиридиниевыми солями с последующим гидролизом является препаративным методом синтеза альдегидов (реакция Крёнке).
См. также
Примечания
- nitrones // IUPAC Gold Book
- “TRANSFORMATION OF PRIMARY AMINES TO N-MONOALKYLHYDROXYLAMINES: N-HYDROXY-(S)-1-PHENYLETHYLAMINE OXALATE”. Organic Syntheses. 80: 207. 2003. DOI:10.15227/orgsyn.080.0207. ISSN 2333-3553. Дата обращения 2020-09-23.
- “OXIDATION OF SECONDARY AMINES TO NITRONES: 6-METHYL-2,3,4,5-TETRAHYDROPYRIDINE N-OXIDE”. Organic Syntheses. 70: 265. 1992. DOI:10.15227/orgsyn.070.0265. ISSN 2333-3553. Дата обращения 2020-09-23.