Нитроловые кислоты
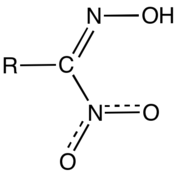
Нитроловые кислоты - соединения общей формулы RC(NO2)=NOH[1].
Синтез
Классическим методом синтеза нитроловых кислот является нитрозирование замещенных нитрометанов, впервые такой синтез был проведен Мейером в 1874 г. с нитроэтанов в качестве нитроалкана[2]:
Реакция обычно проводится подкислением реакционной смеси, содержащей соль аци-формы нитросоединения с нитритом натрия.
Нитроловые кислоты также могут быть синтезированы нитрованием ацилальдоксимов:
Ацилнитроловые кислоты могут быть синтезированы нитрованием ацилальдоксимов, которые получают нитрозированием метилкетонов:
Реакционная способность
Нитроловые кислоты таутомерны с псевдонитролами RCH(NO2)NO, равновесие существенно смещено в сторону нитроловой формы. За счет электронакцепторного заместителя у оксимного атома углерода нитроловые кислоты проявляют кислотные свойства (благодаря чему и получили свое название) и с щелочами образуют окрашеные в красный цвет соли.
Под действием окислителей (пероксид водорода, пероксокарбоновые кислоты, хромовый ангидрид в уксусной кислоте) нитроловые кислоты окисляются до гем-динитрометанов:
- RCH(NO2)NO + [O] RCH(NO2)2
Тетраоксид диазота по тотношению к нитроловым кислотам действует одновременно как нитрующий агент и окислитель, реакция с ним ведет к образованию тринитрометанов:
При обработке концентрированной серной кислотой нитроловые кислоты отщепляют оксид азота(I), образуя карбоновые кислоты[3]:
При нагревании в инертных растворителях нитроловые кислоты отщепляют азотистую кислоту с образованием нитрилоксидов[4]:
Эта реакция является одним из препаративных методов синтеза последних.
Поскольку нитрилоксиды, будучи высокореакционноспрсобными 1,3-диполярными соединениями, димеризуются в фуроксаны, то в препаративных синтезах 1,3-диполярного присоединения нитрилоксиды из нитроловых кислот обычно получают in situ, в смеси с 1,3-диполярофилами.
Примечания
- nitrolic acids // IUPAC Gold Book
- Meyer, V.; Locher, J. «Untersuchungen über die Constitution der Nitrolsäuren (Researches on the constitution of the nitrolic acids)» Deut. Chem. Ges. Ber., 1874, volume 7, pp. 670-5. doi:10.1002/cber.187400701211
- Ф. Азингер. Химия и технология парафиновых углеводородов. Москва: Гостоптехиздат, 1959 стр. 271
- Christophe Matt et al. Nitrolic acids: efficient precursors of nitrile oxides under neutral conditions. Tetrahedron Letters 41(8):1191-1194 February 2000 DOI: 10.1016/S0040-4039(99)02278-9