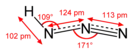Азотистоводородная кислота
Азо́тистоводоро́дная кислота́, азоими́д (азидоводород), HN3 — кислота, соединение азота с водородом. Бесцветная, летучая, чрезвычайно взрывоопасная (взрывается при нагреве, ударе или трении) ядовитая жидкость с резким запахом. Очень токсична. Её хорошо растворимые соли тоже очень ядовиты. Механизм токсичности аналогичен цианидам (блокирование цитохромов).
| Азотистоводородная кислота | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
Азидоводород, азотистоводородная кислота | ||
| Традиционные названия | Азоимид | ||
| Хим. формула | HN3 | ||
| Физические свойства | |||
| Состояние | жидкость | ||
| Молярная масса | 43,03 г/моль | ||
| Плотность | 1,09 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | −80 °C | ||
| • кипения | 37 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | от 4,6 до 4,7 | ||
| Классификация | |||
| Рег. номер CAS | 7782-79-8 | ||
| PubChem | 24530 | ||
| Рег. номер EINECS | 231-965-8 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 29449 | ||
| ChemSpider | 22937 | ||
| Безопасность | |||
| Токсичность | высокотоксична, сильнейший неорганический яд, взрывоопасна | ||
| Пиктограммы ECB |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Химические свойства
Разбавленные водные растворы не взрывоопасны, при стоянии раствор HN3 медленно разлагается до азота и гидроксиламина:
В водном растворе HN3 проявляет свойства слабой кислоты (рKа = 4,59). По силе она близка к уксусной кислоте. Водный раствор HN3 называют азидоводородной кислотой (азотистоводородной кислотой). В растворах азидоводородная кислота диссоциирует на ионы:
Кислота HN3 является окислителем. При взаимодействии с металлами образует соль металла, азот и аммиак:
Соли этой кислоты называются азидами. При ударе или нагревании они распадаются со взрывом, на чём основано применение азида свинца Pb(N3)2 в качестве инициирующего взрывчатого вещества. Относительно устойчивы ионные азиды щелочных металлов, за исключением LiN3.
Смесь HN3 и соляной кислоты HCl подобно «царской водке» является сильным окислителем из-за образующегося хлора и растворяет золото и платину:
Кислота и её соли разлагаются при действии сильных окислителей с выделением азота.
В органической химии применяется в реакции Шмидта.
Получение
Азидоводород HN3 получают действием ортофосфорной кислоты на азид натрия NaN3, который синтезируют из амида натрия:
Также азидоводород можно получить:
Токсичность
![]() Азотистоводородная кислота чрезвычайно ядовита. Вещество при попадании в организм блокирует биохимические процессы в клеточных цитохромах. По токсичности сравнима с синильной кислотой. Но очень острый, неприятный запах и быстро возникающая головная боль при вдыхании воздуха даже со следами паров азотистоводородной кислоты исключают случайное отравление. Не проявляет кумулятивного отравляющего действия.
Азотистоводородная кислота чрезвычайно ядовита. Вещество при попадании в организм блокирует биохимические процессы в клеточных цитохромах. По токсичности сравнима с синильной кислотой. Но очень острый, неприятный запах и быстро возникающая головная боль при вдыхании воздуха даже со следами паров азотистоводородной кислоты исключают случайное отравление. Не проявляет кумулятивного отравляющего действия.
LD50 для мышей в воздухе 34 мг/м3, LD50 для мышей перорально — 33 мг/кг массы тела.
См. также
Литература
- Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. — М.: Химия, 1994.
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.