UBTF
UBTF (англ. upstream binding transcription factor, RNA polymerase I, другие названия UBF; UBF1; UBF2; UBF-1; NOR-90) — ядрышковый транскрипционный фактор, регулирующий транскрипцию генов рРНК РНК-полимеразой I и ряд других процессов. У человека кодируется геном UBTF, расположенным на 17-й хромосоме[1]. UBTF представлен единственной полипептидной цепью, причём за связывание с ДНК отвечает особый домен HGM-бокс. Белок локализуется в ядрышке, точнее, в фибриллярных центрах и плотном фибриллярном компоненте. Нарушения работы UBTF приводят к различным заболеваниям, в том числе раковым.
Классификация
По данным базы TRANSFAC, белок UBTF относится к группе «4.7. Класс HMG», «4.7.4 семейство UBF»[2]. Другие авторы выделяют надсемейство HMGB-белков, в котором белок UBTF принадлежит семейству HMG/UBF[3][4].
Ген и изоформы
Ген UBTF у человека находится на 17-й хромосоме в локусе 17q21.31 и содержит 25 экзонов. У млекопитающих известны 2 изоформы белка UBTF, которые образуются из-за альтернативного сплайсинга первичных транскриптов гена UBTF: UBTF1 и UBTF2[5]. Псевдогены этого гена располагаются на коротких плечах хромосом 3, 11 и Х, а также длинном плече хромосомы 11[1][6].
Структура
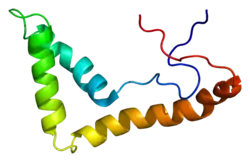
Белок UBTF представлен единственной цепью из 764 аминокислотных остатков. Во вторичной структуре имеются альфа-спирали, бета-слои и бета-поворот. Связывание с ДНК обеспечивается шестью мотивами HGM-бокс. Белок также характеризуется наличием N-концевого домена димеризации и С-концевого кислого хвоста. У изоформы UBTF2 отсутствуют 37 аминокислот из второго HGM-бокса[5].
В растворе UBTF формирует димеры, димеризация осуществляется за счёт N-концевого домена длиной более 80 аминокислотных остатков. Этот домен чрезвычайно консервативен, поэтому, возможно, участвует также в регуляции транскрипции и/или связывании UBTF с функциональными ядрышковыми организаторами. Среди HGM-боксов UBTF для связывания с ДНК совершенно необходим только первый, а другие HGM-боксы усиливают это взаимодействие. HGM-боксы UBTF имеют характерную изогнутую L-образную форму и состоят из трёх альфа-спиралей, которые могут вносить конформационные изменения в ДНК. В условиях in vitro димер UBTF лягушки Xenopus может изгибать в петлю свободную от нуклеосом рДНК длиной до 180 пар оснований. Кроме того, UBTF может одновременно связываться с двумя молекулами ДНК[5].
C-концевой домен UBTF состоит из 57 остатков кислых аминокислот (глутаминовой и аспарагиновой кислоты), а также 23 остатков серина. Кислый домен играет ключевую роль в участии UBTF в активации транскрипции. Именно этот отрицательно заряженный домен обусловливает окрашивание активных ядрышковых организаторов солями серебра[5].
UBTF может подвергаться таким посттрансляционным модификациям, как ацетилирование и фосфорилирование (по остатку треонина Thr201 и 12 остаткам серина)[6]. О функциональном значении посттрансляционных модификаций см. раздел Регуляция.
Внутриклеточная локализация
UBTF — чрезвычайно многочисленный транскрипционный фактор; так, в первичных человеческих фибробластах обнаруживается до 106 молекул на клетку[7]. UBTF — ядрышковый белок, обнаруживается в двух ядрышковых компонентах — плотном фибриллярном компоненте и фибриллярных центрах. Кроме того, он может обнаруживаться в нуклеоплазме[6]. UBTF характеризуется очень высоким сродством к рДНК и в условиях in vivo может связываться с ней в отсутствие промоторов и транскрипции[8]. На клетках HeLa было показано, что ядрышковая локализация UBTF связана с интенсивностью транскрипции генов рРНК (рДНК). В ядрышках, имеющих единственный крупный фибриллярный центр (такие ядрышки характеризуются низким уровнем транскрипции рДНК), UBTF располагается преимущественно там. Однако в ядрышках, характеризующихся интенсивной транскрипцией рДНК и имеющих множество мелких фибриллярных центров, UBTF локализуется в основном на границе фибриллярных центров и плотного фибриллярного компонента[9].
Функции
Долгое время считалось, что единственная функция UBTF — участие в образовании преинициаторного комплекса на промоторах рДНК. Согласно одной из моделей, UBTF связывает вышестоящие и коровые промоторные элементы, в результате чего образуется петля ДНК, на которой собирается похожий на нуклеосому белковый комплекс. Благодаря этому UBTF может взаимодействовать с транскрипционным фактором TIF-1B (SL1). Образующийся комплекс привлекает РНК-полимеразу I. Впрочем, сейчас настоящий механизм образования преинициаторного комплекса и роль UBTF в инициации транскрипции рДНК менее ясны: показано, что в условиях in vitro UBTF не является совершенно необходимым для инициации транскрипции[10].
В ходе экспериментов по интеграции длинного ряда сайтов связывания UBTF из рДНК лягушки Xenopus laevis в геном клеток человека было показано, что UBTF необходим для формирования ядрышка. В этих рядах наблюдалось образование похожих на ядрышки структур, следовательно, UBTF выступал как площадка для сборки ядрышек даже в отсутствие транскрипции, опосредованной РНК-полимеразой I[11]. UBTF совместно с машинерией РНК-полимеразы I, нуклеолином, нуклеофозмином и фибрилларином относится к числу первых факторов, с которых начинается сборка ядрышка и привлечение прочих белковых компонентов ядрышек[12]. UBTF задействован в регуляции биогенеза рибосом[13].
Имеется ряд свидетельств участия UBTF в перестройках хроматина (ремоделирование хроматина). Показано, что UBTF необходим для поддержания структуры эухроматина в области активных ядрышковых организаторов (англ. nucleolar organizer region, NOR). Возможно, что это связано с конкурентным вытеснением UBTF линкерного гистона H1, который участвует в гетерохроматинизации. UBTF совершенно необходим для формирования активных ядрышковых организаторов, в условиях нокаута у мышей соответствующего гена образование NOR нарушено[14]. Таким образом, UBTF препятствует образованию гетерохроматина в области рДНК и способствует поддержанию активной конформации хроматина[10].
Показано, что у мышей метилирование динуклеотида CpG в позиции −133 относительно коровой части промотора рДНК ядрышковым комплексом ремоделирования NoRC обеспечивает транскрипционный сайленсинг генов рРНК и уменьшает связывание UBTF с промоторами рДНК. В конечных стадиях дифференцировки промиелоцитов мыши сайленсинг рДНК увеличивается, при этом связывание UBTF с повторами рДНК также уменьшается. Поскольку экспрессия UBTF постепенно сокращается на конечных стадиях дифференцировки многих клеточных линий, возможно, что регуляция UBTF служит ключевым механизмом сайленсинга рДНК в ходе развития[10]. Действительно, при помощи делеции гена UBTF было показано, что белок UBTF необходим для развития зародыша до стадии морулы. Интересно, что утрата UBTF индуцировала образование в ооцитах и ранних эмбрионах крупных внутриядерных структур, похожих на тельца-предшественники ядрышек (NPB)[15]. Показано, что в отсутствие UBTF у мышей происходит разборка ядрышек в соматических клетках и накопление ключевых факторов транскрипции генов рРНК в плотных внутриядерных тельцах, похожих на NPB. В эмбрионах же сами NPB и окружающий их гетерохроматин разрушены[16].
В 2015 году было показано, что UBTF участвует в поддержании стабильности генома, регулируя гены, активно транскрибируемые РНК-полимеразой II[17].
Регуляция
Активность UBTF может регулироваться посредством посттрансляционных модификаций. Например, фосфорилирование UBTF усиливает транскрипцию генов рДНК[18]. Так, белок mTOR (ключевой регулятор клеточного роста) регулирует транскрипцию генов рРНК через белок S6K1 и фосфорилирование С-концевого домена UBTF[19]. Фосфоинозитид-3-киназа фосфорилирует UBTF в ходе сигнального пути инсулиноподобного фактора роста. UBTF также может быть фосфорилирован киназами ERK1/2. Так, активация пути MAPK/ERK эпидермальным фактором роста (EGF) вызывает опосредованное ERK1/2 фосфорилирование UBTF по первым двум HGM-боксам, что приводит к положительной регуляции транскрипции рДНК за счёт усиления элонгации транскрипции РНК-полимеразой I. Фосфорилирование HGM-боксов 1 и 2 посредством ERK повышает их сродство к линейной ДНК, что облегчает элонгацию транскрипцию, проводимую РНК-полимеразой I[13]. UBTF может активироваться в результате фосфорилирования комплексами циклинов и циклинзависимых киназ, специфичных для фазы G1 клеточного цикла[20]. Человеческий опухолевый супрессор p14ARF подавляет фосфорилирование UBTF и, следовательно, транскрипцию рДНК[21].
Показано, что состояние ацетилированности UBTF изменяется в ходе клеточного цикла и ацетилирование UBTF влияет на его взаимодействие с РНК-полимеразой I[22]. Белковый комплекс RUNX2 и гистондеацетилазы 1 (HDAC1) регулирует экспрессию рРНК, деацетилируя UBTF[23]. Белок hALP может активировать транскрипцию, опосредуемую РНК-полимеразой I, связываясь с UBTF и ацетилируя его[24].
Взаимодействие UBTF с ДНК может непосредственно регулироваться связыванием с фосфатидилинозитол-4,5-бисфосфатом[25].
Взаимодействие с другими белками
В таблице ниже перечислены ключевые белки, с которыми взаимодействует UBTF[26]:
| Белок | Функция | Экспериментальное подтверждение |
|---|---|---|
| PAF53 | Субъединица РНК-полимеразы I | Взаимодействие in vitro и коиммунопреципитация |
| PAF49 | Субъединица РНК-полимеразы I | Взаимодействие in vitro |
| TAFI48 | Субъединица SL1 | Взаимодействие in vitro |
| TBP | Субъединица SL1 | Взаимодействие in vitro |
| Treacle | Взаимодействует с боксом C/D малых ядрышковых РНК | Дрожжевая двугибридная система и коиммунопреципитация |
| SIRT7 | Потенциальная АДФ-рибозилтрансфераза и деацетилаза | Взаимодействие in vitro |
| CTCF | Организация хроматина | Взаимодействие in vitro и ковыделение |
Консервативность
Долгое время считалось, что UBTF имеется только у позвоночных. Это представление подкреплялось отсутствием похожих на UBTF белков у таких модельных организмов, как муха Drosophila, круглый червь Caenorhabditis elegans, дрожжи Saccharomyces cerevisiae и цветковое растение Arabidopsis. Однако с увеличением данных о последовательностях ДНК разнообразных организмов UBTF был найден у животных, не относящихся к позвоночным. Например, UBTF был найден у хордового животного — асцидии Ciona intestinalis. Аминокислотные последовательности N-концевого домена димеризации и первого HGM-бокса у Ciona и человека совпадают на 40 и 54 % соответственно. Более того, у Ciona, как и у человека, UBTF содержит несколько (по крайней мере пять) HGM-боксов[27].
Оказалось, далее, что UBTF имеется у разнообразных членистоногих (например, у клеща Ixodes scapularis, жука Tribolium castaneum, тли Acyrthosiphon pisum). Даже в геноме примитивного животного Trichoplax adhaerens найдена открытая рамка считывания, очень похожая на UBTF. Сравнение UBTF Trichoplax и Ciona выявило 27 % сходства в последовательностях доменов димеризации. Гомолог UBTF Trichoplax также имеет несколько HGM-боксов, причём бокс, соседний с доменом димеризации, имеет 30 % сходства с аналогичным доменом Ciona, однако UBTF Trichoplax не имеет кислого N-концевого домена. По-видимому, у модельных беспозвоночных животных имело место сильная утрата генов, в том числе кодирующих UBTF. У грибов и растений, похоже, UBTF нет. У дрожжей Saccharomyces cerevisiae обнаружен HGM-содержащий белок HMO1, который может играть роли, аналогичные функциям UBTF Metazoa[28].
Клиническое значение
Вирус простого герпеса первого типа вызывает перемещение UBTF из ядрышка клетки-хозяина в компартменты репликации вируса. Однако было показано, что UBTF не способствует репликации вируса, а, напротив, подавляет её[29].
Продемонстрировано, что онкопротеин E7 человеческого папилломавируса стимулирует транскрипцию генов рДНК, увеличивая количество фосфорилированной формы UBTF[30].
Повышенный уровень экспрессии UBTF, соответствующий положительной регуляции транскрипции рДНК, связан с гипертрофией сердца[31]. Напротив, при дифференцировке уровень транскрипции рДНК снижен, что соответствует значительному уменьшению экспрессии UBTF[32].
Установлено, что нарушения ацетилирования UBTF по остатку лизина 352 связаны с нарушениями транскрипции рДНК при болезни Хантингтона[33].
Показано, что у пациентов с гепатоцеллюлярной карциномой наблюдаются повышение уровня экспрессии UBTF, приводящее к онкогенному эффекту. Оказалось, что белок HBx вируса гепатита B активирует злокачественное перерождение клеток через c-Myc-зависимое усиление экспрессии UBTF[34].
Показана связь между утратой волос у человека и уровнем экспрессии UBTF[35].
Примечания
- UBTF upstream binding transcription factor, RNA polymerase I [ Homo sapiens (human) ].
- Классификация по данным TRANSFAC.
- Soullier S., Jay P., Poulat F., Vanacker J. M., Berta P., Laudet V. Diversification pattern of the HMG and SOX family members during evolution. (англ.) // Journal of molecular evolution. — 1999. — Vol. 48, no. 5. — P. 517—527. — PMID 10198118.
- Ait Benkhali J., Coppin E., Brun S., Peraza-Reyes L., Martin T., Dixelius C., Lazar N., van Tilbeurgh H., Debuchy R. A network of HMG-box transcription factors regulates sexual cycle in the fungus Podospora anserina. (англ.) // PLoS genetics. — 2013. — Vol. 9, no. 7. — P. e1003642. — doi:10.1371/journal.pgen.1003642. — PMID 23935511.
- The Nucleolus, 2011, p. 88.
- UniProtKB - P17480 (UBF1_HUMAN).
- The Nucleolus, 2011, p. 89.
- The Nucleolus, 2011, p. 90.
- He J., Wu X., Tao W. Nucleolar localization of upstream binding factor in HeLa cells depends on rRNA synthesis activities. (англ.) // Folia biologica. — 2008. — Vol. 54, no. 6. — P. 202—206. — PMID 19393134.
- Sanij E., Hannan R. D. The role of UBF in regulating the structure and dynamics of transcriptionally active rDNA chromatin. (англ.) // Epigenetics. — 2009. — Vol. 4, no. 6. — P. 374—382. — PMID 19717978.
- Proteins of the Nucleolus, 2013, p. 125.
- Proteins of the Nucleolus, 2013, p. 213.
- The Nucleolus, 2011, p. 94.
- The Nucleolus, 2011, p. 83.
- Hamdane N., Stefanovsky V. Y., Tremblay M. G., Németh A., Paquet E., Lessard F., Sanij E., Hannan R., Moss T. Conditional inactivation of Upstream Binding Factor reveals its epigenetic functions and the existence of a somatic nucleolar precursor body. (англ.) // PLoS genetics. — 2014. — Vol. 10, no. 8. — P. e1004505. — doi:10.1371/journal.pgen.1004505. — PMID 25121932.
- Hamdane N., Tremblay M. G., Dillinger S., Stefanovsky V. Y., Németh A., Moss T. Disruption of the UBF gene induces aberrant somatic nucleolar bodies and disrupts embryo nucleolar precursor bodies // Gene. — 2016. — doi:10.1016/j.gene.2016.09.013. — PMID 27614293.
- Sanij E., Diesch J., Lesmana A., Poortinga G., Hein N., Lidgerwood G., Cameron D. P., Ellul J., Goodall G. J., Wong L. H., Dhillon A. S., Hamdane N., Rothblum L. I., Pearson R. B., Haviv I., Moss T., Hannan R. D. A novel role for the Pol I transcription factor UBTF in maintaining genome stability through the regulation of highly transcribed Pol II genes. (англ.) // Genome research. — 2015. — Vol. 25, no. 2. — P. 201—212. — doi:10.1101/gr.176115.114. — PMID 25452314.
- Lin C. H., Platt M. D., Ficarro S. B., Hoofnagle M. H., Shabanowitz J., Comai L., Hunt D. F., Owens G. K. Mass spectrometric identification of phosphorylation sites of rRNA transcription factor upstream binding factor. (англ.) // American journal of physiology. Cell physiology. — 2007. — Vol. 292, no. 5. — P. 1617—1624. — doi:10.1152/ajpcell.00176.2006. — PMID 17182730.
- Hannan K. M., Brandenburger Y., Jenkins A., Sharkey K., Cavanaugh A., Rothblum L., Moss T., Poortinga G., McArthur G. A., Pearson R. B., Hannan R. D. mTOR-dependent regulation of ribosomal gene transcription requires S6K1 and is mediated by phosphorylation of the carboxy-terminal activation domain of the nucleolar transcription factor UBF. (англ.) // Molecular and cellular biology. — 2003. — Vol. 23, no. 23. — P. 8862—8877. — PMID 14612424.
- Voit R., Hoffmann M., Grummt I. Phosphorylation by G1-specific cdk-cyclin complexes activates the nucleolar transcription factor UBF. (англ.) // The EMBO journal. — 1999. — Vol. 18, no. 7. — P. 1891—1899. — doi:10.1093/emboj/18.7.1891. — PMID 10202152.
- Ayrault O., Andrique L., Fauvin D., Eymin B., Gazzeri S., Séité P. Human tumor suppressor p14ARF negatively regulates rRNA transcription and inhibits UBF1 transcription factor phosphorylation. (англ.) // Oncogene. — 2006. — Vol. 25, no. 58. — P. 7577—7586. — doi:10.1038/sj.onc.1209743. — PMID 16924243.
- Meraner J., Lechner M., Loidl A., Goralik-Schramel M., Voit R., Grummt I., Loidl P. Acetylation of UBF changes during the cell cycle and regulates the interaction of UBF with RNA polymerase I. (англ.) // Nucleic acids research. — 2006. — Vol. 34, no. 6. — P. 1798—1806. — doi:10.1093/nar/gkl101. — PMID 16582105.
- Ali S. A., Dobson J. R., Lian J. B., Stein J. L., van Wijnen A. J., Zaidi S. K., Stein G. S. A RUNX2-HDAC1 co-repressor complex regulates rRNA gene expression by modulating UBF acetylation. (англ.) // Journal of cell science. — 2012. — Vol. 125, no. Pt 11. — P. 2732—2739. — doi:10.1242/jcs.100909. — PMID 22393235.
- Kong R., Zhang L., Hu L., Peng Q., Han W., Du X., Ke Y. hALP, a novel transcriptional U three protein (t-UTP), activates RNA polymerase I transcription by binding and acetylating the upstream binding factor (UBF). (англ.) // The Journal of biological chemistry. — 2011. — Vol. 286, no. 9. — P. 7139—7148. — doi:10.1074/jbc.M110.173393. — PMID 21177859.
- Yildirim S., Castano E., Sobol M., Philimonenko V. V., Dzijak R., Venit T., Hozák P. Involvement of phosphatidylinositol 4,5-bisphosphate in RNA polymerase I transcription. (англ.) // Journal of cell science. — 2013. — Vol. 126, no. Pt 12. — P. 2730—2739. — doi:10.1242/jcs.123661. — PMID 23591814.
- The Nucleolus, 2011, p. 92.
- The Nucleolus, 2011, p. 95—96.
- The Nucleolus, 2011, p. 96—97.
- Ouellet Lavall G., Pearson A. Upstream binding factor inhibits herpes simplex virus replication. (англ.) // Virology. — 2015. — Vol. 483. — P. 108—116. — doi:10.1016/j.virol.2015.04.003. — PMID 25965800.
- Dichamp I., Séité P., Agius G., Barbarin A., Beby-Defaux A. Human papillomavirus 16 oncoprotein E7 stimulates UBF1-mediated rDNA gene transcription, inhibiting a p53-independent activity of p14ARF. (англ.) // Public Library of Science ONE. — 2014. — Vol. 9, no. 5. — P. e96136. — doi:10.1371/journal.pone.0096136. — PMID 24798431.
- Brandenburger Y., Arthur J. F., Woodcock E. A., Du X. J., Gao X. M., Autelitano D. J., Rothblum L. I., Hannan R. D. Cardiac hypertrophy in vivo is associated with increased expression of the ribosomal gene transcription factor UBF. (англ.) // FEBS letters. — 2003. — Vol. 548, no. 1-3. — P. 79—84. — PMID 12885411.
- The Nucleolus, 2011, p. 95.
- Lee J., Hwang Y. J., Boo J. H., Han D., Kwon O. K., Todorova K., Kowall N. W., Kim Y., Ryu H. Dysregulation of upstream binding factor-1 acetylation at K352 is linked to impaired ribosomal DNA transcription in Huntington's disease. (англ.) // Cell death and differentiation. — 2011. — Vol. 18, no. 11. — P. 1726—1735. — doi:10.1038/cdd.2011.38. — PMID 21546905.
- Rajput P., Shukla S. K., Kumar V. The HBx oncoprotein of hepatitis B virus potentiates cell transformation by inducing c-Myc-dependent expression of the RNA polymerase I transcription factor UBF. (англ.) // Virology journal. — 2015. — Vol. 12. — P. 62. — doi:10.1186/s12985-015-0293-5. — PMID 25890091.
- Tasdemir S., Eroz R., Dogan H., Erdem H. B., Sahin I., Kara M., Engin R. I., Turkez H. Association Between Human Hair Loss and the Expression Levels of Nucleolin, Nucleophosmin, and UBTF Genes. (англ.) // Genetic testing and molecular biomarkers. — 2016. — Vol. 20, no. 4. — P. 197—202. — doi:10.1089/gtmb.2015.0246. — PMID 26866305.
Литература
- The Nucleolus / Ed. by Mark O. J. Olson. — New York: Springer Science+Business Media, 2011. — xxvi + 414 p. — (Protein Reviews, vol. 15). — ISBN 978-1-4614-0514-6. — doi:10.1007/978-1-4614-0514-6.
- Proteins of the Nucleolus / O'Day, Danton H, Catalano, Andrew. — Netherlands: Springer, 2013. — ISBN 978-94-007-5818-6. — doi:10.1007/978-94-007-5818-6.