Фибрилларин
Фибриллари́н (англ. Fibrillarin, Fbl, другие названия см. ниже) — ядрышковый белок, у человека кодируется геном FBL, локализованным на 19-й хромосоме[1]. Основной функцией фибрилларина является участие в транскрипции и процессинге рРНК, поэтому он часто используется как маркер активных ядрышек. Фибрилларин является метилтрансферазой, то есть переносит метильную группу с S-аденозилметионина на 2'-гидроксильную группу рибозы в молекуле РНК-мишени. Кроме того, фибрилларин опосредует метилирование остатка глутамина Gln105 в гистоне Н2А. Белки, по структуре и функциям соответствующие фибрилларину, были найдены и у архей, которые являются прокариотами и не имеют ядрышек. Повышенный уровень фибрилларина обнаруживается в случае многих раковых заболеваний. Кроме того, фибрилларин может взаимодействовать со многими вирусными белками[2].
Названия
Название «фибрилларин» используется для обозначения нескольких белков у разных организмов, в том числе архей, хотя их фибрилларин сильно отличается от фибрилларина эукариот. В литературе фигурирует множество синонимов названия «фибрилларин», в том числе ядрышковый антиген склеродермы массой 34 кДа (англ. 34 kDa nucleolar scleroderma antigen), Dmel_CG9888, CG9888, Dmel\CG9888ri, GCR-6, GCR6, Pen59C5, fib, pen59C5, Fib, FIB, FBL, Fbl, FIB1, FLRN, RNU3IP1, фибрилларин рРНК 2'-O-метилтрансфераза (англ. rRNA 2'-O-methyltransferase fibrillarin), NOP1, nop1, fibM, afib. Для обозначения фибрилларина дрожжей часто используется название NOP1, а для фибрилларинов архей — aFIBs[2].
Распространение
Впервые фибрилларин был описан в ядрышке слизевика Physarum polycephalum в 1977 году. Фибрилларин обнаружен не только у эукариот, но и у архей, и, поскольку археи не имеют ядрышка, предполагается, что функции фибрилларина архей несколько отличны от функций фибрилларина эукариот. В клетках дрожжей Saccharomyces cerevisiae содержащийся там фибрилларин NOP1 можно без ущерба для этих клеток заменить на фибрилларин растения Arabidopsis thaliana, лягушки Xenopus laevis или человека, но не на фибрилларин инфузории Tetrahymena thermophila (возможно, это обусловлено отличающейся структурой N-концевого домена последнего). Приведённые данные свидетельствуют в пользу высокой консервативности структуры и функций фибрилларина. Однако домен GAR, обогащённый аргинином и глицином, имеет низкую консервативность аминокислотного состава, а при замене NOP1 фибрилларином человека, X. laevis или A. thaliana всё-таки изменяются параметры ядрышка и рост дрожжевых клеток, поэтому некоторые функции фибрилларина у разных организмов, по-видимому, несколько различаются[2].
Консервативность аминокислотных последовательностей фибрилларина различна в разных группах организмов. Наибольшую консервативность демонстрируют фибрилларины растений (63 % сходства между наиболее удалёнными представителями группы) и позвоночных (61 %), в то время как наименее консервативны фибрилларины беспозвоночных, грибов и архей (33, 27 и 20 % соответственно)[2].
На основании филогенетических данных можно выделить несколько семейств фибрилларинов, однако пока для такого разделения недостаточно биохимических и генетических данных[2].
У человека ген FBL, кодирующий фибрилларин, находится на 19-й хромосоме в локусе 19q13.1 и содержит 9 экзонов[1]. Ген располагается на минус-цепи и имеет длину 11962 пар оснований[3].
Структура
Фибрилларин принадлежит к семейству SAM-метилтрансфераз, содержащих укладку Россмана. В зависимости от организма молекулярная масса фибрилларина может составлять от 34 до 38 кДа. У человека фибрилларин состоит из 321 аминокислотного остатка и имеет массу 33784 Да[3]. Фибрилларин можно подразделить на N-концевой домен и домен, обладающий метилтрансферазной активностью. У Arabidopsis thaliana N-концевой домен подразделяется на два участка: домен, обогащённый глицином и аргинином (GAR) и состоящий из 77 аминокислотных остатков, и спейсерный участок, включающий 61 аминокислотный остаток. Домен GAR участвует во взаимодействии с различными клеточными и вирусными белками, а также содержит сигнал, удерживающий белок в ядрышке совместно с РНК-связывающим мотивом. GAR не является необходимым доменом для локализации фибрилларина в тельцах Кахаля, однако у человека и Arabidopsis thaliana он совершенно необходим для локализации белка в ядре. Домен GAR может метилироваться по нескольким остаткам аргинина. Фибрилларин может метилироваться по остаткам аргинина белком PRMT1, причём метилированные остатки составляют 45 % всех остатков аргинина фибрилларина. Метилирование может способствовать специфичному связыванию фибрилларина с некоторыми белками, например, SMN1. У человека домен GAR и спейсерный участок взаимодействуют с белком SF2A-p32, а метилтрансферазный домен взаимодействует с PRMT5[2].
Метилтрансферазный домен подразделяется на два участка: R-, или центральный участок, включающий 87 аминокислотных остатков, и участок длиной 95 аминокислотных остатков, обогащённый α-спиралями. Для связывания фибрилларина с РНК необходимо несколько участков. Во-первых, это мотив GCVYAVCF, расположенный внутри R-участка, во-вторых, последовательность в R-участке между аминокислотными остатками 138 и 179 и, в-третьих, последовательность между аминокислотными остатками 225 и 281, локализованная в обогащённом α-спиралями участке. Два последних сайта связывания РНК взаимодействуют с различными РНК независимо друг от друга и делеция одного из них не оказывает негативного влияния на способность фибрилларина связывать РНК, однако при совместной работе этих двух сайтов проявляется синергический эффект. В С-концевом участке белка имеется консервативная структура, состоящая из 7 α-спиралей и 7 β-листов. Кроме того, в С-концевом участке находится сайт связывания S-аденозилметионина, окружённый тремя консервативными аминокислотными остатками. Этот же регион взаимодействует с белком Nop56[2].
Удивительно, но структура фибрилларина высококонсервативна в ряду организмов от архей до человека. Однако фибрилларины архей лишены домена GAR, а потому короче фибрилларинов эукариот[2].
Как отмечалось выше, из посттрансляционных модификаций фибрилларин может подвергаться метилироваться по остаткам аргинина. Кроме того, он может фосфорилироваться по остатку серина Ser124[4].
Внутриклеточная локализация
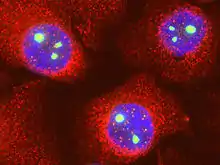
Как и многие другие ядерные белки, фибрилларин — очень динамичный белок, вероятно, из-за того, что процесс образования рибосомных частиц, в котором он принимает участие, требует высокой подвижности. Фибрилларин может быстро перемещаться между ядрышками и нуклеоплазмой, а также появляться в тельцах Кахаля. Возможно, фибрилларин активно перемещается по ядру в поисках субстрата для метилирования[2].
В интерфазе клеточного цикла фибрилларин локализован в плотном фибриллярном компоненте ядрышка, и при переходе от G1- к G2-фазе его концентрация может удваиваться. В начале профазы ядрышки начинают разбираться, и фибрилларин совместно с другими элементами процессинга рРНК (пре-рРНК, нуклеолин, малые ядрышковые РНК U3 и U4) перемещается на периферию хромосом, где составляет часть перихромосомной оболочки или перихромосомного компартмента. Кроме того, фибрилларин был отмечен в цитоплазме клеток, проходящих митоз, поэтому, возможно, во время митоза комплексы процессинга рРНК разбираются и разрушаются в цитоплазме. В телофазе фибрилларин уже собирается в комплексы процессинга рРНК в пренуклеолярных тельцах (PNB). После этого PNB связываются с ядрышковыми организаторами (NORs), причём фибрилларин является одним из первых факторов процессинга рРНК, которые переходят из PNBs в NORs. Было высказано предположение, что киназы и фосфатазы, регулирующие переход из митоза в интерфазу, могут также регулировать переход фибрилларина в NORs до начала транскрипции генов рРНК (рДНК)[2].
Функции
Фибрилларин непосредственно участвует в пост-транскрипционном процессинге рРНК — в частности, разрезании пре-рРНК, метилировании рРНК и сборке рибосом. Метилирование рРНК происходит более чем в 100 сайтах с небольшими отклонениями в зависимости от организма. У архей метилирующий комплекс состоит из белков aFIB, Nop5 и L7Ae. У эукариот белки Nop56 и Nop58 заменяют Nop5, а белок 15.5K замещает L7Ae. N-концевой домен Nop5 взаимодействует с aFIB, а C-концевой домен Nop5 связывается с L7Ae, и при связывании с направляющей РНК комплекс становится активным. У эукариот в роли направляющих РНК выступают малые ядрышковые РНК. В метилировании рРНК участвуют малые ядрышковые РНК, содержащие C/D-бокс. С-бокс, представляющий собой последовательность RUGAUGA (R — пурин), находится рядом с 5'-концом РНК, а D-бокс (CUGA) находится вблизи 3'-конца. Направляющая малая ядрышковая РНК содержит последовательность из 10—21 нуклеотидов, комплементарных РНК-мишени, и метилирование происходит на 5 нуклеотидов выше D-бокса. С фибрилларином взаимодействуют следующие малые РНК: U3, U8, U13, U14, U60, x, y, snR3, snR4, snR8, snR9, snR10, snR11, snR30, snR189 и snR190. Из всех многочисленных метилирований, происходящих при процессинге рРНК, по-видимому, ни одно не отвечает за какую-либо специализированную функцию. Комплекс эукариотического фибрилларина с Nop56, Nop58, 15.5K и малыми ядрышковыми РНК имеет массу около 400 кДа. Фибрилларин может входить в его состав в виде тетрамера, который меняет свою конформацию для того, чтобы метилировать различные участки рРНК. Nop56/58 играет важную роль в расположении каталитической субъединицы на РНК-мишени, одновременно взаимодействуя и с фибрилларином. Малые ядрышковые РНК выступают в роли направляющих и определяют непосредственный сайт редактирования[2].
Было показано, что фибрилларин может участвовать в метилировании гистона H2A по остатку глутамина Gln105 у дрожжей и Gln104 у человека. Такая модификация происходит только в ядрышке, где наблюдается высокая концентрация фибрилларина. Это — первая эпигенетическая модификация гистонов, характерная только для ядрышка. Данная модификация препятствует связыванию комплекса ремоделирования хроматина FACT и характерна для локуса 35S рДНК, а потому оказывает эпигенетический эффект на промоторы РНК-полимеразы I[2].
Роль метилирования, опосредуемого фибрилларином, исследовалась на многоклеточных организмах (на мышах) при помощи нокдауна соответствующего гена. Фибрилларин дикого типа заменялся формой, лишённой метилтрансферазного и N-концевого доменов и, таким образом, состоящей из одного только домена GAR. Гомозиготные по этой форме эмбрионы не развивались из-за многочисленных апоптозов, однако гетерозиготы не имели каких-либо отклонений от нормы. Кроме того, было показано, что фибрилларин необходим для нормального развития данио-рерио, а у растений сокращение экспрессии фибрилларина при помощи РНК-интерференции приводило к развитию карликового фенотипа[2].
Взаимодействия с другими белками
Взаимодействия с клеточными белками
Помимо вышеупомянутых белков Nop56, Nop58 и 15.5K, которые совместно с фибрилларином принимают участие в процессинге рРНК, фибрилларин взаимодействует со многими другими клеточными белками. Так, белки p32 и Nop52 взаимодействуют с фибрилларином не одновременно, но, предположительно, в одних и тех же сайтах. p32 участвует в регуляции сплайсинга, а Nop52 задействован в поздних стадиях образования рибосомных субъединиц 60S. Поскольку оба белка не могут взаимодействовать с фибрилларином одновременно, вероятно, взаимодействие каждого из них с фибрилларином необходимо на определённом этапе биогенеза рибосом. Фибрилларин может взаимодействовать с РНК-хеликазой DDX5[5]. В тельцах Кахаля фибрилларин может взаимодействовать с белком выживания мотонейронов (англ. Survival of Motor Neuron protein (SMN)). У растений фибрилларин 2 является частью медиаторного комплекса транскрипции, опосредованной РНК-полимеразой II, и может взаимодействовать с основными транскрипционными факторами РНК-полимеразы II, такими как TFIIB[2].
Взаимодействия с вирусными белками
Некоторые вирусы, в жизненных циклах которых имеется ядерная фаза (умбравирусы, вирус гриппа А, ВИЧ и другие) взаимодействуют с белками, локализованными в тельцах Кахаля и ядрышках, при реализации своих репликации и транскрипции. К числу таких белков относится и фибрилларин, перемещающийся между ядрышками и тельцами Кахаля. Например, фибрилларин взаимодействует с белком ORF3, кодируемым вирусом из группы умбравирусов, поражающих растения. Фибрилларин непосредственно взаимодействует своим обогащённым аргинином доменом с обогащённым лизином доменом ORF3, благодаря чему вирусный белок может перемещаться между ядрышком и тельцем Кахаля. Кроме того, при вирусной инфекции фибрилларин переносится в цитоплазму, где участвует в образовании вирусных частиц[2].
С фибрилларином взаимодействуют и некоторые вирусы животных. Например, многофункциональный белок NS1 вируса гриппа А подтипа H3N2 подавляет процессинг мРНК клетки-хозяина и препятствует развитию антивирусного ответа. NS1 связывается с фибрилларином и нуклеолином через свой С-концевой сигнал ядерной/ядрышковой локализации. Предполагается, что белок Tat ВИЧ взаимодействует с фибрилларином в комплексе с малой ядрышковой РНК U3 и тем самым нарушает процесс созревания пре-рРНК в ядрышках. Это, в свою очередь, нарушает жизнедеятельность поражённых клеток и может приводить к апоптозу. У других вирусов, например, у вызывающего свинку артеривируса, в ходе жизненного цикла с фибрилларином взаимодействуют белки нуклеокапсида[2]. По-видимому, фибрилларин играет решающую роль в жизненном цикле генипавируса — высокопатогенного вируса, переносимого летучими мышами. В клетках, лишённых фибрилларина, наблюдались существенные нарушения синтеза РНК и белков этого вируса[6].
Клиническое значение
Как и другие ядерные белки, фибрилларин принимает участие в регуляции процессов деления и роста клеток, поэтому нередко нарушения его экспрессии приводят к развитию раковых заболеваний. Фибрилларин является онкогеном. Сверхэкспрессия фибрилларина наблюдается в случае интраэпителиальной неоплазии простаты у мышей у человека, которая может развиться в рак простаты. В случае человеческой аденокарциномы количество фибрилларина связано с количеством белка Myc — хорошо изученного онкогена, который может взаимодействовать с фибрилларином. Превышение экспрессии фибрилларина в два раза было выявлено в клетках лейкемии и лимфомы различных типов. Показано, что p53 снижает экспрессию фибрилларина, взаимодействуя с последовательностью интрона 1 в гене фибрилларина. В клетках рака молочной железы снижение содержания p53 приводит к повышенному уровню экспрессии фибрилларина, а это, в свою очередь, увеличивает количество неправильно метилированных рРНК. Это нарушает работу рибосомы и увеличивает экспрессию онкогенов через IRES[2].
Аутоантитела к фибрилларину обнаруживаются примерно у 8 % пациентов, страдающих от системной склеродермии[1][7][8].
Примечания
- FBL fibrillarin [ Homo sapiens (human) ].
- Rodriguez-Corona U., Sobol M., Rodriguez-Zapata L. C., Hozak P., Castano E. Fibrillarin from Archaea to human. (англ.) // Biology of the cell / under the auspices of the European Cell Biology Organization. — 2015. — Vol. 107, no. 6. — P. 159—174. — doi:10.1111/boc.201400077. — PMID 25772805.
- GeneCards: FBL Gene (Protein Coding).
- UniProtKB - P22087 (FBRL_HUMAN).
- Nicol S. M., Causevic M., Prescott A. R., Fuller-Pace F. V. The nuclear DEAD box RNA helicase p68 interacts with the nucleolar protein fibrillarin and colocalizes specifically in nascent nucleoli during telophase. (англ.) // Experimental cell research. — 2000. — Vol. 257, no. 2. — P. 272—280. — doi:10.1006/excr.2000.4886. — PMID 10837141.
- Deffrasnes C., Marsh G. A., Foo C. H., Rootes C. L., Gould C. M., Grusovin J., Monaghan P., Lo M. K., Tompkins S. M., Adams T. E., Lowenthal J. W., Simpson K. J., Stewart C. R., Bean A. G., Wang L. F. Genome-wide siRNA Screening at Biosafety Level 4 Reveals a Crucial Role for Fibrillarin in Henipavirus Infection. (англ.) // PLoS pathogens. — 2016. — Vol. 12, no. 3. — P. e1005478. — doi:10.1371/journal.ppat.1005478. — PMID 27010548.
- Peterson L. K., Jaskowski T. D., Mayes M. D., Tebo A. E. Detection of anti-U3-RNP/fibrillarin IgG antibodies by line immunoblot assay has comparable clinical significance to immunoprecipitation testing in systemic sclerosis. (англ.) // Immunologic research. — 2016. — Vol. 64, no. 2. — P. 483—488. — doi:10.1007/s12026-015-8710-9. — PMID 26467972.
- Wielosz E., Dryglewska M., Majdan M. Serological profile of patients with systemic sclerosis. (англ.) // Postepy higieny i medycyny doswiadczalnej (Online). — 2014. — Vol. 68. — P. 987—991. — doi:10.5604/17322693.1117543. — PMID 25228505.
Литература
- Proteins of the Nucleolus / O'Day, Danton H, Catalano, Andrew. — Netherlands: Springer, 2013. — ISBN 978-94-007-5818-6. — doi:10.1007/978-94-007-5818-6.
- The Nucleolus / Mark O. J. Olson. — New York: Springer, 2011. — ISBN 978-1-4614-0514-6. — doi:10.1007/978-1-4614-0514-6.